血清ADMA、Cav-1水平联合血小板聚集功能检测对急性脑梗死患者END的预测价值
程 蒙 高广林 康 迪
河南省平顶山市第二人民医院检验科 467000
急性脑梗死为多个原因引起脑组织血供异常,导致脑组织出现缺血缺氧性坏死,引发神经功能障碍综合征[1]。急性脑梗死的发病率、病死率于全球排名较高,其中30%可产生早期神经功能恶化(Early neurological deterioration,END),多在发病24~72h之内产生,一旦发生END,可对临床疗效与预后产生负面影响[2-3]。脑梗死者多伴有血小板、血管内皮细胞系统、凝血、抗凝以及纤溶系统异常变化。非对称性二甲基精氨酸(ADMA)可使血管活性物一氧化氮(NO)的生成减少,致内皮功能异常、收缩血管、平滑肌细胞的增殖、脑血流调节异常[4-5]。陷窝蛋白-1(Cav-1)可调控氧化应激反应,同时参加神经元突触、血管再生及修复髓鞘等[6-7]。基于此,本文探讨血清ADMA、Cav-1水平联合血小板聚集功能(PAgT)检测对急性脑梗死患者END的预测价值。
1 资料与方法
1.1 一般资料 选取我院2019年5月—2022年1月收治的100例急性脑梗死患者为观察对象,根据美国卫生研究院卒中量表(NIHSS)评分变化分为END组(37例)和非END组(63例)。END诊断标准:发病后治疗24~48h,病情未稳定/进行性加重;瘫痪肢体肌力较入院时降低≥2级;发病72h,NIHSS分值比入院时上升≥4分;颅脑CT显示新病灶。纳入标准:符合《中国急性缺血性脑卒中诊治指南2018》[8]中的相关标准;CT、MRI等证实为急性脑梗死;未溶栓或者介入治疗;自愿参加,并签署知情同意书;符合伦理委员会与学术委员会审核。排除标准:入院时头颅影像结果有颅内血肿;颅内病变;伴严重其他系统病变;既往存在脑卒中、脑手术及脑损伤史等。
1.2 方法
1.2.1 临床资料:收集入组者的病历资料,即性别、年龄、体质量指数(BMI)、高脂血症、饮酒史等。
1.2.2 血清收集:取患者晨起静脉血5ml,于30min内离心(4℃、2 000r、15min),取血清,于-80℃下储存待检,以免血清溶血与反复冻融。
1.2.3 指标检测:酶联免疫吸附试验测血清Cav-1、ADMA水平,其中Cav-1的试剂盒购买于美国MyBioSource公司;ADMA的试剂盒购买于上海恒斐生物科技有限公司;用美国CHRMNO-LOG血小板聚集仪测PAgT,以浓度为1μmol/L的ADP作诱导剂,全血阻抗法检测。
1.3 观察指标 (1)比较两组入院时一般临床资料。(2)比较两组入院时血清ADMA、Cav-1水平及PAgT。(3)分析血清ADMA、Cav-1水平及PAgT与基线NIHSS评分及梗死体积的相关性。(4)采用Logistic分析发生END的危险因素。(5)分析不同血清ADMA、Cav-1水平及PAgT水平患者发生END危险度。

2 结果
2.1 两组入院时一般临床资料比较 两组性别、糖尿病、年龄、冠心病史、高脂血症、吸烟史、BMI、高血压、饮酒史对比,差异无统计学意义(P>0.05);两组基线梗死体积、基线NIHSS分值比较,差异存在统计学意义(P<0.05),见表1。
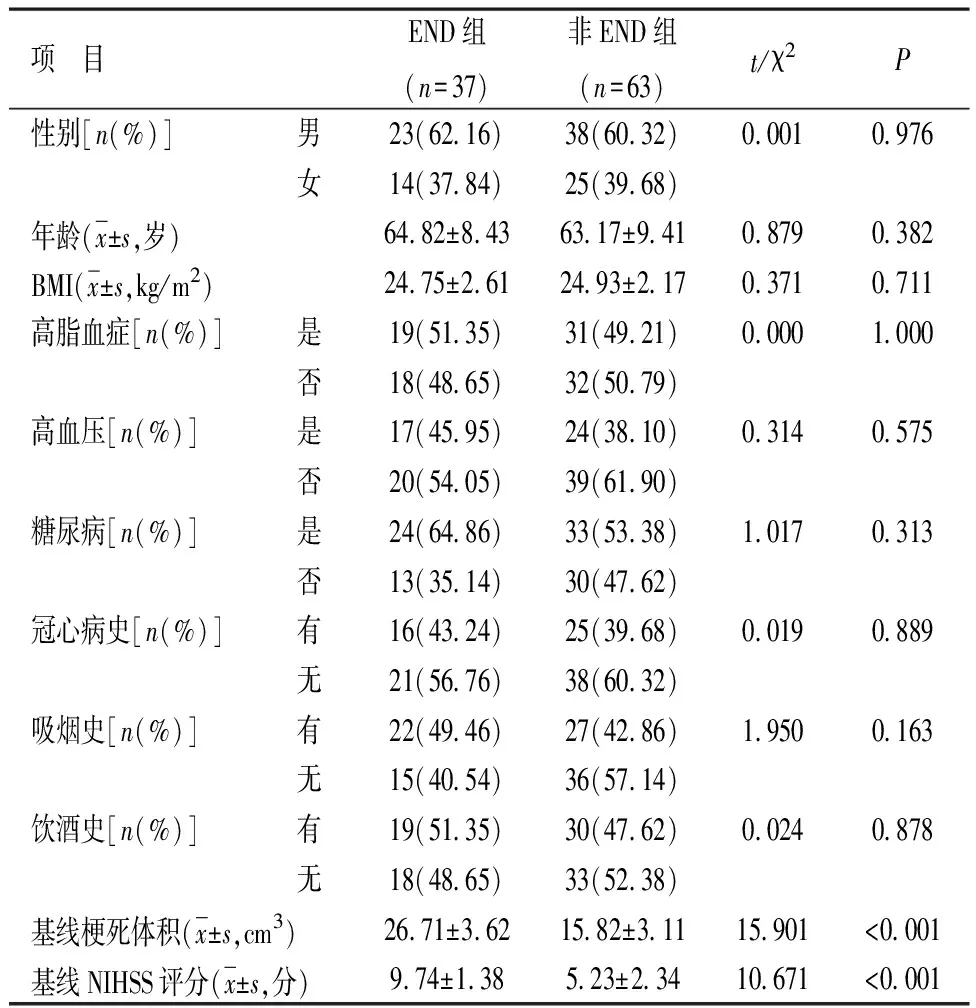
表1 两组入院时一般临床资料比较
2.2 两组入院时血清ADMA、Cav-1水平及PAgT比较 与非END组相比,END组入院时血清ADMA、Cav-1水平及PAgT均较高(P<0.05),见表2。

表2 两组入院时血清ADMA、Cav-1水平及血小板聚集功能比较
2.3 血清ADMA、Cav-1水平及PAgT与基线NIHSS评分及梗死体积相关性分析 血清ADMA、Cav-1水平及PAgT与基线NIHSS评分及梗死体积均呈正相关(P<0.05),见表3。

表3 血清ADMA、Cav-1水平及PAgT与基线NIHSS评分及梗死体积相关性分析
2.4 Logistic分析发生END的危险因素 以急性脑梗死患者是否发生END为因变量,将患者入院时血清ADMA、Cav-1水平及PAgT作为自变量,对自变量进行赋值(以100例的平均值为界:≤平均值=1,>平均值=2)。Logistic回归分析显示,将基线NIHSS评分、梗死体积因素控制后,入院时血清ADMA水平(>0.91μmol/L)、Cav-1水平(>21.81ng/ml)、PAgT(>69.62%)仍为急性脑梗死患者发生END的危险因素,见表4。

表4 Logistic分析发生END的危险因素
2.5 各指标不同水平患者发生END危险度分析 以血清ADMA、Cav-1水平及PAgT的平均值为界,将急性脑梗死患者分为高水平、低水平,结果显示ADMA、Cav-1、PAgT高水平患者发生END危险度是低水平的1.857、2.735、1.876倍(P<0.05),见表5。

表5 各指标不同水平患者发生END危险度分析
3 讨论
ADMA属于心脑血管病变的血管内皮细胞功能紊乱的因子,可非选择性地抑制内皮细胞释放NO,下调NO释放量,引发血管腔狭窄、内皮作用紊乱、细胞增殖、动脉硬化、微循环血栓等[9]。本文中END组入院时血清ADMA水平含量偏高,且和基线NIHSS评分、梗死面积成正比,并属于引发END的独立危险因素,能增加END的发生风险,由此可知,ADMA参与脑梗死的发生,表达水平和发生END存在一定关联性,原因可能为,由于ADMA的高水平表达可导致血管内皮能力出现紊乱,致血管狭窄,使脑血管梗死者出现急性脑梗死,且ADMA可引起HBMEC受损,抑制氧化应激,加重炎症,提升ADMA释放,加剧NO含量的减少,进而出现恶性循环,引发END[10]。本文中,END患者PAgT偏高,为END发生的独立危险因素,增加END的发生率,且PAgT和基线NIHSS评分和梗死体积成正比,可知PAgT在脑梗死患者发生END中起到一定作用,其原因可能为血小板分泌多个物质可加快血栓形成速度,加剧脑组织缺血缺氧损伤度,有助于END发生。急性脑梗死患者伴有脑组织缺血,而脑血管再灌注损伤可引发神经血管单元损坏,以往研究指出,脑缺血再灌注损伤可导致神经血管单元损伤的主要原因是,低灌注组织的毛细血管、血脑屏障损伤、炎症介质和氧自由基生长,其中血脑屏障损伤能加剧脑水肿,扩大缺血半暗带,增加END发生风险[11-12]。本文结果显示,END患者的血清Cav-1水平较高,且高水平的Cav-1是发生END的危险因素,同时能反映梗死体积与基线NIHSS评分,提示NED患者血脑屏障损伤度较大、脑水肿度更重。
综上所述,急性脑梗死END患者和血管内皮损伤、血小板聚集功能加强、血脑屏障损伤与脑水肿等多个因素有关,而ADMA、Cav-1、PAgT可作为临床预测END的指标,便于临床早期制定防治措施。

