4个品种草莓茎尖组培快繁体系的构建
王晓芳,宗晓娟,常元胜,姜莉莉,田中 一久,武冲*
(1.山东省果树研究所,山东泰安 271000;2.徂汶景区化马湾乡政府,山东泰安 271042)
草莓种苗质量是影响草莓产业化发展的关键因素之一[1]。传统自繁自育的育苗方式导致草莓种苗种性退化、繁殖系数降低、易感病、产量降低等问题,且因连作和长期营养繁殖导致植株体内积累各种病毒,生长速度慢,抗逆、抗病虫害能力减弱,果实产量和品质严重下降[2]。植物组培快繁技术具有不受季节限制、培养周期短、易于规模化生产等优点,尤其在解决植物脱毒方面具有显著的优势。采用组培快繁技术培育的草莓种苗具有长势强、产量高等优点[3]。
红颜、章姬、香野和粉玉是当前生产上的主栽的草莓品种或是发展前景比较好的品种,产量高、品质好、抗逆、抗病虫害能力强。虽然有关草莓茎尖组培的研究比较多,但关于筛选这4个品种最佳快繁条件的报道相对较少,因此,本研究以前期筛选比较适宜草莓茎尖生长的培养基为基础,研究4个品种草莓在培养基上的生长表现及驯化移栽表现,确定最佳的组织培养和移栽基质,以期为草莓组培快繁生产提供技术支撑。
1 材料与方法
1.1 材料来源
供试草莓品种为红颜、章姬、香野、粉玉,匍匐茎茎尖取自山东省果树研究所金牛山试验基地草莓大棚。露地栽培可于5~6月进行取材,7月雨季之后取材接种时易被污染。设施栽培有匍匐茎时都可取材。
剪取选择生长健壮无病虫害侵染的草莓匍匐茎,长度保留8~10 cm左右,采后用湿报纸包裹,装入封口袋中,标记好品种,放入带冰袋的盒子中,及时带回试验室,如不能及时接种,将湿报纸包裹的匍匐茎置于4 ℃冰箱保存备用,不超过2 d。
1.2 培养基配制
前期筛选的培养基配方为MS+0.5 mg/L 6-BA+0.1 mg/L IBA,pH值5.6±0.05,每升培养基添加25 g蔗糖和6 g琼脂,121 ℃灭菌30 min,配方根据前人试验结果适当调整[4]。此培养基用做初代培养基和继代增殖培养基,初代培养使用培养皿(直径9 cm),每皿倒入20 mL左右培养基;继代培养使用带盖玻璃组培瓶(高9.5 cm、直径6.6 cm),每皿倒入50 mL左右培养基。在试验过程中发现红颜和粉玉在此培养基上诱导培养时易发生玻璃化,对6-BA的浓度进行调整,初代培养基为MS+0.3 mg/L 6-BA+0.1 mg/L IBA,继代增殖培养基为MS+0.2 mg/L 6-BA+0.1 mg/L IBA,pH值5.6±0.05,每升培养基添加25 g蔗糖和6 g琼脂。
生根培养基配方为1/2 MS培养基,不添加植物生长调节剂,pH值5.6,每升培养基添加25 g蔗糖和6 g琼脂,参考前人方法略有调整[5]。
1.3 外植体消毒处理
所取匍匐茎保留茎尖剪成长约3 cm的小段(图1),先用洗洁精轻轻搓洗30 s,再用流动的自来水持续冲洗30 min,之后在超净工作台中用75%的酒精消毒30 s,无菌水冲洗3次,再用1%次氯酸钠浸泡灭菌7~10 min,无菌水冲洗5次[6]。经试验证明这样可以将污染率控制在2%以内,实际操作过程中清洗和消毒时间长短可视茎段幼嫩程度适当增减,但要掌握好消毒时间,时间太短灭菌效果不理想,接种后易造成大量污染;时间太长易接种后易发生褐化,影响接种成活率。

图1 做外植体的草莓匍匐茎茎尖
1.4 茎尖培养
将灭菌后的茎段放在灭过菌的滤纸上,置于培养皿中,吸收多余水分。将消毒的茎段放到灭菌的培养皿上,一只手用镊子固定茎段,另一只手使用消毒的解剖针先剥去外面较大的幼叶,在电子显微镜下将幼嫩的幼叶逐层剥去,直至露出半圆球形顶端分生组织,切取0.3~0.4 mm大小茎尖接种于初代培养基上进行培养,每皿接种8~10个茎尖,5个培养皿为1组,重复3次。接后密封,放置在组培架上培养。组培室保持温度(25±2) ℃,湿度45%~50%,接种后先暗培养1~2 d,随后在光照强度2 000~3 000 lx,光照时长12~16 h/d条件下培养。初代培养15 d后统计成活率,30 d后统计诱芽率。
1.5 增殖继代培养
在培养皿上用消毒的解剖刀将茎尖诱导出的丛生不定芽分割成小的芽丛,转接到继代培养基上进行增殖培养,3~5丛/瓶,计算增殖系数。5瓶为1组,重复3次。放置到组培架上光照下培养,培养温度、光照强度和光照周期等其他培养条件与初代培养相同,每隔25~30 d继代1次。培养1个月左右,按需要生根或二次继代。一般继代次数不超过5次,否则幼苗生长弱化。
1.6 生根培养
挑选继代培养的高度3~5 cm、长势较好的组培苗在超净工作台中转入生根培养基。放置到组培架上光照下培养(环境条件与1.4所述一样) ,在培养室培养30 d左右,观察各品种幼苗根部生长情况,计算生根率。
1.7 炼苗及移栽
组培苗在移栽前需要进行锻炼,以适应外部环境。组培瓶空间小,遇较强的光照容易使其内部温度快速升高,会导致草莓叶片发生灼烧枯干。因此要采取恰当的炼苗措施,炼苗时逐渐打开培养瓶盖,使幼苗逐步适应外部环境。
生根30 d后准备炼苗移栽,炼苗时先拧开瓶盖但不打开,放置1 d,第2 d天半敞开瓶盖,放置2 d,第4 d全部打开瓶盖炼苗2 d,组培小苗茎秆由绿色变为略带红色,栽植成活率高。移栽时(室内温度23 ℃)将根系发达、生长健壮的生根苗从组培瓶中取出,清洗去除根部多余的培养基,将其栽入穴盘中,提前将蛭石填入草莓专用32孔育苗穴盘,穴盘下放置托盘,提前在托盘中浇水,使蛭石湿润,利于组培苗成活。栽植后先扣带孔的塑料盖2 d,然后揭开适应5 d,期间保持基质湿润,利于萌发新根。缓苗结束后统计移栽成活率。
1.8 数据统计
成活率(%)=接种成活的外植体数/接种的总外植体数× 100
诱芽率(%)=诱导出不定芽的外植体数/接种成活的总外植体数× 100
增殖系数=增殖的不定芽数/接种的不定芽总数
生根率(%)=生根苗数/接种苗数×100
移栽成活率(%)=移栽成活的植株数/移栽植株的总数×100
试验所得数据采用Microsoft Office Excel 2010处理并制表; 运用SPSS 19.0软件进行数据统计分析。结果差异性显著分析是通过单变量方差分析(ANOVO) 结合邓肯检验在P<0. 05的显著水平上实现。
2 结果与分析
2.1 诱导培养基对4个品种草莓茎尖培养的影响
生长30 d左右统计茎尖培养情况,从图2可看出,在MS+0.5 mg/L 6-BA+0.1 mg/L IBA培养基上,4个品种均能够成活,成活率差异不明显,章姬、香野成活率较高,分别为86.7%、87.5%,且长势较旺,诱芽率分别为84.9%、79.9%,不定芽生长较健壮。红颜、粉玉成活率分别为80.8%、80.0%,诱芽率分别为76.3%、72.8%,诱导形成的不定芽多,但生长较弱,出现玻璃化现象。

图2 同一培养基对4个品种草莓茎尖诱导成活率及诱芽率的影响
2.2 增殖培养基对4个品种草莓幼苗增殖的影响
由表1可看出,4个品种在与接种培养基配方一样的培养基上(MS+0.5 mg/L 6-BA+0.1 mg/L IBA)增殖表现差异较大。红颜和粉玉茎尖增殖系数高,平均分别为6.7和6.9,与章姬和香野差异明显。但其株高较矮,生长弱,显著低于章姬和香野。总体生长情况看,此培养基更适合章姬和香野,增殖系数分别为5.4、4.6,且组培幼苗株高在5 cm左右,生长健壮。
2.3 红颜和粉玉在新培养基上的生长表现
在MS+0.5 mg/L 6-BA+0.1 mg/L IBA培养基上,红颜和粉玉两个品种表现不定芽产生较多,但生长弱,出现玻璃化,更换培养基后,在诱导培养基上MS+0.3 mg/L 6-BA+0.1 mg/L IBA表现不定芽分化正常,生长健壮,无玻璃化发生(表2)。在继代增殖培养基上MS+0.2 mg/L 6-BA+0.1 mg/L IBA二者的增殖系数分别为5.2、4.6,株高在5 cm以上,生长健壮。
2.4 生根培养基对4个品种草莓幼苗生根的影响
在继代培养基上培养30 d左右进行生根培养。在不添加植物生长调节剂的1/2 MS培养基上培养,培养条件与增殖培养时相同,生根30 d左右,观察各品种生根情况。从表3可看出,此培养基对4个品种草莓组培苗的根系诱导效果都比较好,生根率均在83%以上,以章姬生根率最高,为90.83%(图3)。平均生根条数为4~6条,根长在9~13 cm左右,且根系生长健壮,各品种间无明显差异。

表3 同一培养基对4个品种草莓组培苗生根的影响

图3 章姬草莓生根1个月后的根系生长情况
2.5 4个品种草莓幼苗炼苗移栽效果
从图4可看出,采用蛭石作为基质进行移栽,4个品种草莓移栽成活率均在95%以上,章姬的成活率最高,为98.6%;红颜最低,为95.5%。
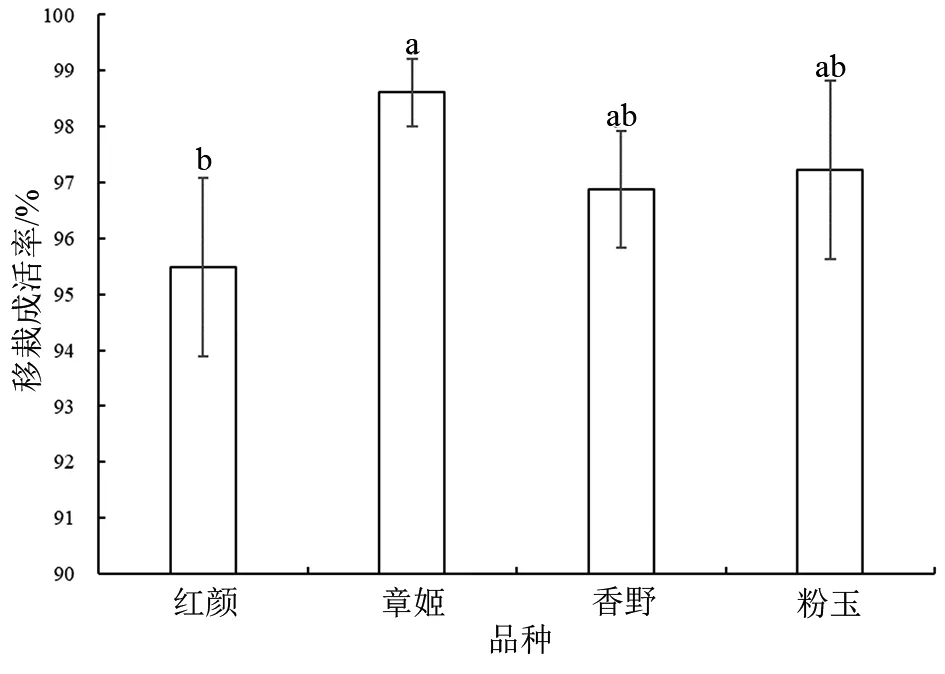
图4 4个品种草莓的移栽成活率
3 小结与讨论
本研究结果表明,在同一茎尖诱导培养基中,4个品种草莓的茎尖成活情况差异较大,MS+0.5 mg/L 6-BA+0.1 mg/L IBA培养基适合章姬、香野,红颜、粉玉茎形成不定芽化较多,但生长较弱,有玻璃化情况发生,二者在MS+0.3 mg/L 6-BA+0.1 mg/L IBA培养基上更为适宜,不定芽生长正常,无玻璃化,说明不同草莓品种茎尖对植物生长调节剂的需求稍有差异。李志强等研究发现培养基MS+0.5 mg/L 6-BA+0.02 mg/L NAA 适宜红颜、章姬草莓茎尖生长[7]。韩如春等研究发现仅添加6-BA情况下,茎尖也可以萌发,但诱芽率低,当6-BA质量浓度为0.3 mg/L时,红颜品种的诱芽率较高,隋珠品种则是在6-BA质量浓度为0.5 mg/L时诱芽率最高[4],与本研究结果一致。本研究中章姬和香野适宜的增殖培养基为MS+0.5 mg/L 6-BA+0.1 mg/L IBA,这与张玲等[8]的研究结果一样。红颜和粉玉适宜的增殖培养基为MS+0.2 mg/L 6-BA+0.1 mg/L IBA。说明不同品种草莓增殖所需的植物生长调剂有差异。
本研究中4个品种草莓采用1/2 MS培养基均较易生根,与前人研究结果一致,张建盈等[9]研究发现,不添加IBA的1/2 MS是白雪公主草莓最适宜的生根培养基,生根率达100%,平均生根数为10条,平均根长为5.00 cm。颜昌敬[10]表示草莓试管苗比较容易生根,在无植物生长调节剂的培养基上就能长出大量根系,添加0.1 mg/L NAA后发根量反而减少。这说明在组培苗生根阶段培养基中过多的基本元素和生长调节剂可能会影响根部的正常生长。采用蛭石进行移栽,4个品种草莓组培苗的成活率均在95%以上,无污染情况发生,生长健壮,是适宜草莓组培苗移栽驯化的良好基质。
本研究中对培养基配方进行了调整,蔗糖和琼脂加入量减少,能够保证组培苗正常生长的同时,降低组培快繁的成本,同时在保证正常生长的情况下添加植物生长调节剂的浓度尽量降低,降低成本及遗传变异的风险。有研究表明,当6-BA的浓度为0.2~0.5 mg/L时有利于草莓的不定芽增殖[11,12],浓度过高会导致植株玻璃化和畸形生长[13,14],大于1.0 mg/L时容易引起植株的表型和遗传变异[15],给草莓生产带来风险。因此,下一步要对草莓茎尖快繁组培苗的遗传变异及病毒检测进行深入研究。

