雌二醇和黄体酮对猪精液冷冻保存效果的影响
姜炜彦 张碧掎
摘 要:人工授精技术的发展使优良种公畜的基因得以延续,在畜禽养殖中占有越来越重要的地位,而精液的保存技术也相得益彰。本试验通过在基础稀释液中分别添加不同浓度的雌二醇和黄体酮,初步研究了生殖激素对猪精液冷冻保存效果的影响。结果显示,雌二醇、黄体酮对猪精液冷冻保存后精子活率和活力的维持均有一定效果,最适浓度分别为10、200 ?g/mL,但在细胞膜完整性方面没有突出效果。
关键词:猪精液;冷冻保存;雌二醇;黄体酮
中图分类号:S828 文献标志码:A 文章编号:1001-0769(2023)05-0030-04
生殖激素在猪的繁殖中起着重要作用。精液中的激素水平对雄性动物的精子生成能力、精液品质好坏、精子的受精能力以及抗冻能力等有重要的影响,其中有紧密联系的是生殖激素[1]。此外,在精液穿越雌性动物生殖道的过程中,雌激素可能与精子相互作用,如生精上皮缺乏雌激素可导致精子细胞分化产生障碍[2],从而影响精子的运动、获能、受精的各项功能。其中黄体酮对子宫内膜有着显著的形态学影响,是一种维持妊娠的必需激素[3]。而雌二醇对精子的激活有着举足轻重的作用,可以通过升高精子胞浆内的Ca2+浓度维持精子的功能[4]。朱首伦[5]通过研究黄体酮注射液对人类精子的作用效果,发现精子膜上存在着一个孕酮门,可以激起Ca2+内流,从而增强精子的活力。生殖激素在精液体外保存中扮演着至关重要的角色,给精液冷冻保存技术的研究带来了新的突破点。本试验通过运用雌二醇和黄体酮这两种生殖激素,研究其在猪精液冷冻保存中产生的影响效果。
1 材料与方法
1.1 材料
1.1.1 精液来源
新鲜公猪精液由湛江市遂溪县建新镇高丰种猪场提供,约一周对种公猪采精一次,用于试验的精子活力不低于70%。
1.1.2 主要试剂与药物
葡萄糖、一水合柠檬酸、二水合柠檬酸三钠、丙三醇购自广东光华科技股份有限公司,果糖购自上海圻明生物科技有限公司,硫酸阿米卡星购自齐鲁制药有限公司,苯甲酸雌二醇、黄体酮购自宁波第二激素厂,三羟甲基氨基甲烷购自国药集团化学试剂有限公司,氨基-钠-十二烷硫酸酯购自日本,卵黄取自于鸡蛋,液氮购自湛江市制氧厂。
1.1.3 主要仪器
电热恒温水浴锅购自上海科恒实业发展有限公司,数显恒温电热板购自常州市金坛区白塔新宝仪器厂,电子分析天平购自常熟市双杰测试仪器厂,Nanopure Life Science超纯水器购自赛默飞世尔科技有限公司,立式压力蒸汽灭菌锅购自上海博迅有限公司,双目生物显微镜购自南京江南永新光学有限公司,数显鼓风干燥箱购自上海博迅实业有限公司医疗设备厂,台式高速离心机购自湖南赫西仪器装备有限公司,离心管(1.5、15、50 mL)、一次性移液枪枪头、移液枪(5、10、50、200、 1 000 ?L均购自北京诺博莱德科技有限公司,滤纸,蛋清分离器,冰箱。
1.2 方法
1.2.1 精液采集
本试验以手握法对种公猪进行采精操作。为防止温差过大造成精子死亡,在精液采集前35~37 ℃预热采精杯,采精杯上覆盖滤纸,滤纸微孔约100 ?m,精子可通过并可滤去精液中的胶体物质。采精时只收集中间浓厚乳白色的精液,弃去前面较稀的精清,以四层以上的纱布过滤掉胶粒物质,但应防止纱布中的棉屑脱落,以免破坏精液品质[6]。检查前需将精液放在 37 ℃水浴锅中预热。精液的品质检查包括外观、气味、活力三方面。然后用基础稀释液将精液稀释至所需浓度,分装于冰箱保存备用。
1.2.2 稀释液配制
稀释液Ⅰ的配制:精确称取0.4 g葡萄糖、1.59 g一水合柠檬酸、2.9 g三羟甲基氨基甲烷于烧杯中,加入200 ?L硫酸阿米卡星,然后加入20 mL超纯水进行溶解。将卵黄与蛋清分离,用滤纸将卵黄上的蛋清吸干后,用移液枪吸取卵黄加入溶液中,其比例为基础稀释液配方的20%,最后用超纯水定容至 100 mL,轻轻混匀,避免产生过多泡沫。分装后,3 000 r/min离心20 min,留上层清液,5 ℃密封保存。
稀释液Ⅱ的配制:取47 mL稀释液Ⅰ,加入3 mL丙三醇和0.3%的氨基-钠-十二烷硫酸酯,充分摇匀后,5 ℃密封保存。
1.2.3 试验设计与精液保存
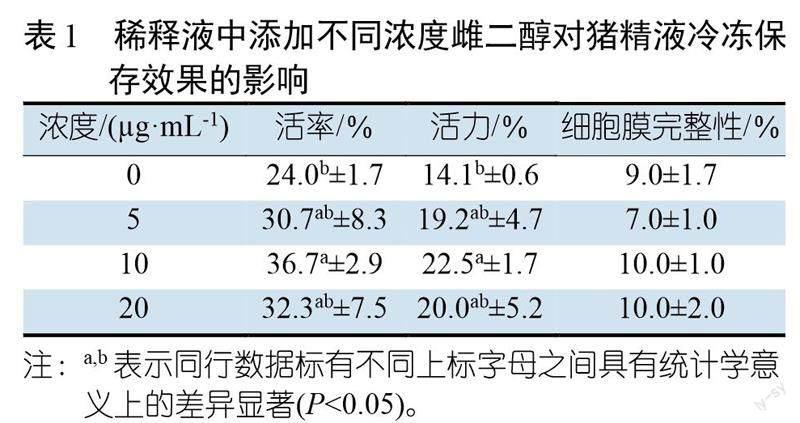
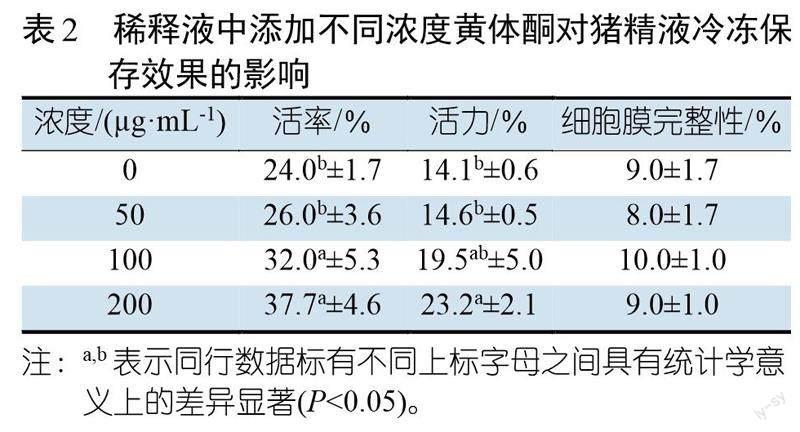
试验共分三个组,分别为雌二醇组、黄体酮组和空白对照组,其中雌二醇组和黄体组各设三个重复。雌二醇组三个重复所用的稀释液Ⅰ中分别添加5、10、20 μg/mL的雌二醇,黄体酮组三个重复所用的稀释Ⅰ中分别加入50、100、200 μg/mL的黄体酮,空白对照组所用稀释液中不添加任何生殖激素。
将稀释液Ⅰ于30 ℃水浴锅中预热。将合格精液分装于离心管,2 000 r/min离心10 min,弃去上清液,将下层精子集装在广口瓶中,用血球计数板测定精子浓度。用稀释液Ⅰ将精子稀释到2×108个/mL左右,做好标签(命名为稀释液Ⅰ-Ⅰ),封口,5 ℃保存。15 min后将稀释液Ⅰ-Ⅰ与稀释液Ⅱ以1∶1混合,5 ℃放置2 h,分装入精液细管。准备一个装有液氮的泡沫箱,上漂浮一个泡沫板,将装有精液的精液细管置于泡沫板上约15 min后放入液氮,待冻后,迅速放入液氮罐中保存。
1.2.4 精液品質检测
精子活率
精子活率是指精液中活精子的比例,若精子活率低下,则无需进行试验。活率的检测可使用目测法,即观察3个视野内活精子数占总精子数的百分比,取平均值。
精子活力
精子活力是检测精液品质的重要指标之一。精子的运动状况一般分为5种:①快速直线运动,活力为100%,标记为“+++”; ②较为缓慢直线运动,活力为75%,标记为“++”;③缓慢运动,活力为50%,标记为“+”;④原地转圈运动,活力为25%,标记为“±”;⑤基本不动或精子死亡,活力为0,标记为“-”。精子对温度十分敏感,检查精子活力时,需要将精液细管同装有液氮的广口瓶一同从液氮罐中取出,放进装有液氮的泡沫箱中,以免造成温差过大影响后续的试验结果。将精液细管放入39.5 ℃的恒温水浴锅中预热3 s,取出,用剪刀先将下端剪开,再剪开上端,使细管中的精液流入水浴锅中漂浮板上的1 mL离心管,备用观察。载破片和盖破片预热至39.5 ℃。吸取10 ?L待检精液在载玻片上,盖上盖玻片,显微镜下观察精子活力,约观察3个视野内的精子活力,记录数据,结果取平均值。
精子细胞膜完整性
检测精子细胞膜完整性常见的方法有常规染色法、荧光染色法以及低渗肿胀试验[7]。其中低渗肿胀试验因成本低廉、操作简单,广为应用。该方法可直观反映精子细胞膜的功能状态[8]。
配制HOST低渗溶液。将装在1 mL离心管中的精液2 000 r/min离心5 min,去上清液,加入90 ?L的HOST低渗溶液,反复吹吸均匀,静置10 min,取10 ?L待检液于显微镜下观察。随机检测3~5个视野内精子尾部肿胀情况,尾部卷曲表示细胞膜完整,视野内精子数必须超过200个,记录数据,取平均值。
2 试验结果
2.1 雌二醇对猪精液冷冻保存效果的影响
表1显示,稀释液中添加不同浓度的雌二醇对猪精液冷冻保存后的精子活率和活力的维持均有有益的影响,与对照组精液相比差异显著(P<0.05),其中雌二醇的最适浓度是 10 ?g/mL。但是雌二醇对猪精子细胞膜完整性的保护效果不显著(P>0.05)。
2.2 黄体酮对猪精液冷冻保存效果的影响
表2显示,稀释液中添加不同浓度的黄体酮对猪精液冷冻保存后的精子活率和活力的维持均有有益的影响,与对照组精液相比差异显著(P<0.05),其中黄体酮的最适浓度是 200 ?g/mL。但是黄体酮对猪精子细胞膜完整性的保护效果不显著(P>0.05)。
2.3 两种激素对猪精液冷冻保存效果的对比
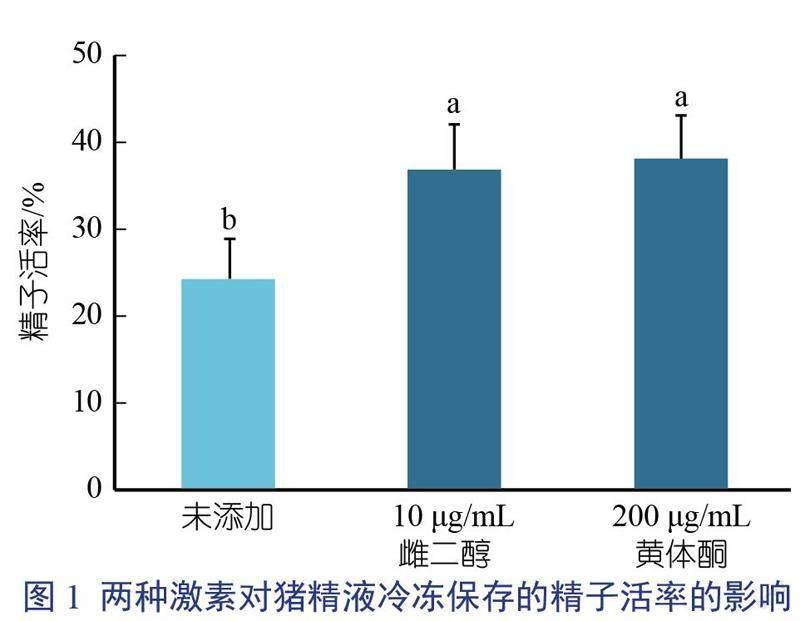
由图1可知,稀释液中添加10 ?g/mL雌二醇或200 ?g/mL黄体酮均有利于维持猪精液冷冻保存后的精子活率,与对照组精液相比差异显著(P<0.05),但两种激素对精液冷冻后精子活力的保存效果差异不显著。
由图2可知,稀释液中添加10 ?g/mL雌二醇或200 ?g/mL黄体酮均有利于维持猪精液冷冻保存的精子活力,与对照组精液相比差异显著(P<0.05),但两种激素对精液冷冻后精子活力的保存效果差异不显著。
3 讨论
3.1 雌二醇保存效果的分析
精子在冻融过程中会形成冰晶,受到一定的损害,导致精子的超微结构改变和新陈代谢紊乱。而雌激素可以增加精子细胞膜和线粒体膜的稳定性,促进精子细胞的分裂、增殖以及分化,减少细胞凋亡。研究证明,稀释液中添加一定浓度的雌二醇可减少冷冻保存中精子细胞凋亡,延长精子存活时间,提高其运动能力和卵膜穿透力,使精子活力增强,对冻融后精子的各項功能恢复有有益作用。雌二醇还能作用于精子膜上的雌激素受体,提高精子内Ca2+的浓度,激活腺苷酸环化酶信号通路。在本试验中,稀释液中加入雌二醇可明显降低冷冻保存对精子质量的损伤,证明雌二醇对冻融后精子激活、保护和功能的恢复有利。
3.2 黄体酮保存效果的分析
黄体酮是一种由卵巢黄体分泌的天然孕激素,能促进精子获能和诱导顶体反应。有研究表明,精子膜上存在着一个由孕酮门控制的Ca2+通道,添加黄体酮能刺激Ca2+内流,使精子内Ca2+浓度增加。Ca2+作为细胞内第二信使,在精子各生理过程中起着关键作用,可以增强精子运动。精子尾部最敏感,冻融会导致鞭毛的轴丝结构受到损伤,从而影响精子活力。精子尾部的Ca2+通道发挥着关键作用。Ca2+可以调节精子鞭毛运动。鞭毛中的Ca2+可以影响动力蛋白臂的滑动,使鞭毛不断地进行摆动运动。因此,黄体酮有助于精子冻融后功能的恢复。
4 结论
综上所述,稀释液中加入一定浓度的雌二醇或黄体酮对对冷冻保存精液中的精子具有一定的保护效果,有益于猪精液冻融后精子活率和活力的维持,但对猪精子细胞膜完整性的保护效果不显著。雌二醇和黄体酮的最适浓度分别为10 ?g/mL和200 ?g/mL,这为临床上通过运用生殖激素改善精子质量来提高人工授精率提供了一定的试验依据。
参考文献
[1] 常万存.精液中生殖激素的研究进展[J].黄牛杂志,1998,24(4):29-32.
[2] BALDI E.Genomic and nongenomic effects of estrogens:molecular mechanisms of action and clinical implications for male reproduction[J].Journal of Steroid Biochemistry and Molecular Biology,2002,80(4-5):369-381.
[3] 殷常康.孕酮对人精子质量参数影响的试验研究[J].山东医学高等专科学校学报,2013,35(6):436-438.
[4] 何彦芳,岳利民,何亚平.雌激素对人精子胞浆内游离钙离子浓度的影响[J].四川生理科学志,2006,28(1):15-17.
[5] 朱首伦.不同浓度黄芪、丹参、黄体酮注射液对精子内Ca2+作用研究[D].广州:广州中医药大学,2010.
[6] 张梦颖,娜日娜.人工采集种公猪精液的科学方法[J].黑龙江动物繁殖,2016,24(1):21-22.
[7] 渊锡藩.日本评定精子活力和生存率的方法[J].国外畜牧科技资料,1976(2):17-19.
[8] 白修云,王有柱,李向臣,等.哺乳动物精子质量检测原理及方法[J].中国畜牧兽医,2007,34(9):24-28.

