贝莱斯芽孢杆菌BR-01菌株高产抗菌肽培养基的优化及其抗菌肽的鉴定*
周健平,谢云巧,廖雨虹,李昕洋,李一鸣,李淑萍,马修国,雷诗敏,林 菲,
姜 伟2**,何勇强1,2**
(1.广西大学农学院,广西南宁 530004;2.亚热带农业生物资源保护与利用国家重点实验室(广西大学),广西大学生命科学与技术学院,广西南宁 530004;3.亚热带农业生物资源保护与利用国家重点实验室(华南农业大学),华南农业大学植物保护学院,广东广州 510642)
水稻(OryzasativaL.)是三大主要粮食作物之一,是全世界接近一半人口的主食,也是重要的工业原料之一[1]。水稻细菌性条斑病(Rice bacterial leaf streak)简称条斑病,俗称红叶病,是由稻黄单胞菌稻生致病变种[水稻细菌性条斑病菌(Xanthomonasoryzaepv.oryzicola,Xoc)]侵染引起的一种细菌性病害。水稻发病后,造成条形叶斑、叶尖枯,光合作用下降,影响谷粒灌浆,一般减产15%-25%,严重时可达40%-60%[2]。该病已经成为我国黄河以南多个稻区的主要水稻病害之一,严重影响水稻的安全生产。Xoc属于外来入侵物种,是我国重要的检疫对象之一[3]。鉴于目前尚缺少高抗细菌性条斑病的水稻品种[3],该病的防控主要依靠农业措施和化学防治。尽管化学防治以其方便、快速、效果显著等特点在水稻病害防治中发挥着重要作用,然而许多化学制剂有不可忽视的副作用,如化学残留物、环境污染和害虫抗性,显然不符合农业可持续发展的要求。而生物防治是一种可持续的、实用的植物病害管理方法,是水稻病害防治的一种很有前途的替代策略[4]。
芽孢杆菌是一种厌氧或兼性厌氧、杆状、内生孢子的细菌,广泛分布于整个环境中,是水稻生产中常用的生物防治剂,一般通过产生抑菌蛋白或抗菌肽等发挥其生防作用[5,6]。解淀粉芽孢杆菌(Bacillusamyloliquefaciens)Lx-11能够产生表面活性素(Surfactin)、杆菌霉素(Bacillomycin)和丰原素(Fengycin) 3类脂肽类抑菌物质,盆栽实验证明Surfactin在控制Xoc侵染的过程中发挥了关键作用[7]。黄梦桑等[8]从辣椒根际土壤中分离筛选到对Xoc和水稻白叶枯病菌(X.oryzaepv.oryzae,Xoo)具有拮抗活性的高地芽孢杆菌(B.altitudinis) 181-7。AntiSMASH软件预测结果显示,181-7菌株中含有多个抑菌活性代谢产物基因簇,包括地衣杆菌素(Lichenysin)、溶杆菌素(Bacilysin)、Fengycin、细菌素(Bacteriocin)等。贝莱斯芽孢杆菌(B.velezensis) 504对黄单胞菌属的细菌具有较好的抑菌活性,基因预测结果显示,B.velezensis504含有fenA、dhbA、sfrAA、bmyA、beaS、dfnA及bacA等编码脂肽类和聚酮糖类抑菌化合物的基因簇[5]。B.velezensis是芽孢杆菌属的一个新种[9]。研究表明,B.velezensis的许多菌株具有抑制水稻病原菌生长和促进植物生长的能力。这些能力在很大程度上依赖于其产生的次级代谢产物,如环脂肽(Surfactin、Bacillomycin D、Fengycin等)和聚酮类化合物[大环内酰亚胺(Macrolactin)、杆菌烯(Bacillaene)和地非西丁(Difficidin)等][10-12]。
生防菌从研究成果转化为应用产品需要阶梯式的试验与开发。发酵是影响生防菌研究与应用的重要因素,在微生物发酵过程中,不同的培养基成分和发酵条件对其生长速度、菌体量及抗菌活性物质的产出等具有显著影响。石慧敏等[13]通过优化发酵工艺,使B.velezensisYH-18的芽孢产量较LB (Luria-Bertani)初始培养基提高9.48倍。张晓云等[14]使用熊果苷作为菌株B.subtilisBAB-1产Surfactin的碳源,其Surfactin产量达到以葡萄糖为碳源时的3倍。乔俊卿等[15]利用响应曲面法优化菌株B.subtilist-500的产抗菌肽培养基后,成功检测到菌株在初始发酵培养基中不能生产的Fengycin。此外,即使是同一个种、属的不同菌株,其最适发酵条件也往往因为菌株不同的遗传背景、生理生化特性及环境适应性而存在差异[16,17]。以近年来报道的B.velezensis菌株最适发酵条件为例,杨可[18]优化B.velezensisTCS001菌株的最佳发酵条件为温度25 ℃、发酵培养时间36 h;黎燕珊等[16]报道B.velezensisHC-8菌株的最佳发酵条件为温度37 ℃、发酵培养时间48 h;郭艳霞等[19]研究发现B.velezensisYB19菌株的最适培养温度和时间分别为32 ℃和28 h。目前,国内外已经有许多关于生物防治水稻细菌性条斑病的研究,但是详细的发酵条件研究还比较缺乏。
本课题组前期研究发现,从中药材土贝母块茎内分离获得的B.velezensisBR-01菌株对Xoc具有良好的拮抗效果,但还需要发酵数据支持下一步的研究与开发。本研究以B.velezensisBR-01菌株无菌发酵滤液对Xoc的抑菌圈直径为因变量,通过提高发酵滤液的抑菌活性来间接提高抗菌肽的浓度,并使用液相色谱-质谱联用(Liquid Chromatography-Mass Spectrometer,LC-MS)技术鉴定抗菌肽,为该菌株进一步的理论研究及后续的大田生防实验提供理论基础。
1 材料与方法
1.1 材料
1.1.1 供试菌株
水稻细菌性条斑病菌(X.oryzaepv.oryzicola)GX01,由亚热带农业生物资源保护与利用国家重点实验室提供。贝莱斯芽孢杆菌(B.velezensis)BR-01菌株分离自中药土贝母的块茎组织,在前期的实验中已证明其对水稻细菌性条斑病菌具有较好的拮抗效果,菌株由本实验室筛选、保存及鉴定。
1.1.2 供试培养基
LB培养基:酵母提取物5.0 g/L、蛋白胨10.0 g/L、NaCl 5.0 g/L;NB (Nutrient Broth)培养基:牛肉膏3.0 g/L、酵母提取物 1.0 g/L、蛋白胨5.0 g/L;PDB (Potato Dextrose Broth)培养基:马铃薯浸粉3.0 g/L、葡萄糖20.0 g/L;Landy培养基:L-谷氨酸5.0 g/L、酵母提取物1.0 g/L、L-苯丙氨酸2 mg/L、葡萄糖20.0 g/L、KH2PO41.0 g/L、KCl 0.5 g/L、MgSO4·7H2O 0.5 g/L、FeSO4·7H2O 0.15 g/L、CuSO4·5H2O 0.16 mg/L、MnSO45 mg/L;YSP (Yeast Sucrose Peptone)培养基:蛋白胨2.0 g/L、酵母提取物1.0 g/L、蔗糖4.0 g/L;CM (Complete Medium)培养基:葡萄糖5.0 g/L、(NH4)2SO42.0 g/L、柠檬酸钠1.0 g/L、MgSO4·7H2O 0.2 g/L、K2HPO44.0 g/L、KH2PO46.0 g/L;NYBD (Nutrient Yeast Beef Dextrose)培养基:牛肉膏8.0 g/L、酵母提取物5.0 g/L、葡萄糖10.0 g/L。以上培养基的pH值控制在7.0-7.2,固体培养基额外添加1.5%琼脂粉。
1.2 方法
1.2.1B.velezensisBR-01菌株发酵滤液离体抑菌活性测定
以Xoc为指示菌,采用牛津杯法和十字交叉法测定B.velezensisBR-01菌株发酵滤液离体抑菌活性[20]。取4 ℃低温离心后获得的B.velezensisBR-01菌株发酵上清液,通过孔径0.22 μm的细菌过滤器得到无菌发酵滤液。为保证培养皿底部平整,首先在培养皿底部铺一层1 mm厚度的水琼脂,再放置牛津杯。将加热融化的NB固体培养基冷却至45 ℃,以0.5%的体积分数加入108CFU/mL的指示菌液,摇晃均匀后倒入平皿中。冷却后取出牛津杯,每孔加入0.1 mL无菌发酵滤液,以加入等量发酵培养基上清液为对照,重复3次处理。28 ℃恒温培养箱中倒置培养2 d,观察并测量抑菌圈直径。
1.2.2B.velezensisBR-01菌株初始发酵培养基筛选
从-80 ℃冰箱中取出B.velezensisBR-01甘油保藏菌液,分别接种到1.1.2节各初始固体培养基平板上。28 ℃培养48 h后,挑取单菌落接种至对应的液体培养基中,28 ℃、200 r/min条件下培养48 h。参照1.2.1节制备各初始培养基发酵滤液并测定其离体抑菌活性,各试验重复3次处理。
1.2.3 单因素试验
以1.2.2节最优培养基为初始发酵培养基,通过改变各组分种类及浓度或设置不同的培养条件,试验各因素对B.velezensisBR-01菌株发酵滤液抑菌活性的影响,每次优化后的结果进入随后的条件优化试验。(1)碳源:将初始发酵培养基中的碳源(酵母提取物)分别等质量替换为玉米粉、淀粉、蔗糖、麦芽糖、糊精和葡萄糖,并调整最适碳源浓度。(2)氮源:将初始发酵培养基中的氮源(蛋白胨)分别等质量替换为花生饼粉、牛肉膏、酵母提取物、豆粕粉、胰蛋白胨、尿素,并调整最适氮源浓度。(3)无机盐:在初始发酵培养基的基础上分别添加CaCl2、MgCl2、CaCO3、MnSO4、K2HPO4,添加量为0.1%(W/V),以不添加无机盐为对照。(4)pH值:设置初始发酵培养基初始pH值为4-9,设置6个梯度。(5)发酵时间:设置发酵时间为12-72 h,设置6个梯度。(6)温度:设置摇床培养温度为26-36 ℃,设置6个梯度。上述培养基配制后按每瓶100 mL分装到250 mL三角瓶中,初始发酵条件为28 ℃、200 r/min培养48 h。参照1.2.1节制备各处理组发酵滤液并测定其离体抑菌活性,各试验重复3次处理。
1.2.4 Plackett-Burman (PB)试验
根据单因素试验结果,采用Design-Expert 12软件PB设计法进行试验设计,以B.velezensisBR-01菌株发酵滤液抑菌圈直径为响应值,设置培养基组分及发酵条件中各个单因素的高(+1)、低(-1)两个水平,每组处理重复3次。参照1.2.1节制备各处理组发酵滤液并测定其离体抑菌活性,使用Design-Expert 12软件处理试验数据,通过方差分析判断各因素对发酵结果的重要程度,试验设计见表1。
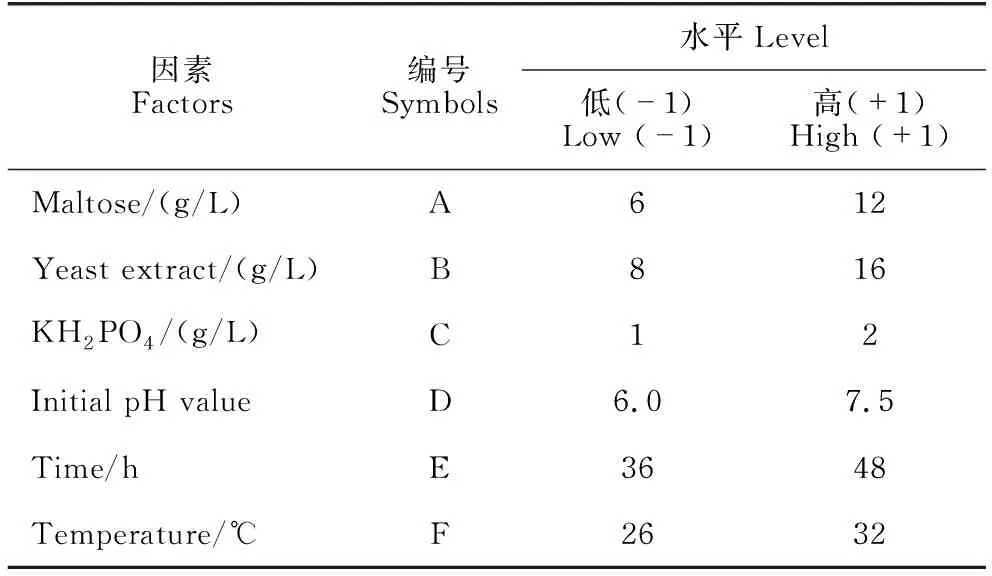
表1 PB试验因素与水平设计
1.2.5 最陡爬坡试验
根据PB试验得到影响发酵结果的显著因素,根据前期单因素试验数据设计步长。显著因素步长方向应与其效应方向一致,非显著因素取单因素最优水平,通过最陡爬坡试验逼近发酵结果最优值。
1.2.6 响应面优化试验
通过最陡爬坡试验确定主要影响因子的最优组合,以B.velezensisBR-01菌株发酵滤液对Xoc的抑菌圈直径为响应值,通过Design-Expert 12软件设计3因素3水平Box-Behnken试验(表2),建立最优发酵条件并验证。
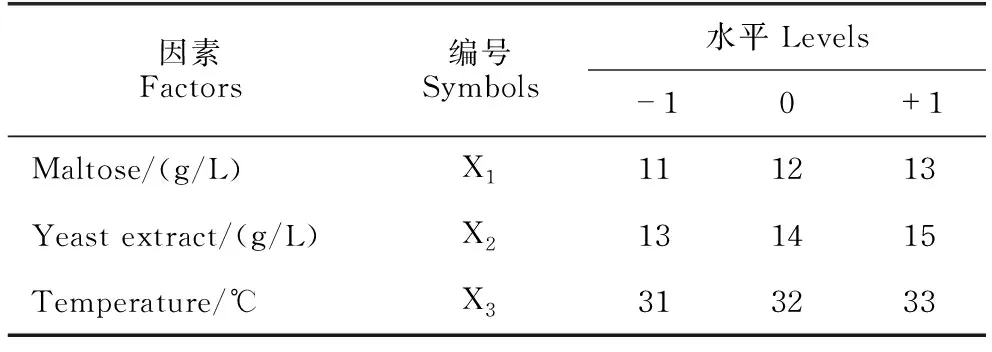
表2 Box-Behnken试验因素与水平设计
1.2.7 抗菌肽合成相关基因的检测
根据文献[21-24]的方法,利用特异性引物检测Iturin、Bacillomycin D、Surfactin、Fengycin、和Bacilysin 5种抗菌肽的合成相关基因。PCR反应体系:1 μL模板DNA,10 μL 5×PCR buffer,5 μL dNTPs (2 mmol/L),1.5 μL上下游引物(10 μmol/L),0.6 μL DNA polymerase,ddH2O补足最终体积为50 μL。PCR扩增条件:95 ℃ 5 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃ 5 min。PCR产物用1.5%的琼脂糖凝胶电泳检查大小。
1.2.8 液相色谱质谱法分析抑菌肽
参照Xu等[25]的方法从B.velezensisBR-01菌株发酵上清液中纯化获得抗菌肽粗提物。采用LC-MS检测和分析技术,利用Thermo Xcalibur 4.0软件根据样品的质量-电荷比(m/z)测定目标物质的相对分子量,并通过比较初步确定菌株产生的脂肽类型[26]。
色谱条件:ACQUITY UPLC BEH C18色谱柱(50 mm×2.1 mm,1.7 μm),柱温30 ℃;自动进样器温度为10 ℃;正离子(ESI+)模式下流动相A为0.1%甲酸水,B为甲醇。样品梯度洗脱程序:0.0-2.0 min,95% A-95% A;2.0-13.0 min,95% A-5% A;13.0-16.0 min,5% A-5% A;16.0-16.1 min,5% A-95% A;16.1-18.0 min,95% A-95% A,流速为0.3 mL/min,进样体积为2 μL。质谱条件:离子源为加热型电喷雾(HESI),温度为300 ℃;正离子模式下喷雾电压为3.0 kV;传输毛细管温度320 ℃,鞘气压力30 psi,辅助气压力10 psi;扫描模式为Full MS/dd-MS2,质量为200-2 000 m/z,一级扫描和二级扫描分辨率分别为70 000 (FWHM)和17 500 (FWHM)。碰撞气:高纯氮气。
1.2.9 数据分析
每个试验至少独立重复3次,结果以“平均值±标准差”表示。使用Design-Expert 12软件进行PB试验设计和Box-Behnken试验设计并进行数据分析,得到拟合回归方程,进行试验方差分析。使用SPSS 20.0软件对最佳初始培养基和单因素试验结果进行统计分析,并使用Duncan法进行显著性检验(P<0.05)。
2 结果与分析
2.1 适用于B.velezensis BR-01菌株的发酵培养基筛选
B.velezensisBR-01菌株由不同的初始培养基发酵培养,所获得的发酵滤液的抑菌活性会有明显的变化(图1)。B.velezensisBR-01菌株以LB培养基和Landy培养基作为初始发酵培养基时,其发酵滤液的抑菌活性显著优于其他培养基,抑菌圈直径分别为(27.9±0.7) mm和(28.0±0.9) mm,两者无显著差异。综合考虑成本因素,LB培养基为B.velezensisBR-01菌株最适初始发酵培养基。
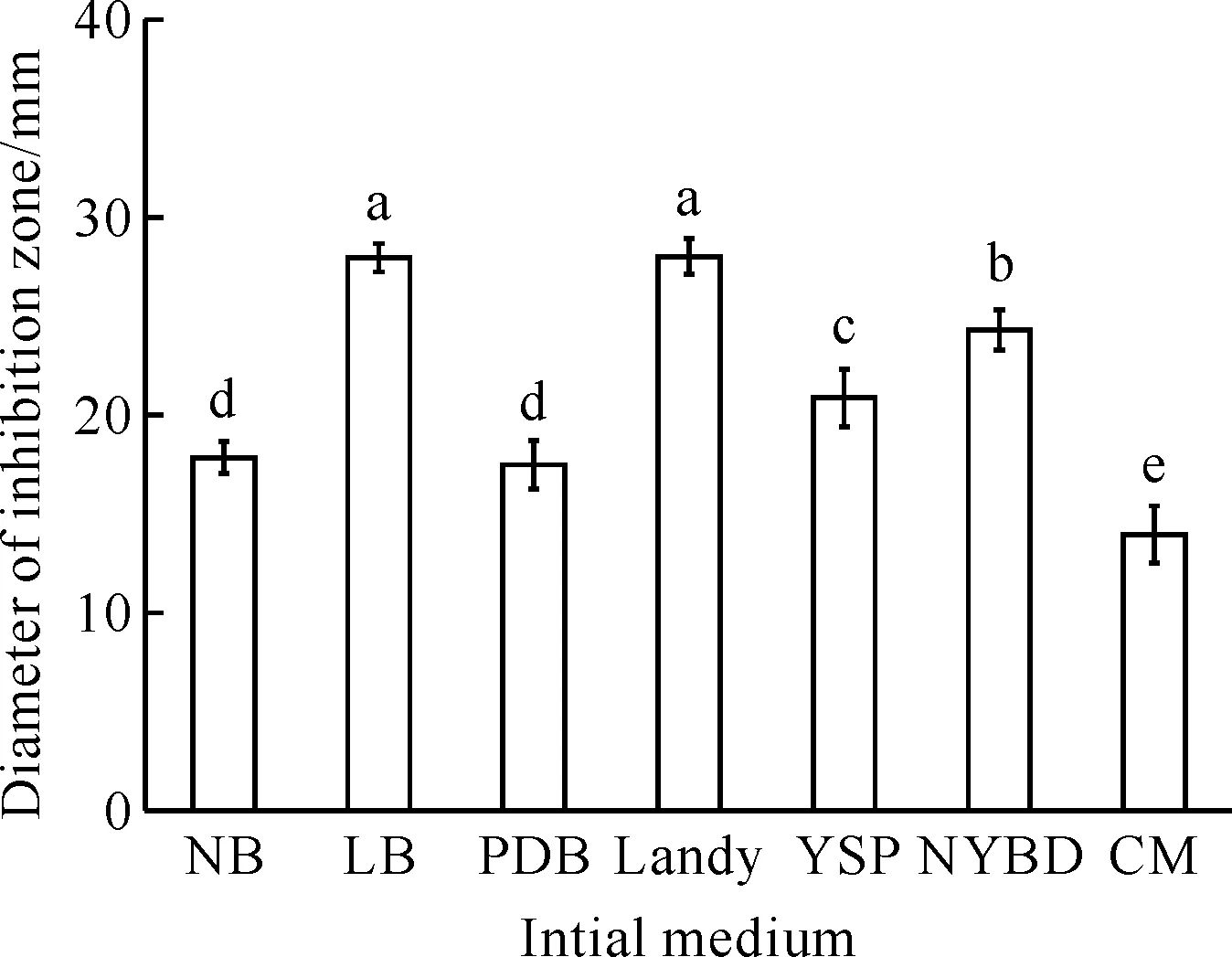
Different letters show significant difference at 0.05 level.
2.2 培养基及发酵条件的单因素优化
在单因素试验中,以麦芽糖为碳源、以酵母提取物为氮源时,B.velezensisBR-01菌株发酵滤液对Xoc的抑菌圈直径分别取得最大值[图2:(a)、(b)],且随着麦芽糖浓度和酵母提取物浓度的提高,抑菌圈直径呈先增加后减小的趋势[图2:(c)、(d)]。与空白对照组(CK)相比,添加MgCl2对发酵滤液抑菌活性影响不显著,添加CaCl2、MnSO4和CaCO3反而会不同程度地降低发酵滤液抑菌活性,只有添加KH2PO4可以略微提高发酵滤液抑菌活性[图2(e)]。B.velezensisBR-01菌株在初始pH值为7、32 ℃条件下发酵培养48 h得到的发酵滤液对Xoc的抑菌圈直径取得最大值[图2:(f)、(g)、(h)]。单因素试验结果表明,B.velezensisBR-01菌株的最适碳源为麦芽糖,最适碳源浓度为11 g/L,最适氮源为酵母提取物,最适氮源浓度为14 g/L,最适无机盐为KH2PO4,最适pH值为7,最适发酵时间48 h,最适发酵温度32 ℃。
2.3 培养基及发酵条件的响应面优化
2.3.1 PB试验结果
PB试验设计与结果见表3。由方差分析可知,不同的因素对发酵结果的作用大小不同。其中麦芽糖(A)、酵母提取物(B)、温度(F)影响作用显著(P<0.05)且都为正效应,3因素按影响作用大小排序为温度(F)>酵母提取物(B)>麦芽糖(A)(表4),选取这3个因素进入下一步试验。
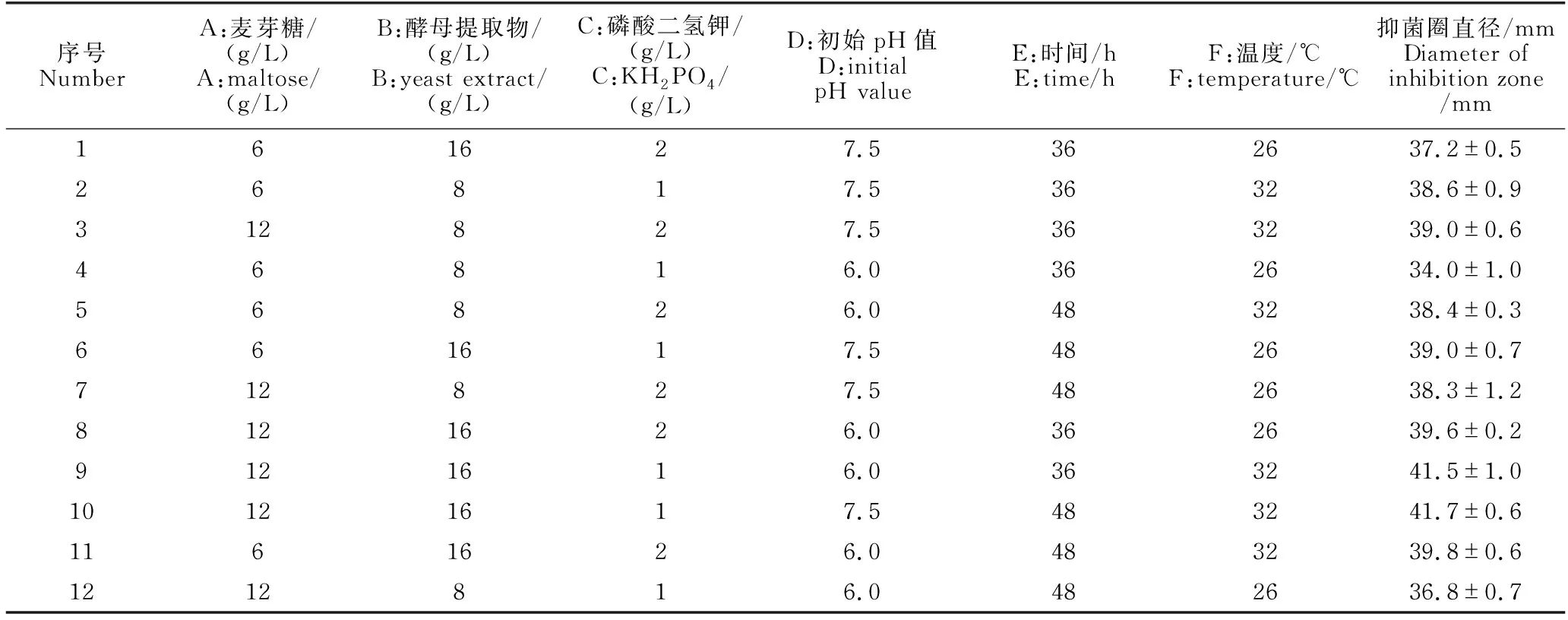
表3 PB试验设计与结果
2.3.2 最陡爬坡试验结果
最陡爬坡试验结果见表5,最优发酵条件组合为麦芽糖12 g/L、酵母提取物14 g/L、培养温度32 ℃。在此发酵条件下,B.velezensisBR-01菌株发酵滤液对Xoc的抑菌圈直径最大,为42.1 mm,取该组合为响应中心点,进入下一步试验。

表5 最陡爬坡路径试验设计与结果
2.3.3 Box-Behnken试验结果
Box-Behnken试验设计与结果见表6。使用Design-Expert 12软件对Box-Behnken 试验数据进行多元回归拟合,得到B.velezensisBR-01菌株发酵滤液抑菌圈直径(Y)对麦芽糖(X1)、酵母提取物(X2)、温度(X3)的回归方程:Y=42.07-0.58X1-0.26X2+0.71X3+0.43X1X2+0.13X1X3-0.50X2X3-2.23X12-0.41X22-1.76X32。方差分析结果显示,该模型回归拟合度P值<0.000 1,回归显著;模型失拟值P=0.240 0>0.05,失拟项不显著,模型稳定误差小。该模型的决定系数R2=0.992 5,校正决定系数R2=0.979 0,模型拟合度较好,预测可信度较高(表7)。
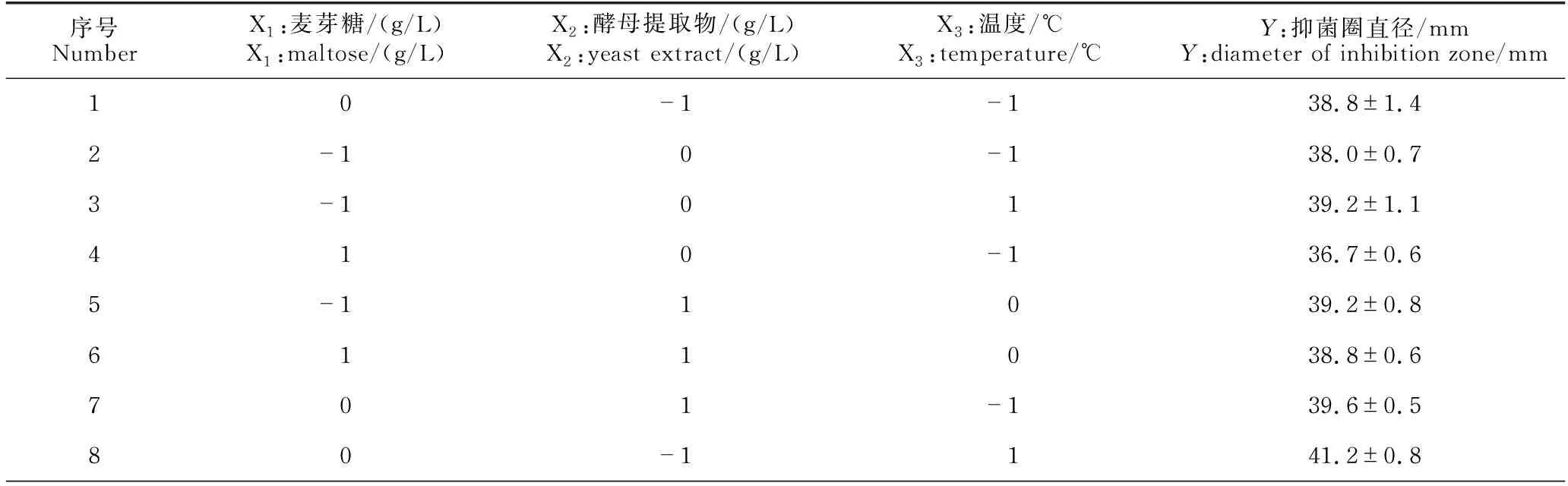
表6 Box-Behnken试验设计与结果
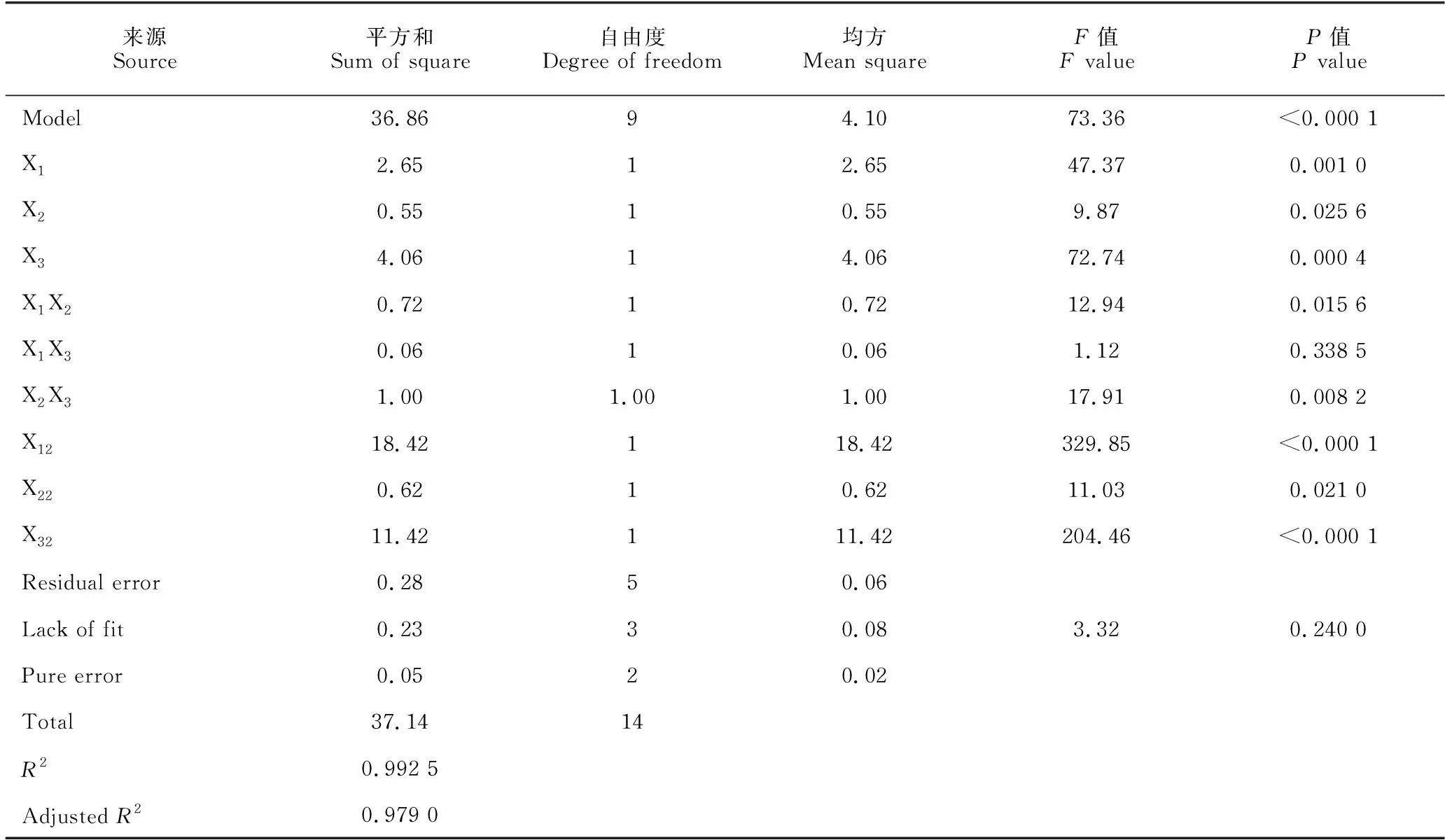
表7 Box-Behnken 试验统计分析
采用Design-Expert 12软件,根据上述拟合方程绘制显著因子间相互作用的响应面曲线图(图3)。由结果可知,响应面曲线图均为凸面图,存在抑菌率获得最大值的发酵条件组合。通过软件求解回归方程得到以下最优解决方案:麦芽糖(X1)11.82 g/L、酵母提取物(X2)13.42 g/L、温度(X3)32.3 ℃,最大抑菌圈直径预测为42.3 mm。

图3 各培养因素对抑菌圈直径交互影响的响应面
2.4 响应面最优条件验证
按照Box-Behnken试验预测值优化发酵条件显著因素,按照单因素试验优化发酵条件非显著因素,得到全部发酵条件如下:麦芽糖11.89 g/L、酵母提取物13.54 g/L、NaCl 5 g/L、KH2PO41 g/L、初始pH值为7、发酵时间48 h、培养温度32.3 ℃。为验证响应面最优条件的可行性,在该优化方案下制备B.velezensisBR-01菌株发酵滤液并测定其对Xoc的离体抑菌活性,试验重复3次处理。结果显示,B.velezensisBR-01菌株发酵滤液对Xoc的抑菌圈直径为(42.5±0.2) mm(图4),与回归模型预测的最大抑菌圈直径42.3 mm相近,表明回归模型合理、可信。

Values given are the means±standard deviations of triplicate measurements.
优化前使用LB培养基制备的B.velezensisBR-01菌株发酵滤液对Xoc的抑菌圈直径为(28.0±0.9) mm,优化后制备的B.velezensisBR-01菌株发酵滤液对Xoc的抑菌圈直径相比优化前增加了51.79%,表明采用优化发酵方案可以有效提高B.velezensisBR-01菌株发酵滤液的抑菌活性物质浓度。
2.5 抗菌肽合成相关基因的检测
本研究从B.velezensisBR-01菌株中成功扩增到与Iturin合成相关的基因ituA和ituD,与Bacillomycin D合成相关的基因bmyB和bmyC,与Surfactin合成相关的基因srfAA,与Fengycin合成相关的基因fenB和fenD,与Bacillysin合成相关的基因bacA和bacD(图5)。结果表明,B.velezensisBR-01菌株具有产生多种抗菌肽的潜力。

Hole M represents Maker,hole 1-10 represent ituA,ituD,bmyC,bmyB,srfAA,fenB,fenD,bacD,bacA and non-template control in sequence.
2.6 LC-MS技术分析抑菌肽
芽孢杆菌可以代谢多种类型的抗菌肽,相当数量的抗菌肽具体组成和相对分子质量已经确定[26-28]。本研究采用LC-MS检测技术分析B.velezensisBR-01菌株抗菌肽粗提取物的成分,结合对应于质谱的色谱图中每个时间段出现的峰,根据相对分子质量和“-CH2-”脂肪链的结构特征分析质谱中的一系列单峰,结合2.5节抗菌肽合成相关基因的检测结果作出以下推测:(1)推测m/z271.15为抗菌二肽Bacilysin [图6(a)];(2)推测m/z1 008.66、m/z1 022.67和m/z1 036.69为Surfactin同系物[图6(b)];(3)推测m/z1 044.66、m/z1 058.67、m/z1 072.69和m/z1 086.70为Iturin同系物[图6(c)];(4)推测m/z1 463.80、m/z1 477.82和m/z1 491.83为Fengycin同源物[图6(d)]。基于上述结果,推测该菌株可能产生4种抗菌肽:Bacilysin、Surfactin、Iturin和Fengycin (表8)。

(a) Bacilysin,MS spectra of m/z 271.15; (b) Surfactin,MS spectra of m/z 1 008.66,m/z 1 022.67 and m/z 1 036.69;(c) Iturin,MS spectra of m/z 1 044.66,m/z 1 058.67,m/z 1 072.69 and m/z 1 086.70;(d) Fengycin,MS spectra of m/z 1 463.80,m/z 1 477.82 and m/z 1 491.83.

表8 抗菌肽脂粗提物的LC-MS分析
3 讨论
贝莱斯芽孢杆菌因其丰富的抗菌肽产物被广泛应用于多种植物病害的生物防治。Cao等[29]分析了对尖孢镰刀菌(Fusariumoxysporum)和青枯菌(Ralstoniasolanacearum)有拮抗作用的两株B.velezensis的抗菌代谢产物,共鉴定到3种脂肽化合物(Surfactin、Iturin和Fengycin),其中Iturin在防御病原真菌方面起主要作用。B.velezensisIP22菌株能够显著减轻野油菜黄单胞菌辣椒斑点病致病变种(X.campstrispv.vesicatoria)侵染造成的辣椒细菌性斑点病,利用高效液相色谱质谱技术可检测到该菌株抗菌代谢产物中的Fengycin和Locillomycin家族[30]。Wu等[31]报道B.velezensisFZB42中的Difficidin和Bacilysin对水稻黄单胞菌具有拮抗活性。本研究利用特异性引物PCR扩增B.velezensisBR-01菌株的基因组DNA,并使用LC-MS技术初步将B.velezensisBR-01菌株抗菌肽成分鉴定为Bacilysin、Surfactin、Iturin和Fengycin。其中Surfactin和Bacilysin被认为具有抗细菌的功能[32,33],可能对水稻细菌性条斑病菌具有拮抗活性。
抗菌肽在农业病虫害防控领域具有广阔的应用前景,利用微生物生产抗菌肽是一个现实可行的选择。但是微生物生产抗菌肽是一个复杂的发酵过程,只有合适的发酵环境,才能让目标菌株的生产性能得到充分的释放[34]。本研究以B.velezensisBR-01菌株无菌滤液对Xoc的抑菌圈直径为因变量,通过提高发酵滤液的抑菌活性来间接提高抗菌肽的浓度。在碳源筛选试验中B.velezensisBR-01菌株对麦芽糖、葡萄糖等速效碳源利用率较高,而对淀粉、玉米粉等迟效碳源利用率较低,这与黎燕珊等[16]研究结果相近,但与赵晓燕等[35]研究发现菌株B.amyloliquefaciensXLA03的最佳碳源为玉米淀粉不同。在氮源筛选试验中B.velezensisBR-01菌株几乎不能利用无机氮源尿素,在有机氮源范围内更偏好酵母提取物、蛋白胨等速效氮源,对迟效氮源花生饼粉利用效率较差,这与张晓勇等[36]的研究结果相近。肖靓等[37]研究报道菌株B.subtilisP5添加CaCl2时对辣椒炭疽病抑菌活性最强;张冬冬等[38]研究表明MnSO4、CaCl2对菌株B.malacitensisZ-5的生长有显著的促进作用;侯美如等[39]发现菌株B.amyloliquefaciensSSYB以CaCO3为无机盐时产纤维素酶发酵中药材黄芪的能力最强;张志焱等[40]报道添加KH2PO4后菌株B.subtilisBL0006的抗菌肽杀菌价效最高。本研究中只有KH2PO4对B.velezensisBR-01菌株发酵滤液的抑菌活性有一定的促进作用,但效果不显著,可能是因为培养基中的酵母提取物和NaCl已经满足B.velezensisBR-01菌株发酵产抗菌肽对无机盐的营养代谢需求。在发酵条件优化方面,发现B.velezensisBR-01菌株最适pH值为7,其在中性偏弱碱性环境下抑菌活性较高,与张晓勇等[36]的研究结果相近,但与Ye等[41]研究发现菌株B.amyloliquefaciensS1适合在偏弱酸性或中性环境下生长不同。B.velezensisBR-01菌株在32.3 ℃条件下培养48 h后其抑菌活性最强,其中发酵时间与郭艳霞等[19]的研究结果相近,发酵温度与黎燕珊等[16]的研究结果相近。
为提高B.velezensisBR-01菌株产抗菌肽的能力,增加其对水稻细菌性条斑病的生防价值,本研究在单因素试验的基础上,对培养基成分与培养条件设计了多因素的组合试验。微生物发酵因素优化的常规方法是正交试验设计,正交试验设计能够同时兼顾多因素对发酵结果的影响,寻求各因素最佳水平的组合。但正交试验设计无法构建微生物发酵响应值的回归方程,从而无法通过数学模型获得最优解[42,43]。本研究利用响应面分析法优化B.velezensisBR-01菌株产抗菌肽培养基和发酵条件,与正交试验设计相比,响应面分析法试验次数少,试验精度高,能够综合考虑多因素间的交互作用并构建回归方程,是近年来微生物发酵参数优化和工艺考察的首选[44-46]。
结合文献分析和本研究结果,发现不同来源的贝莱斯芽孢杆菌菌株在不同的培养条件下产生的抗菌肽的成分与含量存在一定差异,这种差异是贝莱斯芽孢杆菌菌株间拮抗能力、拮抗谱多样性的基础。B.velezensisBR-01菌株的分离与研究为水稻细菌性条斑病的生物防治提供了新的微生物资源与理论基础。
4 结论
B.velezensisBR-01菌株高产抗菌肽培养基配方为麦芽糖11.89 g/L、酵母提取物13.54 g/L、NaCl 5 g/L、KH2PO41 g/L。最适发酵条件为初始pH值7、发酵时间48 h、发酵温度32.3 ℃。抗菌肽主要成分初步鉴定为Bacilysin、Surfactin、Iturin和Fengycin。该方案可用于快速、批量发酵制备B.velezensisBR-01菌株生防菌液。本研究结果为该菌株抗菌肽的分离纯化、结构鉴定及田间生防利用等后续研究提供了理论基础。

