虫高一尺稻高一丈:水稻抗褐飞虱研究
杨芳 祝莉莉 何光存
已经在地球上生存了几亿年的昆虫,经过漫长的进化形成了纷繁复杂上百万种种类,其中以植物为食的植食性昆虫占40%~50%[1]。植食性昆虫为了高效地从植物获取养分,形成了各式各样的口器和取食方式,因此,植物的根茎叶花果都成为昆虫的美食。昆虫的食量大、繁殖快,对植物形成巨大的压力,植物因此进化出各种抗性机制,抵抗昆虫的取食和危害。
农业的兴起使人类可以通过种植特定的植物——农作物而获得稳定可靠的食物来源,昆虫也成为农作物的“收获者”。每年大约有18%~20%产量的农作物被害虫“消费”掉[2]。水稻是人类最重要的口粮作物之一,褐飞虱(学名Nilaparvata lugens,英文名brown planthopper,简称BPH),是专吃水稻的单食性害虫。褐飞虱体长几毫米,群集于水稻基部,它们将针管状的口器插入植物的养分输导组织——维管束韧皮部,借助于自身的肌肉作用和水稻体内的压力吸食韧皮部内的汁液,大量吸取水稻的养分。传统农业生产中,水稻地方品种多种多样,丰富的遗传多样性和抗性基因有效地防止了褐飞虱种群的爆发与流行;同时,为适应水稻品种的多样性,褐飞虱群体也产生了高度异质化,褐飞虱与水稻得以共同生存。
笫二次世界大战后,世界人口快速增长,粮食供应紧张。从1960年代开始,亚洲水稻生产兴起了绿色革命,国际水稻研究所(IRRI)培育的革命性品种IR8的产量达到了10 000千克/公顷,而传统品种的产量只有1000千克/公顷。水稻生产的种子从种植农民培育的地方品种转变为矮杆高产的品种,生产方式从投入少的分散栽培转变为以化肥和农药为基础的集约化连作栽培。IR8于1966 年开始在菲律宾推广,很快遍布亚洲热带地区,绿色革命为解决世界稻米短缺问题做出了巨大贡献。
然而,水稻生产的绿色革命带来了一个意想不到的问题是水稻害虫褐飞虱的连年大爆发。褐飞虱在热带和亚热带地区可以全年生长发育,一年可繁殖12代。褐飞虱具有长距离迁飞的能力;在中国、日本和韩国等温带地区,褐飞虱在冬季不能生存,而在每年的夏季水稻生长季节,褐飞虱在天气锋面系统的帮助下,从泰国、越南、菲律宾等地迁飞而至,在当地水稻上生存繁殖。绿色革命之前褐飞虱只是局部性零星发生,没有造成大的危害。

IR8等矮秆高产水稻不携带抗虫基因且生长茂密,为褐飞虱提供了理想的栖息地和丰富的食料,助长了害虫的繁殖力(这种品种称为感虫品种)。褐飞虱侵食感虫水稻时食量非常大,刚羽化的雌虫每小时可取食相当于自己体重(3毫克)的水稻汁液;一只雌虫可产几百只卵,每一稻株基部常聚集有数千只虫,极易发生害虫种群爆发。褐飞虱大爆发的年份,亚洲的热带稻区成为温带稻区的褐飞虱虫源地,迁飞而来的褐飞虱可以落地成灾。褐飞虱取食剥夺水稻的养分,严重影响水稻生长发育,造成籽粒充食不良、空秕增加,消费品质和加工品质严重下降。严重时致使稻株完全干枯死亡,这种症状被称为“虱烧”(hopperburn),此外,褐飞虱还会传播水稻病毒病。
现代农业生产中杀虫剂是控制害虫的主要手段,频繁使用农药既增强了害虫的抗药性,又杀死了褐飞虱的天敌,更加剧了问题的严重性。1970年代以来,亚洲各国的褐飞虱虫灾连年不断,关于农药难以控制褐飞虱的报告也越来越多。孟加拉国、柬埔寨、中国、印度、印度尼西亚、日本、韩国、老挝、马来西亚、菲律宾、泰国和越南都有关于发生重大褐飞虱虫灾的报道[3]。如2005年越南因褐飞虱虫灾损失水稻40万吨,致使2007年停止了稻米出口;泰国2009—2011年有300万公顷水稻受褐飞虱危害,产量损失超过110万吨。我国的稻飞虱虫灾(褐飞虱、白背飞虱和灰飞虱的统称,其中多以在水稻成熟期造成重大危害的褐飞虱为主)常年发生的面积约4亿亩次,尽管全力施用农藥防治,仍造成产量损失百万吨。因此,褐飞虱是水稻生产中的第一大害虫,是粮食安全的主要威胁因素之一[4]。
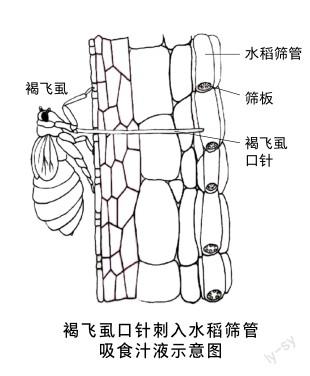
造成农业生产重大损失的害虫如飞虱、蚜虫、粉虱等,都是同翅目刺吸式昆虫。褐飞虱口器由外侧一对上颚口针和内侧一对下颚口针套在一起,长度650~700微米。刺吸式口器常被形象地称为口针。褐飞虱口针内有两个管道:唾液管道和食物管道。其中,唾液管道负责将唾液注入植物中,食物管道则将从植物韧皮部吸取的汁液输送到消化系统,两条管道实现了昆虫和植物间的物质交换。
褐飞虱取食时先用口针在水稻上进行试探和穿刺,以寻找吸食目标组织。水稻叶鞘表皮分化成粗糙区和平滑区,粗糙区对应叶鞘的内部结构是气腔,平滑区对应的则是维管束。褐飞虱口针从平滑区刺入可直达维管束韧皮部吸食汁液,整个取食过程中褐飞虱都要分泌唾液。褐飞虱的唾液分两种:一种是胶状唾液,含有磷脂、脂蛋白和多糖,由口针释放后迅速凝固,形成中空的口针鞘,为口针穿刺提供支撑和润滑的作用,并保护口针免受物理和化学损伤;一种是水状唾液,含有消化酶、水解酶和降解细胞壁的酶类,使得口针更容易穿刺,其中的α-淀粉酶和淀粉葡糖苷酶可以水解淀粉释放能量。唾液在防止植物的防卫反应方面也具有重要作用,有助于害虫取食。
任何生物遇到侵害时都会进行防卫,水稻也是一样。被褐飞虱取食侵害时,感虫水稻也会激发基础防卫反应,然而,褐飞虱可以通过唾液中的蛋白质抑制水稻的这种防卫和反抗反应,其中的唾液蛋白BISP就能行使这样的功能。BISP是一个具有241个氨基酸残基的唾液蛋白,富含甘氨酸,它在褐飞虱唾液腺中高表达,褐飞虱取食时被分泌进入水稻组织。如果抑制其唾液腺BISP的表达,则会显著影响褐飞虱对感虫水稻的取食,进而影响其生长,表明BISP对于维持褐飞虱正常取食具有重要作用。
此外,水稻中的细胞质受体激酶OsRLCK185在水稻的基础防卫反应中也起着关键作用,BISP可以通过直接与OsRLCK185的激酶结构域结合,抑制其激酶活性,进而抑制水稻的基础防卫反应。通过基因操作手段在感虫水稻中表达BISP,发现这些植株中水杨酸及防卫相关基因的表达显著下调,水稻变得对褐飞虱更敏感。可见褐飞虱唾液蛋白进入水稻后的作用就是压制水稻基础防卫体系,使水稻变得更脆弱、毫无还手之力,便于褐飞虱取食[5]。
针对褐飞虱的侵害,自然界中的水稻也必然会进化出相应的抗性,来抵抗褐飞虱的取食。这种具有抵抗能力的水稻品种称为抗褐飞虱水稻或抗虫水稻品种。褐飞虱在抗虫水稻品种上的取食被抑制,生长发育受阻,死亡率升高;而水稻自身不受伤害或受害很轻。抗虫水稻是如何做到这一点的呢?
各国科学家通过遗传学研究发现,抗虫水稻对褐飞虱的抗性是由基因控制的,这类基因称为抗褐飞虱基因。科学家从不同水稻品种资源中找到了50多个抗褐飞虱基因[6],并且确定了这些基因在水稻染色体上的位置(基因定位)。2009年我们应用图位克隆法首次成功分离出水稻抗褐飞虱基因Bph14(基因名称斜体表示,其中Bph是水稻褐飞虱基因的符号,数字是该基因的编号),发现该基因编码一种具有NB-LRR结构域的蛋白质(NLR蛋白)[7]。NLR蛋白是植物细胞内主要的免疫受体,可识别病原微生物的效应蛋白,激发免疫反应。这一成果表明,抗虫水稻也是通过与抗病类似的免疫反应实现抗褐飞虱的。其后,国际上克隆出多个抗褐飞虱基因,其中Bph3和Bph15编码细胞膜受体激酶LecRK[8,9];Bph9及其等位基因编码具有两个NB结构域的NLR蛋白[10];Bph6、Bph30,Bph40编码具有两个富含亮氨酸结构域的受体蛋白[11,12]。这些受体是如何起抗虫作用的呢?
在带有Bph14基因的抗褐飞虱水稻(Bph14抗虫水稻)中,BPH14蛋白(抗褐飞虱基因Bph14编码的蛋白,用正体表示)存在于细胞质中。当褐飞虱唾液蛋白BISP被分泌进入水稻细胞后,BPH14立即与BISP结合。实验室的酵母双杂交、免疫共沉淀及双分子荧光互补等实验,证实了 BISP与BPH14的相互作用,但BISP与感虫水稻中的BPH14同源蛋白N14不互作。生物层干涉测量法和微量热泳动测定结果表明,BISP只与 BPH14的LRR结构域发生特异性互作——直接结合,其解离常数较高,二者有很高的亲和性,所以,BISP一旦进入水稻细胞就会被BPH14特异性结合[5]。
BPH14与BISP结合后被激活,形成BPH14同源聚合体,进而与转录因子WRKY72发生作用,增加WRKY72的积累。WRKY72进一步激活抗性途径的下游基因,如细胞质激酶RLCK281和胼胝质合成酶LOC_Os01g67364.1表达,动员更多基因参与抗虫反应。水稻抗虫反应还表现为植物激素SA信号通路激活、细胞转录重新编程、防卫相关基因表达上升等[13]。
因此,BPH14的功能之一是识别褐飞虱唾液蛋白BISP,并将信号传递下去,动员细胞内更多力量参与抗虫反应。其他抗褐飞虱基因编码的蛋白也可能有类似的功能,它们在水稻细胞膜上和细胞内构成识别褐飞虱取食和信号传递体系而发挥抗虫作用[5]。
水稻免疫受体识别褐飞虱唾液成分被激活后,其信号除通过转录因子WRKY72传递之外,也可通过钙离子、蛋白质磷酸化、植物激素等多条途径传导,激发抗虫反应,最终形成一套抵御褐飞虱侵害的机制。

与其他刺吸式昆虫一样,褐飞虱从植物韧皮部筛管吸取汁液满足其生长发育的需要。筛管是高等植物韧皮部的管状结构,它由一系列端壁具有筛板的管状活细胞连接而成,筛板上有筛孔,负责光合作用产物和多种有机物在植物体内的长距离運输。胼胝质是具1,6-分枝的线性β-1,3-葡聚糖,是植物细胞壁上最具动态(能按需要很快合成或分解)的成分之一;它有多种功能,其中之一是作为栓塞封堵细胞间的连接通道——胞间连丝,从而控制细胞间的物质运输。在Bph14抗虫水稻中,褐飞虱取食被NLR受体感知后,水稻植株立即作出抗虫反应,包括胼胝质合成酶基因的表达上调,胼胝质合成增加并沉积到筛板上形成栓塞,从而使褐飞虱不能吸食韧皮部的汁液。而在感虫水稻植株中β-1,3-葡聚糖苷酶表达上升,则有效分解胼胝质,使褐飞虱取食不受影响。抗虫植株筛管中β-1,3-葡聚糖苷酶基因表达量低或不表达,因此不会降解胼胝质,使褐飞虱始终不能顺利取食韧皮部汁液,形成了对褐飞虱的有效抗性[7,14]。
抗褐飞虱基因Bph6编码的蛋白BPH6定位于水稻胞泌复合体(exocyst),并与胞泌复合体亚基OsEXO70E1及OsEXO70H3相互作用。研究表明,抑制OsEXO70E1的表达可以降低Bph6水稻的抗性水平,表明OsEXO70E1参与了BPH6介导的抗性。植物细胞的分泌作用在细胞壁发育中起重要作用。BPH6与OsEXO70E1和OsEXO70H3互作后,提高了胞泌复合体介导的物质外泌,使得纤维素、半纤维素、木质素合成加强,维管束鞘细胞壁加厚,阻止了褐飞虱口针穿刺进入韧皮部吸食。Bph6对褐飞虱和白背飞虱都有高抗性[11,15]。
抗褐飞虱基因Bph30在水稻叶鞘表皮细胞下面的厚壁组织中高表达。厚壁组织位于维管束之外,是褐飞虱口针刺入韧皮部的必经之路。BPH30与MYB转录因子相互作用,调控纤维素和半纤维素合成基因的表达,褐飞虱的取食激发了Bph30抗虫水稻中纤维素和半纤维素合成基因的显著上调,叶鞘厚壁组织中的细胞壁的纤维素和半纤维素含量快速增加,厚壁组织明显加厚,原子力显微镜测量结果显示,厚壁组织细胞壁的硬度也显著增加。褐飞虱口针穿过Bph30水稻厚壁组织的可能性显著降低。强化的厚壁组织如同一道屏障阻止了褐飞虱的口针,使其不能到达韧皮部取食[12]。
上述Bph14、Bph6和Bph30介導的抗虫机制,都是通过强化水稻相关组织的细胞壁或堵塞筛管来阻止褐飞虱的取食。面对这些抗虫水稻,褐飞虱取食量显著降低,体重增加很小或负增长,死亡率上升,从而有效控制来褐飞虱群体的增长与危害。
褐飞虱唾液蛋白BISP与BPH14识别后激发强烈抗虫反应。如果BISP在抗虫水稻细胞中不被降解而长久留存,会产生什么结果?
通过转基因技术将BISP在Bph14抗虫水稻中不同细胞组织中一直表达,发现这种转基因水稻除抗虫性提高外,其植株变矮小、产量降低,表明褐飞虱唾液蛋白BISP在水稻细胞中长期保留,对水稻植株生长是非常有害的[5]。
自然界中抗虫水稻为了维持正常的生长发育,是如何及时消除入侵之敌BISP以避免过度的抗虫反应?研究者惊奇发现,Bph14抗虫水稻是通过细胞自噬(autophagy)途径来清除BISP的。细胞自噬是一类依赖于溶酶体和液泡的蛋白质降解途径。在动物细胞中,靶蛋白通过自噬体包裹被运送到溶酶体中,再由特定的水解酶降解;在植物细胞中,靶蛋白降解在液泡内进行。在这一过程中仍然是BPH14在起关键作用。BPH14识别BISP后,除激活抗虫信号通路之外,也激活了细胞自噬。BISP能与细胞自噬选择性受体OsNBR1结合,并且BPH14还促进二者的结合,OsNBR1进而与自噬体上的ATG8结合,最后将BISP拖入液泡,在其中将BISP降解掉。由于BISPBPH14-OsNBR1三种蛋白互作激活细胞自噬降解BISP,Bph14抗虫水稻细胞内BISP蛋白质的量被严格控制在适当的水平,从而不会产生过度的抗性反应。
由于抗性的作用,褐飞虱在抗虫水稻上很难吸食到足够的食物,因此或是死亡或是逃离。褐飞虱取食和分泌唾液等侵害行为终止,此时,细胞自噬迅速将细胞内残留的BISP降解,调低或终止抗虫反应,水稻快速恢复正常的生长发育。因此,BPH14识别BISP后激活细胞自噬,把入侵之敌BISP装入自噬体降解,是精细调控抗虫反应与生长发育之间平衡、实现既抗虫又高产的新机制[5]。
抗褐飞虱基因在水稻抗虫中起到了关键作用。当带有单个抗褐飞虱基因的水稻品种大面积推广种植后,对褐飞虱群体产生了巨大的选择压力。在菲律宾这样的热带国家,单一基因型大面积连续种植三年就会导致褐飞虱形成一个新生物型,它们可以克服原来抗虫水稻的抗性,产生危害。
实践证明,抗褐飞虱基因基因多样性可以避免对褐飞虱群体的筛选而产生新生物型。然而,至今水稻育种中应用的抗褐飞虱基因非常少。1970—1980年代国际水稻研究所应用Bph1培育了抗褐飞虱品种,在生产中单一抗虫基因型水稻压倒性地大面积种植,3年后新的褐飞虱群体(生物型2)流行,对Bph1水稻造成危害。其后,育成并推广了含Bph2的水稻品种,同样3年后其抗性又被生物型3褐飞虱所克服。因此,水稻育种中必须应用多个抗褐飞虱基因,不同品种带有不同的抗褐飞虱基因,将褐飞虱分而治之,使其难以产生选择而形成新种群。目前,全世界水稻资源中已鉴定出50多个抗褐飞虱基因位点,培育具有多个抗褐飞虱基因的品种的条件已经具备。
最近,对全球1500份水稻核心种质进行了三种褐飞虱生物型的抗性鉴定与全基因组关联分析,鉴定出59个抗褐飞虱位点。发现自然界中抗多种生物型褐飞虱的水稻具有的特点:一是抗褐飞虱基因位点内的等位变异非常丰富,二是多个位点的聚合且每个位点的效应值较小。这为今后抗褐飞虱育种指明了方向[16]。近年来我国抗褐飞虱育种实践也证明了抗褐飞虱基因的聚合,如(Bph14+Bph15)和(Bph6+Bph9),可以培育出抗性稳定的抗虫品种[17]。

水稻是世界上适应范围最广、遗传变异最丰富的作物之一,全球收集保藏的水稻种质资源达到78万份。我们要注重发掘和利用水稻资源中的抗褐飞虱基因及其等位变异,特别关注效应小的位点和不同抗性机制基因的聚合利用,形成抗褐飞虱的长效机制。随着人类对水稻抗褐飞虱基因调控网络和分子机制越来越清晰的认识,以及对水稻、褐飞虱和环境之间相互作用的深入了解,将为水稻抗褐飞虱育种提供新的资源,从而推动多样性抗褐飞虱品种的选育,实现褐飞虱的可持续治理。
[1]Stork N E. How many species of insects and other terrestrial arthropods are there on Earth? Annu Rev Entomol, 2018, 63:31–45.
[2]Oerke E C. Crop losses to pests. J Agric Sci, 2006, 144: 31–43.
[3]Bottrell D G, Schoenly K G. Resurrecting the ghost of green revolutions past: The brown planthopper as a recurring threat to high-yielding rice production in tropical Asia. J Asia-Pacific Entomol, 2012, 15:122–140.
[4]Liu W C, Liu Z D, Huang C, et al. Statistics and analysis of crop yield losses caused by main diseases and insect pests in recent 10 years (in Chinese). Plant Prot, 2016, 42: 1–9.
[5]Guo J, Wang H, Guan W, et al. A tripartite rheostat controls selfregulated host plant resistance to insects. Nature, 2023, 618: 799–807.
[6]Yang K, Liu H, Jiang W,et al. Large scale rice germplasm screening for identification of novel brown planthopper resistance sources. Mol Breeding, 2023, 43: 70.
[7]Du B, Zhang W, Liu B, et al. Identification and characterization of Bph14, a gene conferring resistance to brown planthopper in rice. Proc Natl Acad Sci USA, 2009, 106: 22163–22168.
[8]Cheng X Y, Wu Y, Guo J P, et al. A rice lectin receptor-like kinase that is involved in innate immune responses also contributes to seed germination. Plant J, 2013, 76: 687–698.
[9]Liu Y, Wu H, Chen H, et al. A gene cluster encoding lectin receptor kinases confers broad-spectrum and durable insect resistance in rice. Nat Biotechnol, 2015, 33: 301–305.
[10]Zhao Y, Huang J, Wang Z Z, et al. Allelic diversity in an NLR gene BPH9 enables rice to combat planthopper variation. Proc Natl Acad Sci USA, 2016, 113: 12850–12855.
[11]Guo J, Chen R, Du B, et al. Progress in exploitation and utilization of brown planthopper resistance gene in rice (in Chinese). Sci Sin Vitae, 2022, 52: 1326–1334.
[12]Shi S, Wang H, Nie L, et al. Bph30 confers resistance to brown planthopper by fortifying sclerenchyma in rice leaf sheath. Mol Plant, 2021, 14: 1714-1732.
[13]Hu L, Wu Y, Wu D, et al. The coiled-coil and nucleotide binding domains of brown planthopper resistance14 function in signaling and resistance against planthopper in rice. Plant Cell, 2017, 29: 3157–3185.
[14]Hao P, Liu C, Wang Y, et al. Herbivore-induced callose deposition on the sieve plates of rice: an important mechanism for host resistance. Plant Physiol, 2008, 146: 1810–1820.
[15]Wu D, Guo J, Zhang Q, et al., Necessity of rice resistance to planthoppers for OsEXO70H3 regulating SAMSL excretion and lignin deposition in cell walls. New Phytol, 2022, 234: 1031–1046.
[16]Zhou C, Zhang Q, Chen Y, et al. Balancing selection and wild gene pool contribute to resistance in global rice germplasm against planthopper. J Integr Plant Biol, 2021, 63: 1695–1711.
[17]Jeevanandham N, Raman R, Ramaiah D, et al. Rice: Nilaparvata lugens Stal interaction—current status and future prospects of brown planthopper management. J Plant Dis Prot, 2023, 130: 125–141.
關键词:水稻 褐飞虱 抗性基因 抗虫机理 育种 ■