参芪扶正注射剂预防由抗PD-1抗体致免疫性心肌炎损伤的保护作用
刘 倩,杨嘉明,高文聪,黄海彬,马 昕,胡振湘,郑昌博
(1.昆明医科大学药学院暨云南省天然药物药理重点实验室,云南 昆明 650500;2.丽珠单抗生物技术有限公司,广东 珠海 519000)
目前,肿瘤是全球仅次于心血管疾病的第二大致死疾病。免疫检查点抑制剂(immune checkpoint inhibitor,ICI)是治疗肿瘤的一线药物并受到研究领域的关注。ICI治疗肿瘤药物中程序性细胞死亡蛋白-1(programmed cell death protein 1,PD-1)和程序性细胞死亡蛋白配体-1(programmed death ligand-1,PD-L1)阻断剂的研究最受瞩目。通过PD-1/PD-L1免疫疗法,阻断PD-1和其配体PD-L1之间的相互作用,从而阻断肿瘤免疫逃逸通路(PD-1/PD-L1通路),最大限度的提高免疫应答,维持T细胞的肿瘤杀伤活性,延长患者生存期[1]。然而,在PD-1免疫疗法发挥抗肿瘤作用的同时也可能引起自身免疫疾病以及炎症效应。临床研究发现,PD-1免疫疗法引起的免疫性不良反应中最致命的毒性是免疫性心肌炎[2],虽然发生率较低,然而一旦发生就会产生严重后果,引起突发心源性休克,甚至造成死亡。根据资料显示,经ICI治疗的肿瘤患者中,心肌炎发病率为0.09%[3],而在PD-1/PD-L1单抗联合用药中的心肌炎发病率却明显高至0.27%,并且还出现了两例致命性心肌炎[4]。其中1例关于抗PD-1单抗治疗肿瘤,诱发免疫性心肌炎导致患者死亡的病例,其主要原因是心脏出现III级房室传导阻滞,随后出现心动过缓现象,最后导致患者心力衰竭[5]。尸检解剖病理学分析显示心脏组织中淋巴细胞弥漫、中性粒细胞浸润以及肌纤维损坏。目前关于抗PD-1单抗引发免疫性心肌炎的治疗,还仅局限于糖皮质激素,而且还容易引发其他的副作用[6]。因此,研究抗PD-1抗体治疗肿瘤的同时,还需关注其带来的免疫性心脏毒性,为肿瘤患者的治疗和预后提供保障。
现已研究证明,多种中药复方制剂具有抗病毒、提高机体免疫、及改善心脏功能。参芪扶正注射剂是以党参、黄芪为原料提取制成的注射液,具有活血化瘀、益气扶正的功效。党参内有丰富的氨基酸和多糖物质,可以增强机体的抵抗能力,加强网状内皮系统的吞噬功能,并减轻治疗中出现的毒副作用;黄芪可以诱导干扰素的生成,增强自然杀伤( natural killer,NK)细胞的活性参与免疫调节、抗肿瘤和抗病毒感染等过程[7]。参芪扶正注射剂被广泛应用于改善心血管疾病中,如心绞痛、心肌炎、冠心病、心力衰竭等,此外还用于辅助肿瘤治疗[7]。然而关于参芪扶正注射剂是否可以预防由抗PD-1单抗诱发的免疫性心肌炎,目前还未有明确实验验证。因此,本研究旨在探讨心肌炎患者治疗肿瘤时使用抗PD-1抗体是否会加重心肌炎,以及检测参芪扶正注射剂能否预防抗PD-1抗体造成的心肌炎损伤,为今后参芪扶正注射液临床辅助治疗由PD-1阻断药物诱导的心肌炎提供理论依据。
1 材料
1.1 实验动物4-5周龄,健康SPF级,C57BL/6的雄性PD-1人源化小鼠,体质量(18~22) g,购于北京维通达生物技术有限公司,实验动物生产许可证号SCXK(京)2019-0002。本实验经昆明医科大学动物伦理委员会批准(动物实验伦理审批号kmmu20221590)。实验小鼠普通饲料喂养,自由饮水,饲养于室温(20~22) ℃,1周后进行实验。
1.2 药物参芪扶正注射剂,规格250 mL/瓶(丽珠医药集团股份有限公司,批号201214);注射用重组人源化抗PD-1单克隆抗体(珠海市丽珠单抗生物技术有限公司,批号202104034,规格50 mg/瓶),使用生理盐水配制终浓度为4 mg·L-1的溶液,给药剂量为0.04 mg·kg-1;心肌肌球蛋白重链肽段——MyHc.0t614629[Ac-SLKLMATLFSTYASAD-OH](上海吉尔生化有限公司,纯度>90%,批号P21115-SJ074923);完全弗氏佐剂(sigma公司,批号SLCF1289);2%戊巴比妥钠(昆明医科大学动物中心)。
1.3 试剂与仪器酶标仪(美国BioTekInstruments公司,型号ELx800);荧光定量PCR仪(北京大龙兴创实验仪器股份公司,型号Accurate96);HRP-标记羊抗兔二抗(Invitrogen公司,批号WK337326A);SuperKineTM超敏型ECL发光液(亚科因生物技术有限公司,批号ATVF20051);RIPA裂解液(上海碧云天生物技术有限公司,批号082820210119);兔抗GAPDH(Cell Signaling Technology公司,5174S-8)、IL-1β(Proteintech公司,00106096)、TNF-α(Abcam公司,GR3359225-6)、BAX(Abcam公司,ab53154)、BCL-2(Abcam公司,ab32124)、Caspase-3(Abcam公司,ab32351)、Cleaved-Caspase-3(Abcam公司,ab2301);小鼠肌酸激酶同工酶ELISA试剂盒、小鼠肌钙蛋白ELISA试剂盒(购于北京华博德亿生物技术有限公司,批号分别为1147495、1147496);反转录试剂盒(TaKaRa公司,批号AJ40606A);实时荧光定量聚合酶链式(real-timePCR)试剂盒(TaKaRa公司,批号AK81977A)。
2 方法
2.1 动物模型建立实验性自身免疫性心肌炎模型(experimental autoimmune myocarditis,EAM)的建立根据相关文献[8],将小鼠来源的心肌肌球蛋白重链α溶于配制好的PBS液中(1 g·L-1),然后将其与相同体积的完全弗氏佐剂乳化充分后,使得终浓度为0.5 g·L-1,构建EAM的小鼠分别在试验第1天和第7天腹腔注射0.2 mL上述含有短肽的乳化剂,共腹腔注射2次,其余正常小鼠以生理盐水进行腹腔注射。
2.2 实验动物分组及干预将PD-1人源化小鼠进行随机分组处理,共分为4个小组:①对照组(Sham组,n=8);②心肌肌球蛋白重链肽诱导的心肌炎模型组(EAM组,n=8);③抗PD-1处理的心肌炎组(EAM+anti-PD1组,n=8);④参芪治疗组(EAM+anti-PD1+shenqi组,n=8)。分别在第1天和第7天时,sham组腹腔注射0.2 mL生理盐水,EAM组、EAM+anti-PD1组、EAM+anti-PD1+shenqi组腹腔注射0.2 mL含有短肽的乳化剂构建心肌炎模型;第8~22天,Sham组、EAM组、EAM+anti-PD1组小鼠每天以0.8 mL生理盐水进行灌胃处理,EAM+anti-PD1+shenqi组小鼠每天以0.8 mL参芪扶正注射剂进行灌胃,总共灌胃15次,根据相关文献参考确定参芪扶正注射剂使用体积[9];在第16、18、20、22天,Sham组、EAM组腹腔注射0.2 mL生理盐水,EAM+anti-PD1组、EAM+anti-PD1+shenqi组腹腔注射0.2 mL抗PD-1单克隆抗体,以间隔1 d的形式每组分别注射4次。在第23天时,小鼠经2%戊巴比妥钠(20 mg·kg-1)麻醉,眼眶取血后,处死全部小鼠,收集心脏,进行各项指标的检测。动物药物干预方法基于一定的考量因素(实验先给予参芪扶正注射剂治疗的原因是:参芪扶正注射剂的药物治疗周期需要15 d[9],而抗PD-1单克隆抗体的给药次数是根据文献参考设定为4次[10],为了验证心肌炎患者再使用抗PD-1单克隆抗体治疗肿瘤是否会加重心肌损伤,因此先建立EAM模型,以参芪扶正注射剂预防抗PD-1单克隆抗体所致的心肌损伤)。
2.4 蛋白质印迹法(Western blot)检测小鼠心脏组织中IL-1β、TNF-α、Bax/BCL-2、Cleaved caspase-3/caspase-3蛋白表达取下心脏组织后用预冷PBS冲洗3次,去除PBS冲洗液,加入含有蛋白酶抑制剂的预冷RIPA裂解缓冲液裂,使用高通量组织破碎仪(60 Hz,30 s/次)将心脏组织研磨裂解。研磨结束后离心取上清(即总蛋白),用BCA蛋白质测定试剂盒测定蛋白浓度后,加入蛋白上样缓冲液在95 ℃条件下进行蛋白变性5 min。蛋白变性后通过SDS-PAGE凝胶电泳分离目的蛋白,在冰浴条件下,采用湿转将蛋白质转移至PVDF膜。取出PVDF膜放入2%BSA封闭液中,室温封闭1 h后,将目的条带放至相对应的一抗中,包括GAPDH(1 ∶1 000)、IL-1β(1 ∶1 000)、TNF-α(1 ∶1 000)、Bax(1 ∶1 000)、BCL-2(1 ∶1 000)、Cleaved caspase-3(1 ∶1 000)、及caspase-3(1 ∶1 000),4 ℃摇床上孵育过夜。次日取出条带,用TBST洗3次,每次10 min,再加入羊抗兔二抗,室温孵育1 h。二抗孵育结束后,使用TBST洗3次,每次20 min。根据SuperKineTM超敏型ECL发光液说明书配制显影液,取出洗好的目的条带,将条带平放于成像仪里,均匀滴上显影液后,使用Tanon显影仪及GelCap ECL软件采集图像。
2.5 实时荧光定量聚合酶链反应(RT-qPCR)检测IL-1β、TNF-α、Bax/BCL-2 mRNA表达采用TRIzol法提取心脏总RNA,按照Prime ScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)说明书将RNA逆转录为cDNA。利用TB Green染料法定量试剂盒以cDNA为模板进行扩增,检测mRNA表达,所获数据通过2-ΔΔCt法进行处理与分析。实验所用引物均由北京擎科生物科技有限公司合成,引物序列见Tab 1。

Tab 1 Information for primer sequences
2.6 心脏病理特征检测将小鼠处死后取心脏用于苏木素-伊红(HE)染色,10%中性甲醛固定心脏,再进行常规石蜡包埋,切片厚度为1 cm,进行HE染色,梯度酒精脱水,中性树胶封固,镜下检测心脏组织心肌纤维变性坏死、炎性细胞浸润和纤维组织增生等病理改变。
2.7 血清生物标志物检测小鼠眼眶取500~1 000 μL血液,放至37 ℃ 1 h后,3 000 r·min-1离心5 min,取上清(即为血清),ELISA法检测小鼠血清中肌酸激酶同工酶(creatine kinase muscle brain,CK-MB)、心肌肌钙蛋白T(cardiac troponin T,cTNT)水平,实验操作严格按照说明书进行。

3 结果
3.1 PD-1人源化小鼠的心脏指标(心肌肥厚指标)的变化情况小鼠取样时,对体质量(body weight,BW)、心脏质量(heart weight,HW)、胫骨长度(tibial length,TL)进行称量及测量统计,以心脏质量/体质量(HW/BW)、心脏重量/胫骨长度(HW/TL)作为初步判断心肌肥厚指标。结果显示,与sham组相比,EAM组、EAM+anti-PD1组及EAM+anti-PD1+shenqi组差异均无统计学意义,提示心肌炎模型的建立以及抗PD-1单克隆抗体的给予不会对小鼠造成心肌肥厚的影响,见Fig 1。
3.2 心脏病理特征分析通过HE染色对小鼠心脏组织进行病理学分析,与对照组相比,EAM组局部心肌纤维变性,见心肌纤维内含大小不等的透亮空泡,胞核多偏于一侧;EAM+anti-PD1组心肌纤维变性坏死严重,坏死区域有淋巴细胞浸润,伴有少量纤维组织增生;参芪治疗组未见明显病变,见Fig 2。
3.3 参芪扶正注射剂可以降低由抗PD-1抗体所致的免疫性心肌炎IL-1β、TNF-α的蛋白水平与对照组相比,EAM组IL-1β、TNF-α的蛋白表达均明显升高(P<0.05),表明心肌炎模型构建成功;给予抗PD-1单克隆抗体处理后的EAM+anti-PD1组与EAM组相比,抗PD-1单抗会加重心肌炎诱导的炎症反应(P<0.05);参芪扶正注射剂治疗组与EAM+anti-PD1组相比,参芪扶正注射剂降低了IL-1β、TNF-α的蛋白水平(P<0.05),提示参芪扶正注射剂可以预防由抗PD-1抗体加重的心肌损伤,见Fig 3。
为解决问题,首先要将数据中心中的耗电负载进行分类。根据PUE的定义,可分为IT负载、供配电设备、制冷设备、其他设施四大类,如表1所示:
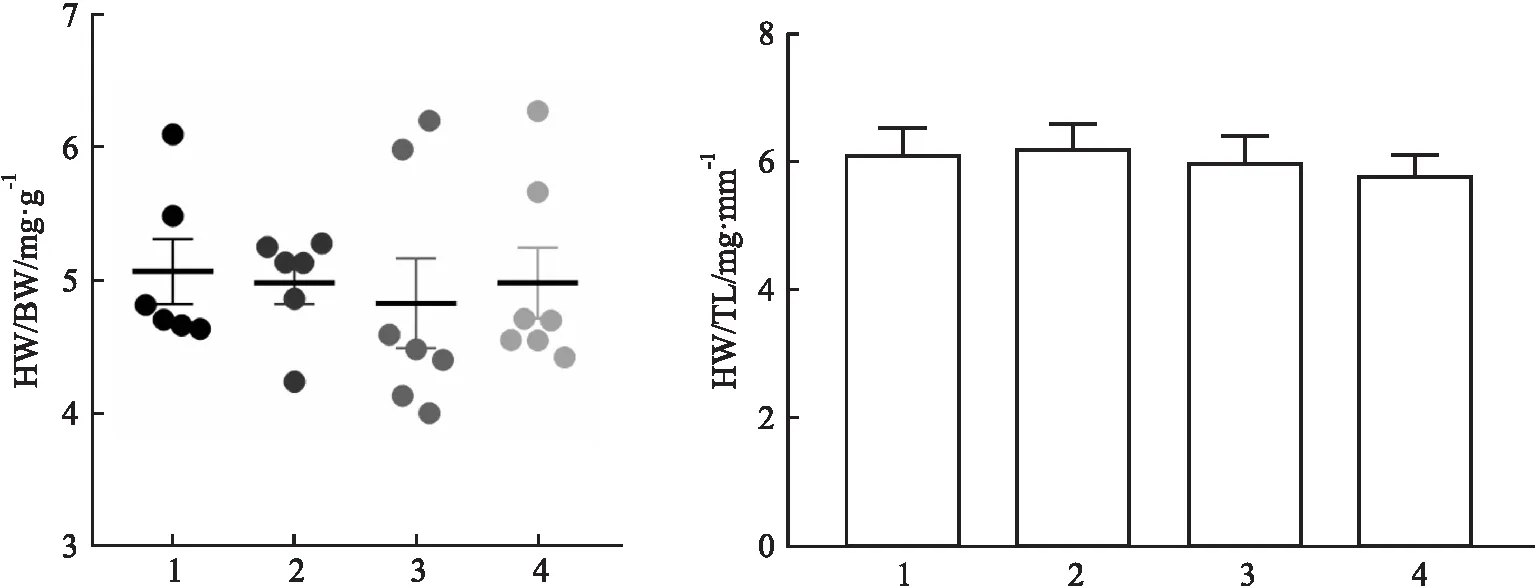
Fig 1 Changes in cardiac indexes of PD-1 humanized mice treated with different
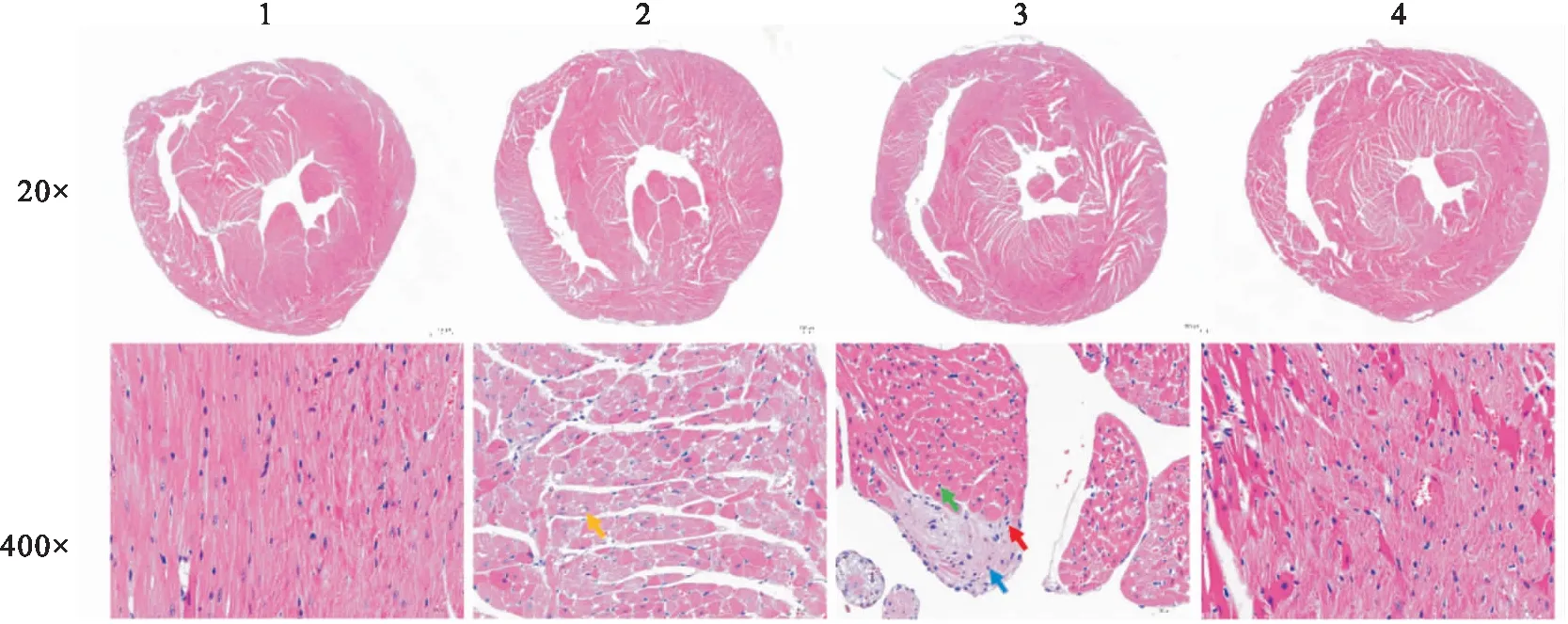
Fig 2 Cardiac histopathological changes in different groups of treated mice(HE staining)
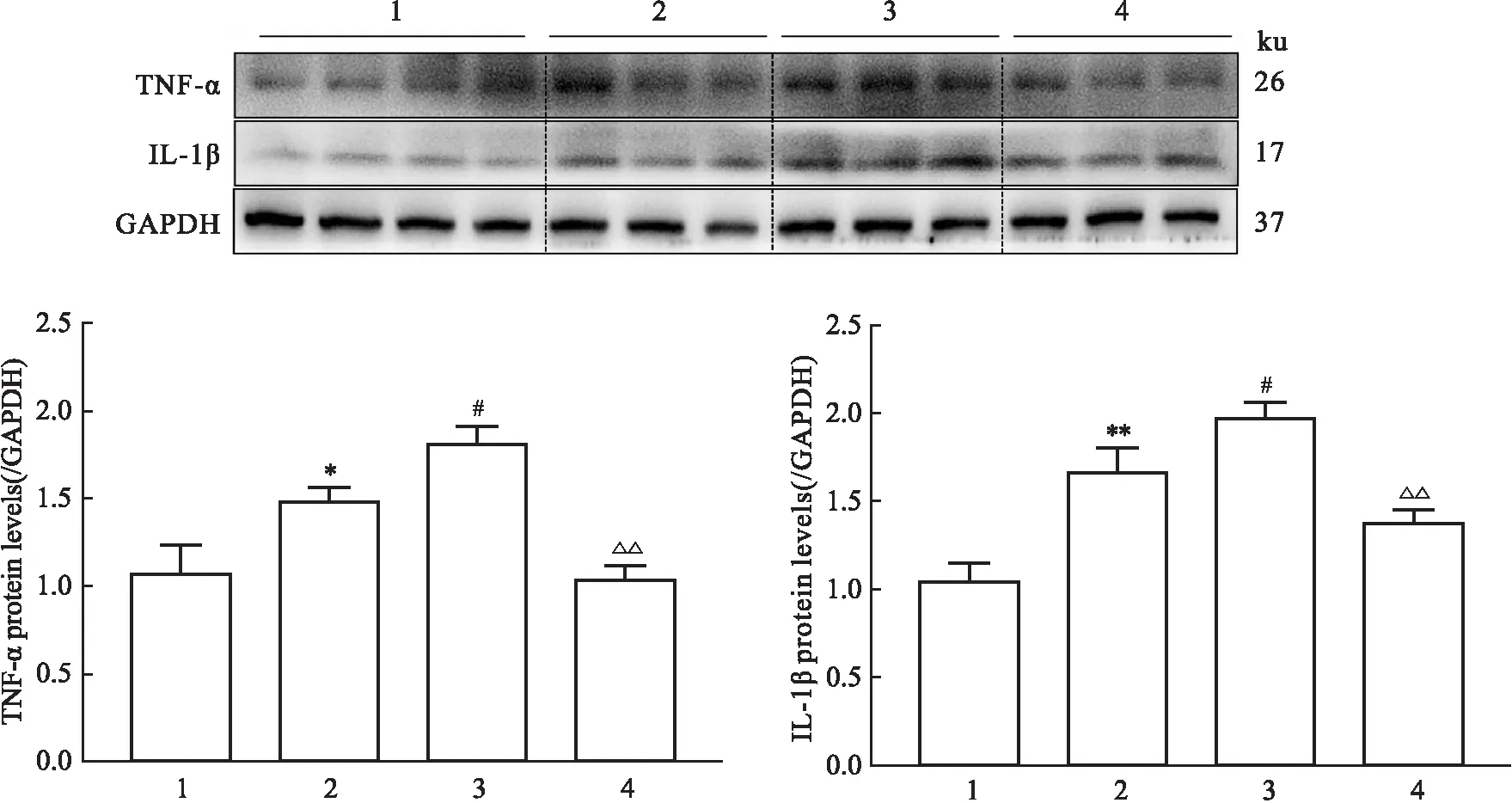
Fig 3 Changes of protein levels of IL-1β and TNF-α in each group after Shenqi Fuzheng
3.4 参芪扶正注射剂可以降低由抗PD-1抗体所致的免疫性心肌炎Bax/BCL-2、Cleaved-caspase-3/caspase-3的蛋白水平与对照组相比,EAM组Bax/BCL-2、Cleaved-caspase-3/caspase-3的蛋白表达比值均明显升高(P<0.05),表明心肌炎模型构建成功;给予抗PD-1单克隆抗体处理后的EAM+anti-PD1组与EAM组相比,抗PD-1单抗会加重心肌炎诱导的细胞凋亡(P<0.05);参芪扶正注射剂治疗组与EAM+anti-PD1组相比,参芪扶正注射剂降低了Bax/BCL-2、Cleaved-caspase-3/caspase-3的蛋白水平(P<0.05),提示参芪扶正注射剂可以预防由抗PD-1抗体加重心肌损伤,见Fig 4。
3.5 参芪扶正注射剂降低由抗PD-1抗体所致的免疫性心肌炎IL-1β、TNF-α、Bax/BCL-2的mRNA水平与对照组相比,EAM组IL-1β、TNF-α、Bax/BCL-2的mRNA水平都明显升高(P<0.05),进一步验证心肌炎模型构建成功;与EAM组相比,EAM+anti-PD1组三者的mRNA表达水平升高(P<0.05),提示心肌炎患者在使用抗PD-1单克隆抗体抗肿瘤时,有增加心肌损伤的风险;与EAM+anti-PD1组相比,参芪扶正注射剂治疗后降低IL-1β、TNF-α、Bax/BCL-2的mRNA水平,提示参芪扶正注射剂可减轻心肌损伤,见Fig 5。
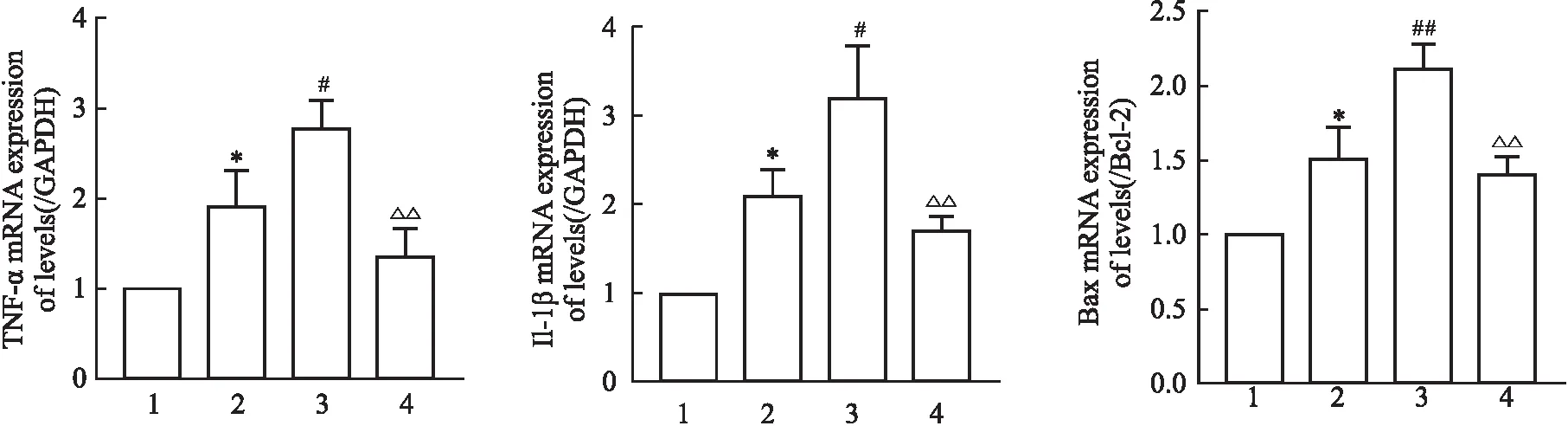
Fig 5 Changes of mRNA levels of IL-1β, TNF-α and Bax/BCL-2 in each group after Shenqi Fuzheng
3.6 血清中心肌损伤标记物CK-MB、c-TNT水平心肌损伤标志指标包括CK-MB、cTNT等[11],与对照组小鼠相比,心肌炎模型组的CK-MB、cTNT水平上升(P<0.05),表明心肌炎建模成功;与肌炎模型组相比,EAM+anti-PD1组CK-MB、cTNT水平上升(P<0.05),暗示抗PD-1单抗会加重心肌炎损伤;再给予参芪扶正注射剂治疗后,可以明显降低CK-MB、cTNT水平,减轻由抗PD-1抗体加重的心肌损伤,见Fig 6。
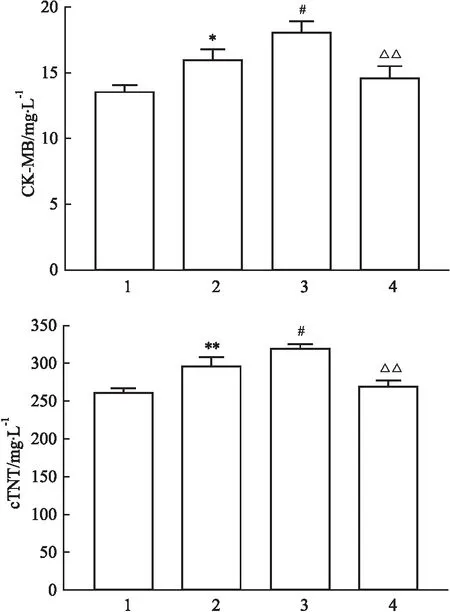
Fig 6 Changes of CK-MB and cTNT levels between groups
4 讨论
PD-1是一种主要在T细胞、B细胞、NK细胞等细胞表面抗体的开发与利用为治疗肿瘤提供了更加深入的研究方向,帮助肿瘤患者获得强有力的疗效,目前广泛用于临床治疗。然而,随着抗PD-1抗体的广泛应用,越来越多的不良反应被报道,其中最为严重的就是心脏毒性[2]。关于抗PD-1抗体诱发心脏毒性的具体作用机制还未被研究清楚,有研究报道,抗PD-1抗体可能会导致机体免疫耐受下调,T细胞被过度激活,刺激各种细胞炎症因子[12],同时还可能识别心脏和肿瘤组织中的共同抗原[13],从而造成了心肌炎症细胞浸润和心肌纤维化等心肌损伤。因此,本实验主要是为了研究抗PD-1抗体是否会在PD-1小鼠心肌炎的基础上进一步加重心肌损伤,验证参芪扶正注射剂是否可以改善由抗PD-1抗体造成的PD-1小鼠的免疫性心肌炎。
免疫性心肌炎会产炎症细胞浸润、组织细胞中释放大量细胞因子和炎症介质,从而导致心脏毒性,造成不可逆的损伤[14]。有报道称,约有94%~97%的心肌炎患者伴有如CK-MB、cTNT等心肌损伤标志物表达升高,心肌标志物水平的变化成为检测心肌炎的主要手段之一,心肌标志物表达的升高程度反映了心肌损害的程度。本研究中心肌炎小鼠血清中CK-MB、cTNT水平升高,但差异无统计学意义(P>0.05),而模拟抗PD-1抗体处理的CK-MB、cTNT水平明显高于对照组(P<0.05),表明心肌受到损害。给予参芪扶正注射剂治疗后,CK-MB、cTNT水平均显著降低,验证了我们关于参芪扶正注射剂可以预防抗PD-1抗体加重心肌炎损伤的猜想。
心肌炎损伤通常伴随着病理改变,其中在心肌纤维化和炎性细胞浸润中研究较多,是许多心血管疾病的病理标志。心肌纤维化具体表现为纤维化组织的区域性或弥漫性积聚[15],淋巴细胞浸润是慢性炎细胞浸润的主要检测指标。本研究中,所有心脏组织心外膜结构完整,对照组未见炎性细胞浸润和纤维组织增生;心肌炎组局部心肌纤维变性,表明心肌发生病变;心肌炎基础上抗PD-1抗体处理后,心肌膜心肌纤维呈螺旋状排列,局部心肌纤维变性坏死,部分淋巴细胞浸润,亦见少量纤维组织增生,主要以纤维细胞和成纤维细胞为主,说明抗PD-1抗体可能会加重心肌病变;而给予参芪扶正注射剂治疗后,淋巴细胞浸润和心肌纤维化的情况明显改善,进一步验证了参芪扶正注射剂可以改善心肌损伤。
细胞炎症伴随着IL-1β、TNF-α等细胞因子的表达,免疫性心肌炎的发生会刺激机体产生过量的TNF-α、IL-1β。本实验中,心肌炎小鼠中的IL-1β、TNF-α与对照组相比均显著升高(P<0.05),说明使用短肽的乳化剂成功构建了PD-1小鼠心肌炎模型。在炎症因子的蛋白以及mRNA表达水平上,抗PD-1抗体的使用会加重炎症反应,说明心肌炎患者使用抗PD-1抗体治疗肿瘤时在一定程度上可能会加重心肌损伤。给予参芪扶正注射剂治疗后,IL-1β、TNF-α蛋白以及mRNA水平均下降,进一步说明使用参芪扶正注射剂可以预防抗PD-1单抗加重的心肌炎症反应。
此外,在心肌炎过程中伴随着一定的心肌细胞死亡,包含:细胞凋亡、细胞坏死、细胞程序性坏死。其中以Bax/BCL-2比值以及Cleaved-caspase-3/caspase-3的比值作为两大最常见的细胞凋亡指标。Bax/BCL-2比值决定着细胞凋亡的走向,caspase-3是凋亡过程中最关键的凋亡执行蛋白酶,Bax和BCL-2可作为caspase-3的上游调控靶点,caspase-3经剪切后形成活化的Cleaved-caspase-3,执行自身免疫性心肌炎诱导细胞凋亡过程。使用两种比值,可以检测出心肌炎以及抗PD-1抗体诱导的凋亡水平变化,明确参芪扶正注射剂预防炎症因子产生的同时也能预防心肌细胞凋亡。
心肌炎的发生伴随着炎症反应以及部分心肌细胞的凋亡,我们的研究证明了参芪扶正注射剂可以预防此类现象的发生,但关于参芪扶正注射剂如何减少炎症和凋亡的具体机制还未得到明确。未来我们会继续就参芪扶正注射剂改善心肌炎的具体作用机制展开研究,目前我们推断参芪扶正注射剂改善炎症损伤可能是通过巨噬细胞的调控。参芪扶正注射剂内的主要材料为党参和黄芪,党参内含生物碱、皂苷和多糖,可以诱导巨噬细胞的活化[16]。巨噬细胞是防御病原体入侵宿主以及抑制肿瘤生长的重要免疫细胞,巨噬细胞不仅可以对凋亡细胞进行吞噬减少炎症的发生,还可以在吞噬过程中和凋亡细胞/凋亡细胞代谢物直接作用从而获取抗炎作用[17]。黄芪可以诱导干扰素的生成,有研究表明在免疫性疾病慢性肉芽肿性疾病(chronic granulomatous disease)中,巨噬细胞吞噬凋亡细胞的能力下降,而II型干扰素(IFN-γ)以NO依赖性的方式逆转了这种现象的发生[18]。以上研究提示,参芪扶正注射剂改善心肌损伤可能是通过巨噬细胞来达到抗凋亡、抗炎症作用,并还可能涉及IFN-γ改善巨噬细胞吞噬能力。但关于参芪扶正注射剂是诱导Ⅰ、Ⅱ或Ⅲ型干扰素参与调控过程,或是通过直接调控巨噬细胞参与调控还未可知,这也为我们未来的研究提供了一定的研究基础。
目前,关于抗PD-1抗体引起的免疫不良反应,专家普遍建议为停用,以免造成更加严重的心脏毒性[6]。但在某种特定情况下必须使用时,绝大多数抗PD-1抗体诱发的相关免疫性心肌炎一般都会加以糖皮质激素治疗心力衰竭、心肌重构等心肌损伤,如口服强的松或静脉使用甲基强的松龙[6]。然而,这种预后手段又会诱导一些其他的机体副作用,如高血压、心肌肥厚等。因此,本研究中使用的参芪扶正注射剂,不仅可以降低了心肌损伤以及抗PD-1抗体造成的心脏毒性,而且根据我们对心肌肥厚初步指标的结果分析,参芪扶正注射剂治疗不会造成心肌肥厚。本研究为治疗抗PD-1抗体造成的心脏毒性提供了一种新的治疗方案,为治疗ICI诱发心脏毒性提供了新的研究方向,对于其发病机制的研究、治疗药物的筛选以及参芪扶正注射剂治疗免疫相关不良反应提供初步的参考数据。
综上所述,本研究探讨了参芪扶正注射剂作为一种治疗药物改善了抗PD-1抗体诱发的心脏毒性。在心肌炎基础上使用抗PD-1抗体会加重心肌损伤,而参芪扶正注射剂逆转了这种心肌损伤,为防治抗PD-1抗体诱发心脏免疫性不良反应提供新的治疗策略。