黄芪甲苷对肺炎链球菌感染的肺泡上皮细胞损伤的保护作用及机制
徐永妮,李 烁,赵智凝
(空军军医大学西京医院第九八六医院检验病理科,西安 710054;*通讯作者,E-mail:h0erxx@163.com)
细菌性肺炎是一种感染性肺部疾病,肺炎链球菌作为一种革兰阳性菌,是引起细菌性肺炎常见的病原体,其入侵宿主无菌部位后,免疫系统受到抑制,促使肺炎链球菌通过肺泡上皮的迁移,最终导致肺部感染[1,2]。因此,研究肺炎链球菌感染肺泡上皮细胞的作用机制对细菌性肺炎的治疗具有重要意义。黄芪甲苷(astragaloside Ⅳ,AS-Ⅳ)来源于黄芪根部,具有抗炎、抗病毒、抗氧化等作用,对心血管疾病、肺病和神经系统疾病等具有保护作用[3,4]。研究显示黄芪甲苷能够减轻肺炎链球菌诱导的肺泡上皮细胞凋亡和炎症反应[5],但具体的作用机制还尚未研究。转录启动因子1(Sirtuin 1,SIRT1)是一种NAD+依赖性去乙酰化酶,参与细胞分化、凋亡、能量代谢等。磷酸腺苷活化蛋白激酶(adenosine monophosphate-activated protein kinase,AMPK)作为SIRT1的下游因子,主要调节细胞的能量代谢[6]。据了解,启动SIRT1/AMPK通路对脂多糖(lipopolysaccharide,LPS)诱导的肺泡上皮屏障功能具有保护作用,而黄芪甲苷可以通过启动SIRT1/AMPK信号通路改善血管内皮功能障碍[7,8]。因此,本研究通过观察肺泡上皮细胞的增殖、凋亡及蛋白表达情况,探讨黄芪甲苷对肺炎链球菌感染的肺泡上皮细胞损伤的作用及其具体作用机制。
1 材料与方法
1.1 材料
1.1.1 细胞和菌株 人正常肺泡上皮细胞A549(批号CBP30021L)购自南京科佰生物科技有限公司,ATCC BAA-255肺炎链球菌(批号092144)购自上海硕欣生物科技有限公司。
1.1.2 主要试剂和仪器 黄芪甲苷(批号202208,北京凯诗源生物科技有限公司);EX527(SIRT1抑制剂,批号15452,美国Med chem Express公司);脱纤维羊血、THB培养基(批号分别是1001339、HB0311-3,北京普非生物科技有限公司);MTT细胞活性检测试剂盒(批号C11019,广州市锐博生物科技有限公司);5-溴-2′-脱氧尿苷(BrdU,批号A1397,北京康瑞纳生物科技有限公司);Annexin Ⅴ-FITC/PI双染细胞凋亡检测试剂盒(批号FY600003,上海弗元生物科技有限公司);白细胞介素6(IL-6)、白细胞介素1β(IL-1β)、肿瘤坏死因子α(TNF-α)ELISA检测试剂盒(批号DS647、3648D、DS636,上海优利科生命科学有限公司);反转录试剂盒、实时荧光定量PCR试剂盒(批号分别是11119、11184,翌圣生物科技股份有限公司);BrdU、SIRT1、AMPK、p-AMPK一抗(批号分别是ab6326、ab189494、ab32047、ab92701,英国abcam公司);荧光标记及辣根过氧化物酶标记的山羊抗兔IgG(批号1053、1102,武汉伊莱瑞特生物科技股份有限公司);Bcl-2、Bax、cleaved Caspase-3、GAPDH引物设计与合成(上海生工生物工程有限公司);NanoDrop One/OneC微量核酸蛋白浓度测定仪(赛默飞世尔科技(中国)有限公司);CFX96实时荧光定量PCR仪(上海伯乐生命医学产品有限公司);CytoFLEX流式细胞仪(上海贝克曼库尔特国际贸易有限公司);Tecan Spark多功能酶标仪(上海帝肯实验器材有限公司)。
1.2 方法
1.2.1 细胞培养 将肺泡上皮细胞A549用含有10%胎牛血清和1%双抗(青霉素-链霉素混合液)的DMEM培养基放在37 ℃,5% CO2培养箱中培养,待细胞汇合率达到80%时开始传代。肺炎链球菌用含有5%的脱纤维羊血的平板培养,并在实验开始之前放入含0.5%酵母的Todd-Hewitt肉汤(Todd Hewitt broth,THB)液体培养基中培养过夜。
1.2.2 细胞分组与处理 将传代后培养至生长对数期细胞分为对照组、感染组、黄芪甲苷低、中、高浓度组、黄芪甲苷+SIRT1抑制剂组(黄芪甲苷+EX527组)。对照组用DEME培养基培养,感染组用1×108CFU/ml肺炎链球菌培养细胞24 h[9],黄芪甲苷低、中、高浓度组细胞分别用浓度为10,20,40 μmol/L的黄芪甲苷培养48 h后,收集细胞用PBS清洗,再用1×108CFU/ml肺炎链球菌培养24 h[10],黄芪甲苷+EX527组细胞用含有40 μmol/L黄芪甲苷和200 nmol/L SIRT1抑制剂EX527[6]的培养基共培养48 h后,收集细胞用1×108CFU/ml肺炎链球菌培养24 h。
1.2.3 MTT检测细胞增殖 收集各组细胞以每孔1×104个细胞接种到96孔板中,培养24 h后每孔加入20 μl MTT溶液,继续孵育4 h。然后吸弃上清液,加150 μl DMSO,振荡10 min,使结晶物充分融解。用酶标仪检测490 nm处各孔的吸光值,并计算细胞存活率。
1.2.4 BrdU法检测细胞增殖 将细胞接种至24孔板中,按分组培养24 h后,每孔中加入10 μmol/L的BrdU孵育2 h。然后将细胞用4%多聚甲醛固定,加入BrdU抗体在37 ℃下孵育2 h,再用山羊抗兔荧光二抗孵育1 h,最后加入DAPI进行核染,在激光共聚焦显微镜下观察细胞染色情况,并计算BrdU阳性细胞(绿色荧光)的比例,以此表示细胞增殖率。
1.2.5 流式细胞术检测细胞凋亡 收集各组细胞用PBS洗涤,4 ℃,200g离心5 min,收集细胞沉淀加入200 μl Binding Buffer重悬细胞,再分别加入5 μl Annexin Ⅴ-FITC和10 μl碘化丙啶(PI)染色液混匀,避光放置10 min。流式细胞仪检测细胞凋亡率。
1.2.6 酶联免疫吸附实验(ELISA)检测细胞培养液中IL-6、IL-1β、TNF-α的含量 收集各组细胞上清液,然后利用ELISA试剂盒的标准品制备标准曲线,并依据操作步骤处理待测样品,用酶标仪测定其在450 nm处的吸光值,利用标准曲线计算IL-6、IL-1β、TNF-α的含量。
1.2.7 实时荧光定量PCR(qRT-RCR)检测Bcl-2、Bax、cleaved Caspase-3 mRNA的表达 收集各组细胞提取总RNA,并用微量核酸蛋白浓度测定仪测定RNA浓度,利用试剂盒将RNA反转录为cDNA。然后按照荧光定量试剂盒说明书进行qPCR,反应体系为SYBR Green Master Mix 10 μl,上下游引物各0.4 μl,cDNA 1 μl,水8.2 μl。反应程序:95 ℃预变性2 min;2步法:95 ℃变性10 s,60 ℃退火30 s,40个循环,熔解曲线95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。以GAPDH为内参,采用2-ΔΔCt法计算细胞中mRNA的相对表达量,引物序列见表1。
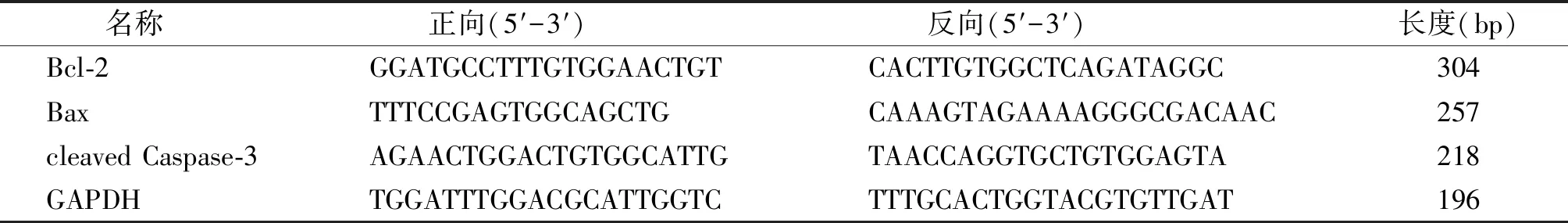
表1 RT-qRCR引物
1.2.8 蛋白免疫印迹法(Western blot)检测SIRT1、AMPK、p-AMPK蛋白的表达 收集各组培养的细胞,加入蛋白裂解液提取总蛋白,用BCA试剂盒测定蛋白浓度。将变性后的蛋白样品用10% SDS-PAGE分离总蛋白,并将目的蛋白转至PVDF膜。将PVDF膜取出用TBST清洗3次,置于5%的脱脂牛奶中封闭2 h,TBST冲洗后放入脱脂牛奶配制的一抗稀释液(SIRT1、AMPK、p-AMPK稀释比例1∶1 000)中,4 ℃孵育过夜,再放入羊抗兔二抗稀释液(1∶1 000)中,室温孵育2 h,继续用TBST清洗3次,放入显影剂中避光显色10 min。用蛋白凝胶成像系统观察蛋白条带并拍照,并以GAPDH为内参蛋白,利用Image J软件分析蛋白条带灰度值。
1.3 统计学分析

2 结果
2.1 黄芪甲苷对A549细胞增殖的影响
MTT和BrdU实验结果显示,与对照组相比,感染组细胞存活率及BrdU阳性细胞率显著降低(P<0.05);与感染组相比,黄芪甲苷低、中、高浓度组细胞存活率及BrdU阳性细胞率升高(P<0.05);与黄芪甲苷低浓度组相比,黄芪甲苷中、高浓度组细胞增殖活性升高(P<0.05);与黄芪甲苷中浓度组相比,黄芪甲苷高浓度组细胞存活率及BrdU阳性细胞率升高(P<0.05);与黄芪甲苷高浓度组相比,黄芪甲苷+EX527组细胞存活率及BrdU阳性细胞率降低(P<0.05,见图1和表2)。
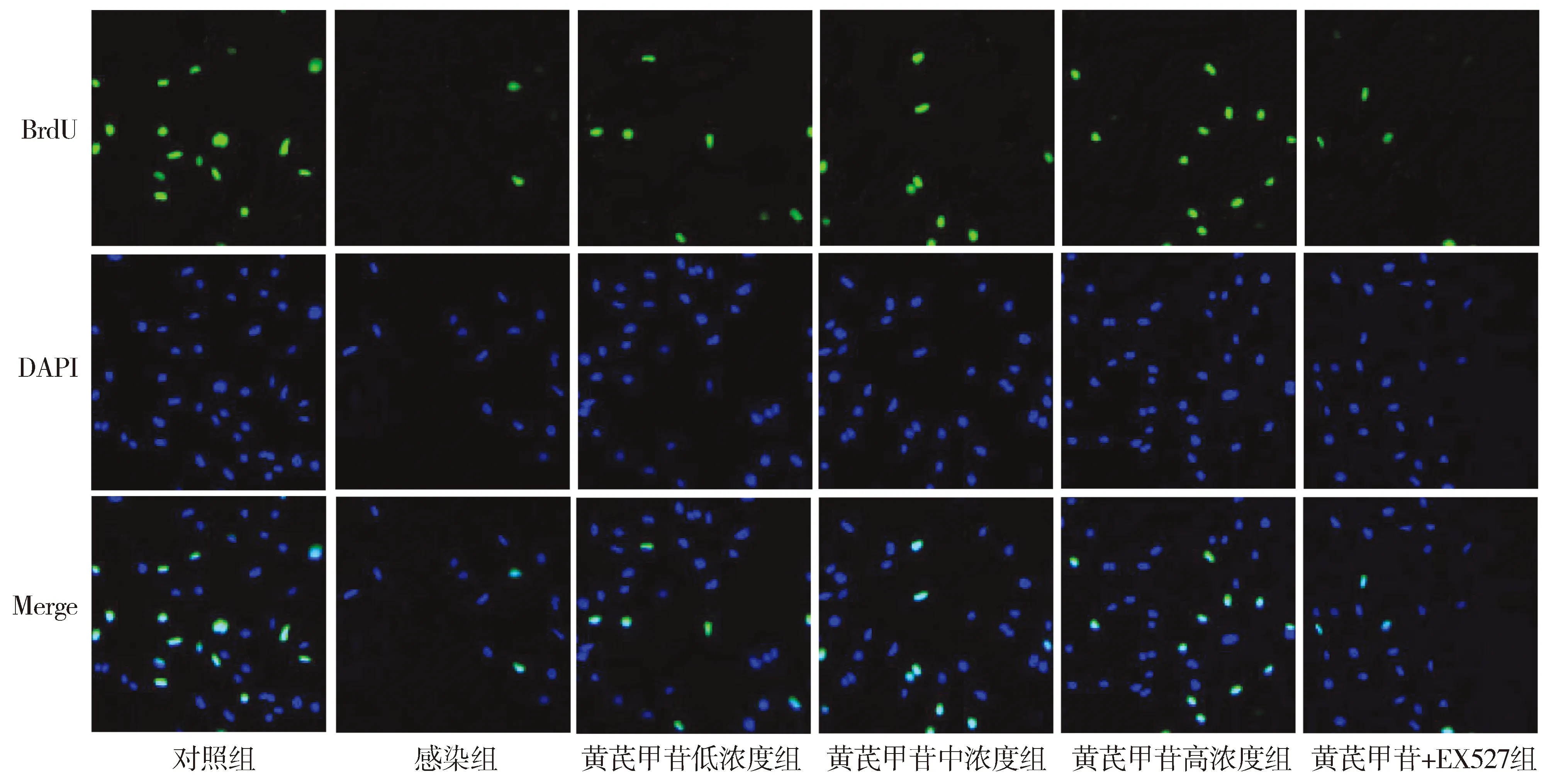
图1 BrdU实验检测黄芪甲苷对A549细胞增殖的影响 (×200)
表2 黄芪甲苷对A549细胞增殖的影响
2.2 黄芪甲苷对A549细胞凋亡的影响
与对照组相比,感染组细胞凋亡率升高(P<0.05);与感染组相比,黄芪甲苷低、中、高浓度组细胞凋亡率降低(P<0.05);与黄芪甲苷低浓度组相比,黄芪甲苷中、高浓度组细胞凋亡率降低(P<0.05);与黄芪甲苷中浓度组相比,黄芪甲苷高浓度组细胞凋亡率降低(P<0.05);与黄芪甲苷高浓度组相比,黄芪甲苷+EX527组细胞凋亡率升高(P<0.05,见表3和图2)。
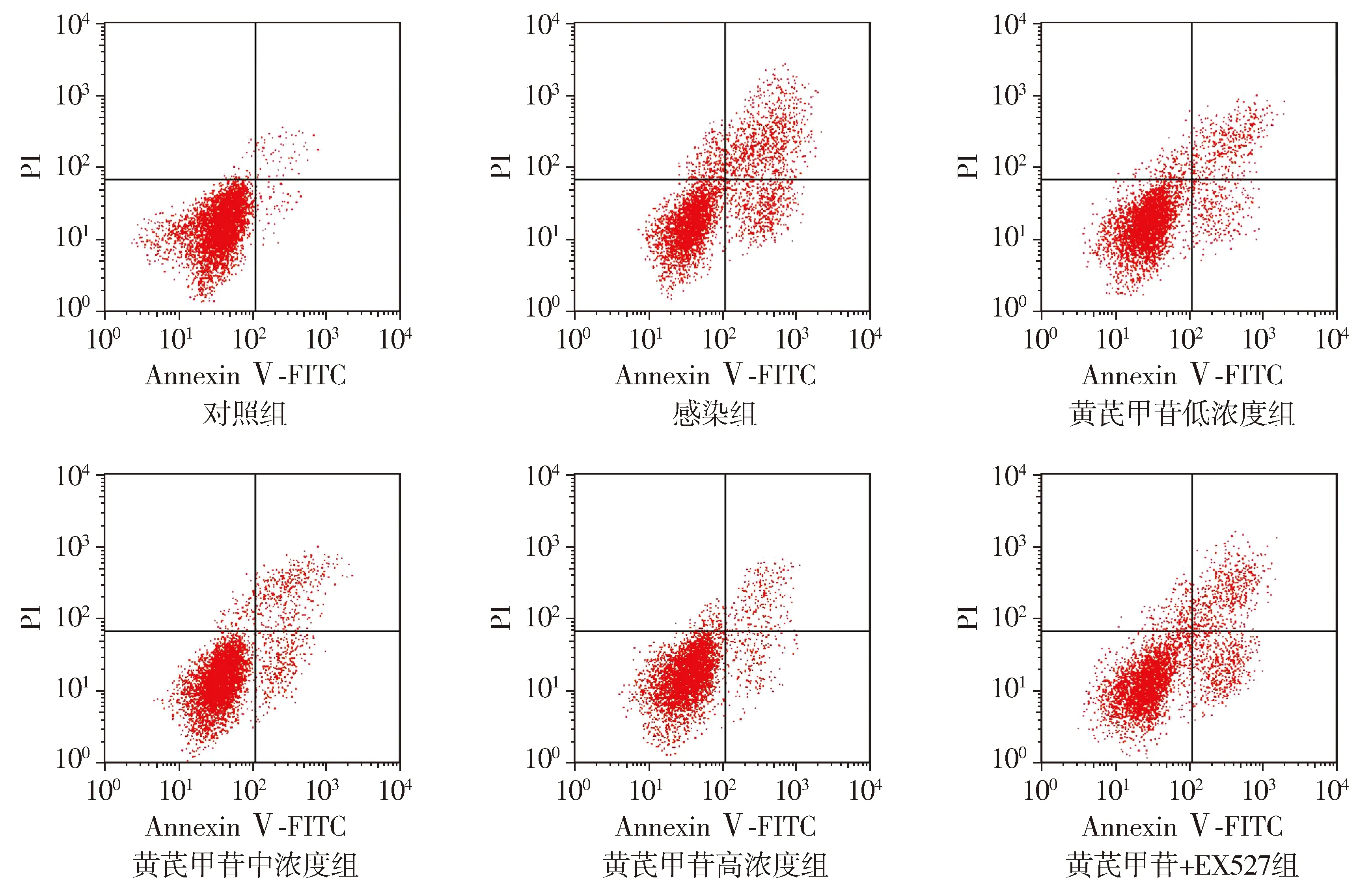
图2 流式细胞术检测黄芪甲苷对A549细胞凋亡的影响
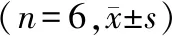
表3 黄芪甲苷对A549细胞凋亡率的影响
2.3 黄芪甲苷对A549细胞培养液中IL-6、IL-1β、TNF-α含量的影响
与对照组相比,感染组细胞培养液中IL-6、IL-1β、TNF-α含量升高(P<0.05);与感染组相比,黄芪甲苷低、中、高浓度组细胞培养液中IL-6、IL-1β、TNF-α含量降低(P<0.05);与黄芪甲苷低浓度组相比,黄芪甲苷中、高浓度组细胞培养液中IL-6、IL-1β、TNF-α含量降低(P<0.05);与黄芪甲苷中浓度组相比,黄芪甲苷高浓度组细胞培养液中IL-6、IL-1β、TNF-α含量降低(P<0.05);与黄芪甲苷高浓度组相比,黄芪甲苷+EX527组细胞培养液中IL-6、IL-1β、TNF-α含量升高(P<0.05,见表4)。
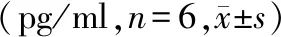
表4 黄芪甲苷对A549细胞培养液中IL-6、IL-1β、TNF-α含量的影响
2.4 黄芪甲苷对A549细胞中Bcl-2、Bax、cleaved Caspase-3 mRNA表达的影响
与对照组相比,感染组细胞中Bcl-2 mRNA表达降低,Bax、cleaved Caspase-3 mRNA表达升高(P<0.05);与感染组相比,黄芪甲苷低、中、高浓度组细胞中Bcl-2 mRNA表达升高,Bax、cleaved Caspase-3 mRNA表达降低(P<0.05);与黄芪甲苷低浓度组相比,黄芪甲苷中、高浓度组细胞中Bcl-2 mRNA表达升高,Bax、cleaved Caspase-3 mRNA表达降低(P<0.05);与黄芪甲苷中浓度组相比,黄芪甲苷高浓度组细胞中Bcl-2 mRNA表达升高,Bax、cleaved Caspase-3 mRNA表达降低(P<0.05);与黄芪甲苷高浓度组相比,黄芪甲苷+EX527组细胞中Bcl-2 mRNA表达降低,Bax、cleaved Caspase-3 mRNA表达升高(P<0.05,见表5)。
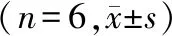
表5 黄芪甲苷对A549细胞中Bcl-2、Bax、cleaved Caspase-3 mRNA表达的影响
2.5 黄芪甲苷对A549细胞中SIRT1、AMPK、p-AMPK/AMPK蛋白表达的影响
Western blot结果发现,AMPK在各组细胞中均无显著变化。与对照组相比,感染组细胞中SIRT1、p-AMPK蛋白表达及p-AMPK/AMPK降低(P<0.05);与感染组相比,黄芪甲苷低、中、高浓度组细胞中SIRT1、p-AMPK蛋白表达及p-AMPK/AMPK升高(P<0.05);与黄芪甲苷低浓度组相比,黄芪甲苷中、高浓度组细胞中SIRT1、p-AMPK蛋白表达及p-AMPK/AMPK升高(P<0.05);与黄芪甲苷中浓度组相比,黄芪甲苷高浓度组细胞中SIRT1、p-AMPK蛋白表达及p-AMPK/AMPK升高(P<0.05);与黄芪甲苷高浓度组相比,黄芪甲苷+EX527组细胞中SIRT1、p-AMPK蛋白表达及p-AMPK/AMPK降低(P<0.05,见表6和图3)。
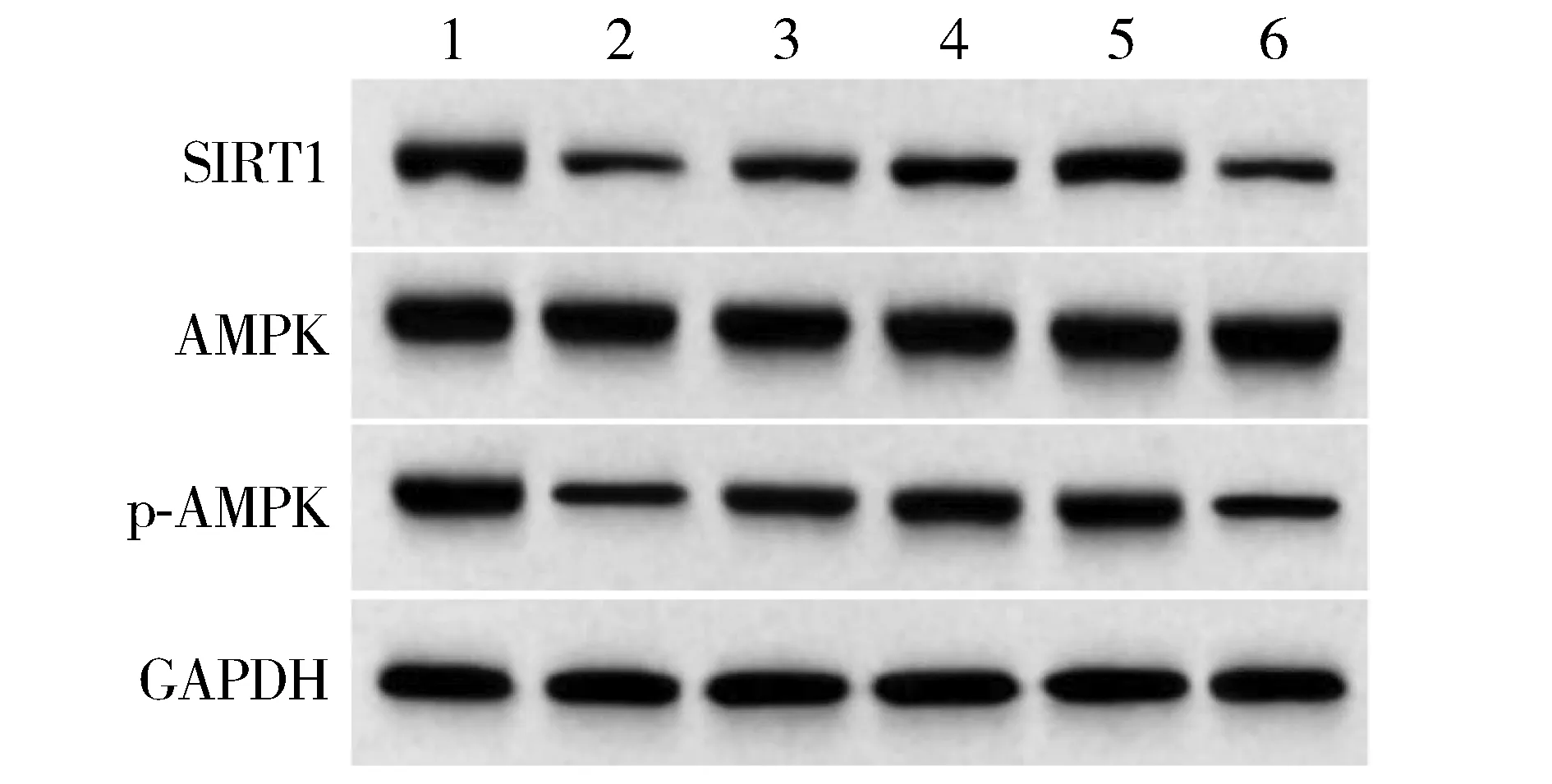
1.对照组;2.感染组;3.黄芪甲苷低浓度组;4.黄芪甲苷中浓度组;5.黄芪甲苷高浓度组;6.黄芪甲苷+EX527组
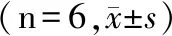
表6 黄芪甲苷对A549细胞中SIRT1、p-AMPK、p-AMPK/AMPK蛋白表达的影响
3 讨论
肺炎链球菌是一种高度适应人类的病原体,其作为呼吸道微生物群中常见的无症状成员,具有引起黏膜和侵袭性疾病的能力,包括肺炎、中耳炎、脑膜炎等[11]。其中由肺炎链球菌感染引起的细菌性肺炎在世界上仍然有较高的发病率和死亡率,当人类肺细胞和组织被肺炎链球菌感染后会引起强烈的促炎反应,进一步导致细胞死亡,且已知IL-6、IL-1β、TNF-α是评估肺泡上皮细胞损伤程度的重要炎性细胞因子[5,12,13]。因此,本研究对细胞中IL-6、IL-1β、TNF-α的水平进行检测,结果发现,感染组肺泡上皮细胞的存活率及BrdU阳性细胞率明显低于对照组,细胞凋亡率以及其培养液中促炎因子IL-6、IL-1β、TNF-α的含量明显高于对照组。表明肺炎链球菌成功感染了肺泡上皮细胞并引起炎性损伤。而黄芪甲苷不同浓度处理后细胞的存活率及BrdU阳性细胞率升高,凋亡率以及IL-6、IL-1β、TNF-α的含量明显降低。提示黄芪甲苷能够促进肺泡上皮细胞的增殖,抑制细胞凋亡和炎症反应,从而减轻肺炎链球菌感染引起的损伤。接着又检测了凋亡相关蛋白的表达,已知抗凋亡蛋白Bcl-2和促凋亡蛋白Bax均是细胞凋亡的关键调节因子,而当细胞发生凋亡时,pro-Caspase-9被转化为其活性形式,并作用于Caspase-3前体形成cleaved Caspase-3[14,15]。结果显示,与感染组相比,黄芪甲苷处理组细胞中Bcl-2 mRNA表达升高,Bax和cleaved Caspase-3 mRNA表达降低。以上结果进一步验证了黄芪甲苷对肺炎链球菌感染的肺泡上皮细胞凋亡的抑制作用,这与先前的研究结果[5]保持一致,但具体的作用机制还需进一步了解。
SIRT1是调节能量代谢的关键因子,也是细胞存活的重要组成部分,其可以作用于细胞的增殖、凋亡以及炎症反应[16]。AMPK作为SIRT1的下游基因,也是生物能量代谢调节的关键,在各种类型的细胞中参与脂质代谢、炎症和血管生成的调节[17]。当AMPK被启动后可以增加细胞内NAD+水平,从而建立代谢反馈机制,使SIRT1活性增强,导致SIRT1靶蛋白的去乙酰化,调节线粒体功能和维持能量平衡[18,19]。有研究发现,诱导启动SIRT1/AMPK信号通路可以抑制炎症和细胞凋亡,从而保护缺血再灌注引起的肺上皮细胞损伤[20]。本研究结果显示,感染组细胞中SIRT1和磷酸化AMPK蛋白表达降低,黄芪甲苷处理组SIRT1和磷酸化AMPK蛋白表达升高。表明黄芪甲苷可以启动SIRT1表达,从而介导下游AMPK蛋白磷酸化。而加入SIRT1抑制剂EX527后,黄芪甲苷促进肺泡上皮细胞增殖,抑制其凋亡和炎症反应的作用被逆转,且AMPK磷酸化表达降低。进一步揭示了黄芪甲苷能够减轻肺炎链球菌引起的肺泡上皮细胞损伤的作用机制可能与调控SIRT1/AMPK信号通路有关。
综上所述,黄芪甲苷通过调控SIRT1/AMPK信号通路,减轻肺炎链球菌感染引起的肺泡上皮细胞损伤。本研究为肺炎链球菌等细菌感染引起的肺部疾病提供了新的治疗思路和依据。但本研究仍然存在一定的局限性,首先本研究仅在细胞中进行了体外实验,并未探讨黄芪甲苷在体内的作用效果及机制;其次,本研究仅证明了黄芪甲苷对肺炎链球菌感染造成的肺泡上皮细胞损伤的保护作用,并未探究黄芪甲苷对肺炎链球菌的具体作用。因此,在后续实验中需要进一步研究黄芪甲苷对肺炎链球菌的作用,并深入探讨黄芪甲苷在体内对肺炎链球菌感染引起的肺泡上皮细胞损伤的具体作用。

