NPM1突变对IDH2突变急性髓系白血病患者的预后分析
胡晓青 李骏
(蚌埠医学院第一附属医院血液科,安徽 蚌埠 233004)
急性髓系白血病(Acute myeloid leukemia, AML)是一类以幼稚骨髓干细胞于骨髓克隆扩增为特点且具有较高异质性的恶性疾病。据报道[1],全球范围内AML发病以中老年人最为常见,发病率与年龄成正相关,生存率与年龄成负相关。AML作为一种人群高发病率的血液系统疾病,早期发病症状无特异性,后期随着骨髓中幼稚细胞等恶性增殖,骨髓的正常造血功能受到了抑制,外周血中成熟血细胞显著减少,出现皮肤黏膜苍白、乏力、出血、发热等症状。随着AML的深入研究,有研究[2]表明AML的发生与基因突变密切相关。异柠檬酸脱氢酶2(Isocitrate dehydrogenase 2, IDH2)突变是引发AML的重要因素之一,其机制与2-羟基戊二酸在体内堆积进而促使DNA和组蛋白甲基化有关。核仁磷酸蛋白1( Nucleophosmin 1, NPM1)突变在AML中也较为常见,其通过影响P53和可变阅读框(Alternative reading frame, ARF)导致AML的发生[3]。目前,国内外虽有不少关于AML伴随IDH2突变的生存预后研究,但其预后意义仍不明确,而NPM1突变被认为与预后良好相关。本研究探讨NPM1突变对IDH2突变AML患者的预后影响,以期为后续的临床治疗提供参考依据。
1 资料与方法
1.1 一般资料 纳入蚌埠医学院第一附属医院血液内科2018年01月—2020年06月收治的AML患者105例。根据IDH2突变与否将AML患者分为IDH2突变阳性组(28例)和IDH2突变阴性组(77例)。纳入标准:①所有患者均经MICM即细胞形态不、免疫学、细胞遗传学、分子生物学特征确诊。②诊断标准参照《血液病诊断及疗效标准》第4版。排除标准:①未分型的急性髓系白血病。②急性早幼粒白血病。③急性混合细胞性白血病。④急性继发性髓系白血病。⑤存在精神类疾病。⑥合并其他严重或恶性疾病。⑦未进行与急性髓系白血病相关性的检查及随访的患者。本研究患者及其家属均签署知情同意书,研究方法遵从《赫尔辛基宣言》2013年版中的相关规定条例。
1.2 方法
1.2.1 仪器与试剂 ABI7500荧光定量PCR仪(美国ABI公司);Oligo7引物分析软件(美国Molecular Biology Insights公司);taq酶(日本Takala公司);pGM-T载体(北京天根生化科技有限公司)。
1.2.2 标本采集及处理 患者入院后第2 d采集5 ml清晨空腹静脉血和肝素抗凝骨髓液5 ml,检测分析其白细胞计数、中性粒细胞计数、红细胞计数、血红蛋白含量、血小板计数及骨髓原始细胞计数等。NPM1和IDH2基因检测是运用PCR扩增技术捕获目的片段,利用核酸外切酶和碱性磷酸酶分别与PCR反应后的引物和dNTP相互反应,降解其底物并获取纯化PCR产物,以纯化PCR产物模板,进行双脱氧末端测序。
1.3 首次诱导化疗方案与疗效评价 主要采用蒽环类药物+阿糖胞苷为首次诱导化疗方案。具体治疗天数和剂量如下:①第1~3 d注射去甲柔红霉素8~12 mg/m2或柔红霉素60~90 mg/m2。②第1~7 d注射阿糖胞苷100~200 mg/m2。老年患者采用地西他滨+HAG为其化疗方案。根据血象和骨髓象复查结果评估首次诱导化疗疗效,记录完全缓解(Complete remission, CR)例数,标准参照《血液病诊断及疗效标准》第4版。
1.4 随访方法 对所有纳入患者进行电话随访,时间截止至2022年06月。生存状态分为存活或死亡。统计患者的总体生存时间(Overall surivival, OS),即从确诊至随访截止、死亡或失访的时间,以月份为计量单位。
1.5 统计学分析 使用SPSS 25.0软件对数据做统计学处理,计数资料以百分比(%)表示,组间比较采取χ2检验。不符合正态分布的计量资料以中位数(百分位数间距)[M(P25,P75)]表示,组间比较采用两独立样本的非参数检验。应用Kaplan-Meier曲线进行生存分析,组间比较采用log-rank检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组AML患者临床特征比较 IDH2突变阳性组患者性别、年龄、NPM1突变率、FAB分型(M1、M2、M4、M5)、白细胞计数、血小板计数、血红蛋白含量、骨髓原始细胞比例与IDH2突变阴性组比较,差异均无统计学意义(P>0.05),见表1。
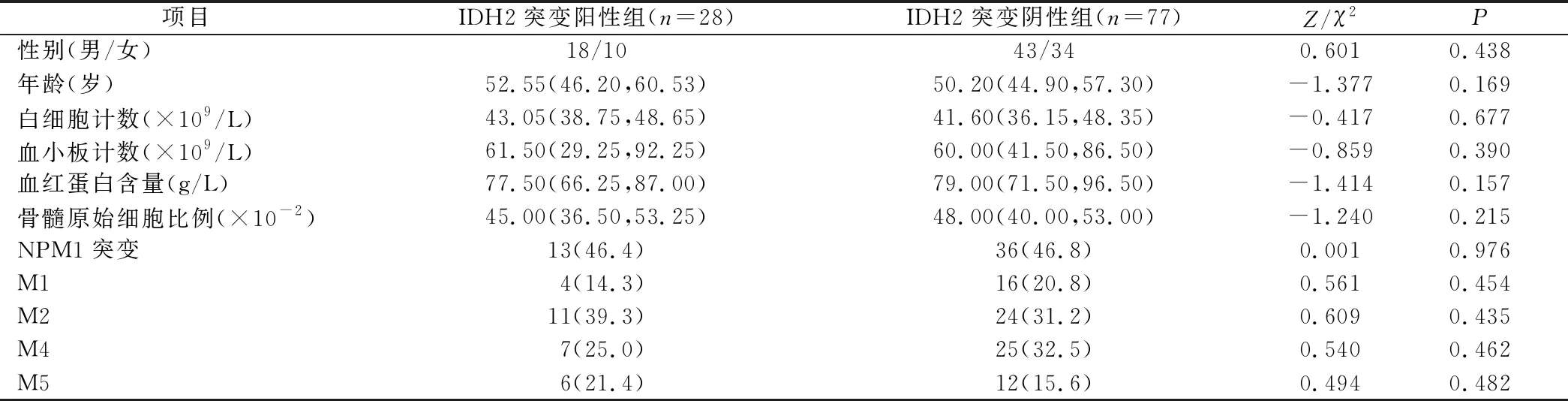
表1 临床资料比较[M(P25,P75),n(×10-3)]
2.2 两组AML患者CR率比较 IDH2突变阳性组CR率46.4%(13/28),与IDH2突变阴性组患者CR率63.6%(49/77)比较,差异无统计学意义(χ2=2.514,P=0.113)。105例患者中49例患者伴随NPM1突变,56例患者不伴随NPM1突变,伴随NPM1突变中IDH2突变阳性13例,IDH2突变阴性36例,13例IDH2突变阳性患者CR率[61.5%(8/13)]与36例IDH2突变阴性患者CR率[55.6%(20/36)]比较,差异无统计学意义(χ2=0.140,P=0.709);不伴随NPM1突变中IDH2突变阳性15例,IDH2突变阴性41例,IDH2突变阳性患者CR率[33.3%(5/15)]与IDH2突变阴性患者CR率[70.7%(29/41)]比较, 差异有统计学意义(χ2=6.440,P=0.011)。
2.3 两组AML患者2年生存率比较 IDH2突变阳性组患者2年生存率、OS中位数与IDH2突变阴性组患者比较,差异无统计学意义(P=0.110)(见表2、图1);伴随NPM1突变患者中13例IDH2突变阳性患者中2年生存率、OS中位数与36例IDH2突变阴性患者比较,差异均无统计学意义(P=0.803)(见表3、图2);不伴随NPM1突变中15例IDH2突变阳性患者2年生存率、OS中位数与41例IDH2突变阴性患者中2年生存率、OS中位数比较,差异有统计学意义(P=0.008),见表4、图3。
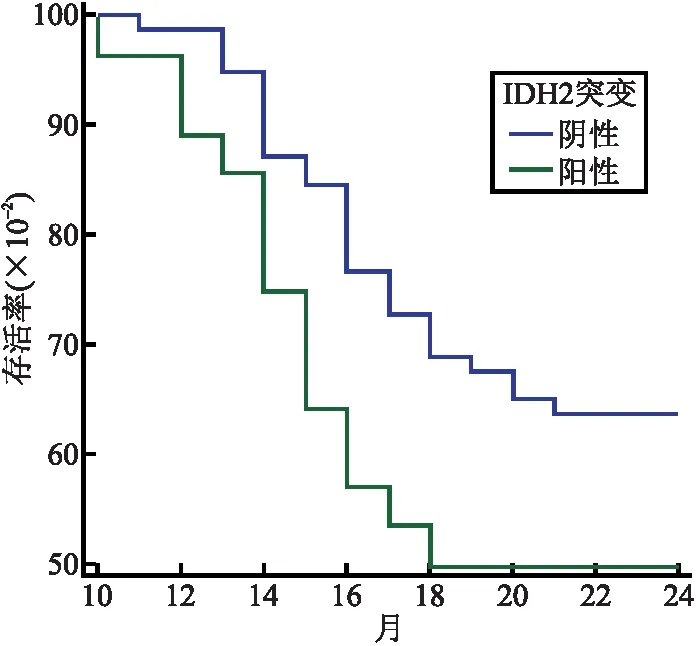
图1 两组生存曲线
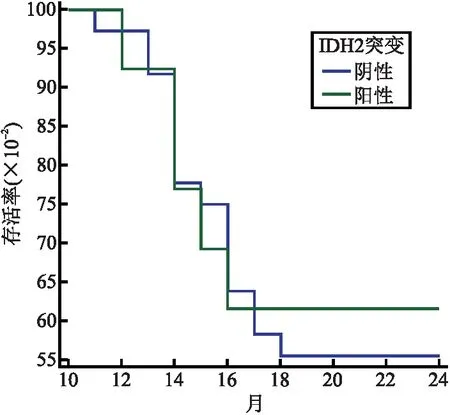
图2 两组生存曲线(伴随NPM1突变)
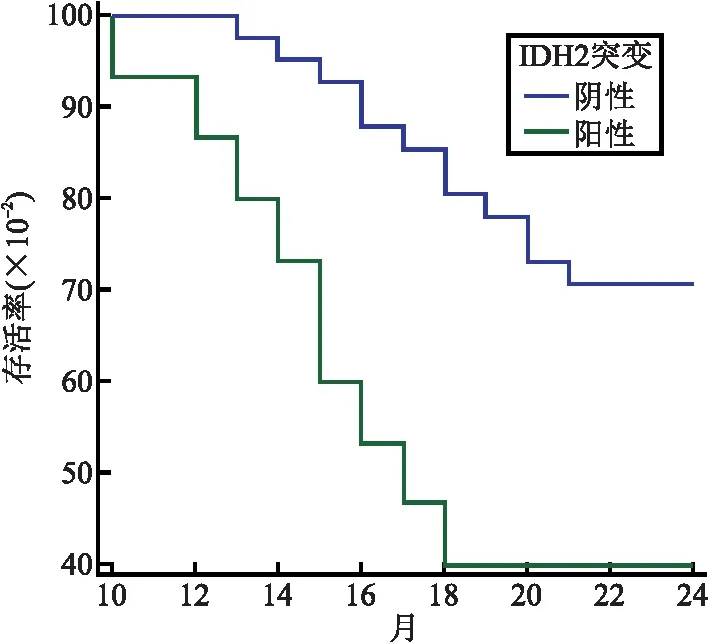
图3 两组生存曲线(不伴随NPM1突变)

表2 2年生存率比较

表3 2年生存率比较(伴随NPM1突变)
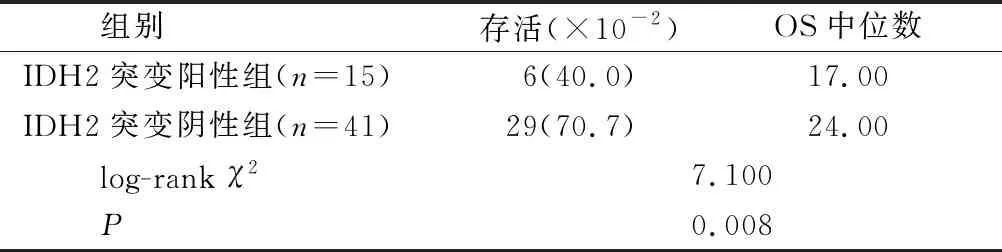
表4 2年生存率比较(不伴随NPM1突变)
3 讨论
IDH作为机体有氧氧化途径柠檬酸循环(也称三羧酸循环)中的关键酶,其中IDH2是IDH的同工酶,分别在细胞质、线粒体催化异柠檬酸氧化脱羧转变为α-酮戊二酸并产生烟酰胺腺嘌呤二核苷酸磷酸(Nicotinamide adenine dinucleotide phosphate,NADPH)。IDH2突变时,细胞可产生新的活性酶体与其余IDH2酶竞争结合底物,通过NADPH的还原作用在细胞质和线粒体中将α-KG转化为R-2-HG,负性调控α-KG依赖性双加氧酶,导致细胞内DNA和组蛋白高甲基化,促使AML的发生[4-6]。
有国外文献[7-10]指出NPM1和IDH2突变在AML中的发生率为27%~33%和8%~19%,与本研究有一定差异。由于本次研究纳入患者中存在病例资料不完整,因此未将该部分患者纳入分析,导致NPM1和IDH2突变发生率增加。IDH2突变阳性患者与IDH2突变阴性患者在性别、年龄、NPM1突变率、FAB分型(M1、M2、M4、M5)、白细胞计数、血小板计数、血红蛋白含量、骨髓原始细胞比例上差异无统计学意义。据报道[11],伴随IDH2突变的AML患者的年龄、血小板计数、NPM1突变率显著高于不伴随IDH2突变患者。这与本研究结果不相符,可能是研究纳入样本量的差异导致。有报道[12]指出,IDH2突变多见于M1、M2、M5分型的AML。该结果与本研究大致相符。
关于首次诱导化疗CR率,本研究发现IDH2突变阳性患者与IDH2突变阴性患者在CR率上无显著差异。在此基础上挖掘NPM1突变因素的影响发现,在不伴随NPM1突变的背景下,IDH2突变阳性患者的CR率显著低于IDH2突变阴性患者。而在伴随NPM1突变的背景下,IDH2突变阳性患者的CR率与IDH2突变阴性患者相比无显著差异。表明NPM1突变对IDH2突变患者的化疗疗效有着积极影响。本研究2年生存率发现IDH2突变阳性患者与IDH2突变阴性患者无显著差异。进一步分析显示,在不伴随NPM1突变的背景下,IDH2突变阳性患者的2年生存率显著低于IDH2突变阴性患者。而在伴随NPM1突变的背景下,两者的2年生存率无显著差异。结合上述CR率分析,推测NPM1突变可中和IDH2突变时的不利影响,能够在一定程度上提高IDH2突变患者对化疗的有效性,对提高存活率和延长存活时间有着重要意义。有相关研究[13-14]表明,在伴有NPM1突变的AML细胞中,NPM1由细胞核内转至细胞质中与NF-kB蛋白产生作用,致使NF-kB蛋白裂解,一定程度削弱其结合DNA的能力,进而改善AML患者的预后,因此研究认为NPM1突变是预示AML患者预后良好的指标。有研究[15]选取195例AML患者进行生存预后分析,结果显示患者IDH2突变患者CR率显著低于无IDH2突变患者。另外,在2年生存率比较上,IDH2突变患者与无IDH2突变患者无显著差异,但在没有合并NPM1突变的情况下,IDH2突变患者的2年生存率显著低于无IDH2突变患者,而在合并NPM1突变的情况下无显著差异。虽然上述结果与本研究结果稍有不同,但值得一提的是,两研究均提及到,不伴随NPM1突变的IDH2突变AML患者的2年生存率较无NPM1和IDH2突变患者差。NPM1作为一种多功能穿梭蛋白,不仅在DNA复制、转录、修复及核糖体蛋白组装等方面发挥着重要作用,并且能够通过P53和ARF调控细胞发育增殖的周期进程的功能[16]。现阶段,NPM1突变是AML发病最为常见的驱动因素[17]。有研究[18]指出,伴随NPM1突变的AML患者一般多同时伴有其它基因突变,如IDH2、FLT3-ITD等。既往有研究[19]指出NPM1突变与预后相关。根据NCCN指南指出,伴有NPM1突变的AML患者若不同时伴有FLT3-ITD突变则提示预后良好。据报道[20],在伴有NPM1突变的情况下,异常染色体核型的AML患者其长期生存率显著低于正常染色体核型的AML患者。总结上述研究结论,排除FLT3-ITD突变和异常染色体核型等因素NPM1突变预后良好。由此推测,NPM1突变在特定的条件下能够改善IDH2突变AML患者的预后,但由于本研究未将上述因素纳入分析,因此还需要更为细化的研究证实NPM1在IDH2突变AML患者中的价值。
有研究[21-22]表明IDH2140Q亚型突变预后良好,而IDH172K亚型突变预后较差;也有研究[15]表明IDH2突变与预后无相关性;因此,IDH2突变的预后意义暂无统一结论。本研究为揭示IDH2突变与预后的关系增加佐证,有利于日后临床工作中对高危AML患者的识别和指导个体化治疗。近年,随着人们对IDH2的深入研究,相应的IDH2突变抑制剂已研发成功。Enasidenib作为IDH2突变抑制剂的代表性药物,已在国外投入使用并取得了一定的成果。有报道[23-24]指出,由于Enasidenib具备较好的耐受性且较少与其他药物发生反应,因而推测联合其他药物的疗效可能优于单一药物应用。总之,IDH2突变抑制剂的出现是为IDH2突变的AML患者带来福音。
4 结论
本研究结果发现,在AML不伴随NPM1突变的背景下,IDH2突变阳性患者的化疗疗效和2年生存率差于IDH2突变阴性患者。

