HOX13与糖尿病足患者临床特征的相关性及对细胞增殖、凋亡及炎症的影响*
刘宇彪 周花玩 鞠上
(1.中国中医科学院广安门医院南区外科,北京 102600; 2.天承金象中医诊所,北京 100045; 3.北京中医药大学东直门医院周围血管科,北京 100061)
1 资料与方法
1.1 一般资料 选取2018年1月—2021年1月中国中医科学院广安门医院南区接诊的糖尿病足患者60例作为糖尿病足组,选择同期因外伤在我院行清创手术的2型糖尿病非病足组患者19例作为糖尿病非病足组,并选取同期因外伤在我院接受清创手术的无糖尿病病史且无创面感染的患者60例作为对照组。纳入标准:①相关诊断符合《中国老年2型糖尿病诊断措施专家共识(2018)版》[12]。②糖尿病足患者除满足①外,糖尿病足分级:Wagner分级≥1。③临床资料完整。④诊断为糖尿病足均为初次且未进行任何治疗。⑤近期未使用利尿剂、抗凝剂。排除标准:①合并恶性肿瘤、严重创伤及肝肾功能严重异常。②机体处于感染的应急状态。③不具有完整的临床资料。④痛风史、激素类药物服用史。⑤合并免疫系统疾病。本研究经医院伦理委员会批准通过,所有研究对象均签署知情同意。
1.2 方法
1.2.1 临床资料收集 通过回顾性分析查阅患者基线资料,主要包括:年龄、性别、糖尿病病程、血压、血糖、血生化指标、白细胞计数、血脂、Wanger分级及住院时间等。计算质量体质量指数(BMI)及腰臀比(Waist-to-Hip Ratio, WHR)。使用全自动生化仪对纤维蛋白原(FG)、三酰甘油(TG)、总胆固醇(TC)、低密度脂蛋白(LDL-C)、高密度脂蛋白(HDL-C)、血肌酐(SCr)、血尿酸(UA)等实验室指标进行检测。检测糖化血红蛋白(HbA1c)通过使用高效液相色谱法。ELISA法检测血清中1L-6、1L-4、TNF-β、hs-CRP水平。
1.2.2 创面标本采集 研究对象治疗常规换药处理过程中,创面覆盖凡士林纱布,每日更换,不使用含外源性细胞因子和药物或敷料,于换药时用组织剪留取创面中央部位肉芽组织。清洗后,冷冻20~30 min于液氮中,-70 ℃冰箱保存备用。
1.2.3 创面组织中HOX13蛋白表达检测 将研究所取组织标本放入遇冷的研钵中,将其粉碎至粉末。加适量裂解液30 min后,进行冰上裂解反应,后在4 ℃条件下,离心5 min取上清(4 ℃,12000 r/min)。根据BCA试剂盒(Promega生物技术有限公司,美国)说明检测蛋白浓度。100 ℃条件下蛋白样品变性3~5 min,上样缓冲液与变性蛋白80 μg进行充分混匀,后恒压电泳。在行浓缩胶(90 V电压),分离胶(120 V电压),停止电泳在电泳至距离分离胶下端约1 cm处。后取出凝胶,进行转膜处理,完成后封闭2 h(5%脱脂奶粉),后依次加入1∶1000稀释后的一抗HOX13单克隆抗体(美国Abcam公司)、1∶1000稀释的辣根过氧化物酶标记的羊抗鼠IgG(美国Abcam公司)反应,显色液滴加,转移至暗室,曝光处理,加入内参甘油醛-3-磷酸脱氢酶(Glyceraldehyde-3-phosphate dehydrogenase,GAPDH),分析蛋白水平。
1.2.4 Western blot检测蛋白表达 各组细胞培养48 h后,提取蛋白,再检测HOX13、TNF-β、hs-CRP、1L-6、1L-4的表达,参照1.2.3中步骤。
1.2.5 HOX13免疫组化染色 固定样本组织通过使用4%多聚甲醛,后制成石蜡切片(5 μm)。使用3%过氧化氢溶液去除脱水后的石蜡切片中的内源性过氧化物酶,封闭组织切片30 min通过3%的胎牛血清白蛋白(美国Hyclone公司)。兔抗人HOX13单克隆抗体(Sigma公司,美国)滴加处理,在4 ℃条件下对其进行孵育过夜处理;二抗滴加。在室温条件下进行孵育(1 h)。对其进行冲洗处理使用PBS,SABC孵育。对其进行显色处理使用DAB,苏木素复染。有经验病理师按照盲法对检测结果进行独立判断。判读标准:阳性细胞为细胞浆呈棕色着色,阴性细胞为无棕色着色。
总之,对有攻击性行为的幼儿,应更多地强调爱和平静、温和的教育,注意在平时培养他们的爱心和善良的品格,铲除孩子产生攻击性行为的土壤,让幼儿从小学会爱自己、爱别人,尊重自己、尊重别人。
1.2.6 细胞模型构建与分组 HOX13基因质粒构建:采用GenBank查找序列获得HOX13过表达以及敲除靶点,通过Peimer-BLAST工具在靶点上设计引物序列,获得基因过表达与敲除质粒,以上操作由上海吉玛公司完成。①细胞分离培养与分组:无菌条件下于超净工作台上取标本组织,去髓核、表皮及结缔组织后将组织切成2~3 mm后置于培养皿中,PBS清洗2次后密度以1~2块组织/cm2排列整齐,表面滴加1~2滴胎牛血清于每颗组织表面,置于5%CO2、37 ℃培养箱中进行6~8 h培养后组织块贴壁,后培养箱中加入适量DMEM(包含10%体积分数胎牛血清),培养过夜,于第2 d观察培养基无污染后换液,后换液每2~3 d一次,观察有成纤维细胞组织迁移出于1周后,可传代待贴壁生长达80%以上时。而后通过Lipo2000转染试剂转染2 μgHOX13基因过表达、敲除质粒,换液在24 h后,在质粒完成转染48 h后通过1 μg/ml嘌呤霉素进行筛选,筛选时长为72 h,后继续培养细胞,通过流式细胞仪对细胞进行分选至96孔板上,最终分组为敲除组(转染敲除HOX13质粒)、过表达组(转染过表达HOX13质粒)、空白组(未做任何处理)。② HOX13转染效率鉴定:采用实时荧光定量PCR法鉴定HOX13 基因转染效率,取3组细胞提取细胞总RNA,测定RNA纯度和含量,通过逆转录试剂盒进行逆转录获得cDNA,通过RT-PCR法鉴定HOX13基因转染效率,通过2-△△CC法计算。
1.2.7 CCK-8检测细胞增殖 在96孔板中共设8个孔/组,密度为3×103个/孔均匀铺满。在细胞培养箱(5% CO2、37 ℃)进行72 h的培养至出现细胞形态正常且细胞贴壁。吸去其内旧液,使用PBS缓冲液进行2次冲洗,加入含HOX13蛋白2 μg/ml培养基。孵育72 h后,吸出培养液使用排枪,加入CCK-8溶液按10%浓度配置,每孔加入100 μL混合液,37 ℃条件下孵育30 min。调节分光光度计,检测吸光度(Optical density,OD)于450 nm波长处。
1.2.8 EDU实验检测细胞增殖数目 1×104/孔细胞培养在96孔细胞培养板,按照实验分组添加10 μmol/L5-乙炔基2′-脱氧尿苷(5-ethynyl-2′-deoxyuridine,EdU)试剂; 37 ℃、5%CO2培养6 h后,4%多聚甲醛溶液固定45 min,按照EdU试剂盒说明书进行后续实验; 并用5 mg/LDAPI染细胞核20 min,TCSSP2激光扫描共焦显微镜观察。Image-Pro Plus 6.0.1图像软件分析细胞增殖数目。
1.2.9 流式细胞术检测细胞凋亡 同前的细胞处理,对目的培养基进行更换根据实验分组,进行72 h的培养,消化处理后洗涤使用PBS,Annexin VFITC 联合PI双染法检测细胞凋亡。
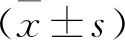
2 结果
2.1 3组患者一般资料比较 糖尿病足组年龄46~71岁;糖尿病非病足组年龄38~67岁;对照组年龄35~63岁。3组患者年龄、踝肱指数、病程、Hb、WBC、FG、HbA1c、白蛋白(ALB)、TNF-β、hs-CRP、1L-6、1L-4比较差异有统计学意义(均P<0.05)。其中糖尿病非病足组年龄、病程、WBL、FG、HbA1c、TNF-β、hs-CRP、1L-6、1L-4显著低于糖尿病足组(均P<0.05),对照组年龄、病程、WBC、FG、HbA1c、TNF-β、hs-CRP、1L-6、1L-4显著低于糖尿病非病足组(P<0.05)。踝肱指数、Hb、白蛋白在糖尿病病足组、糖尿病非病足组、对照组依次显著偏高(P<0.05)。见表1。
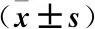
表1 3组患者一般资料比较
2.2 HOX13与临床特征相关性分析 相关性分析结果表明,HOX13表达与年龄、病程、Hb、FG、HbA1c、、TNF-β、hs-CRP、1L-6、1L-4呈负相关(P<0.05);与踝肱指数、ALB呈正相关(P<0.05)。见表2。
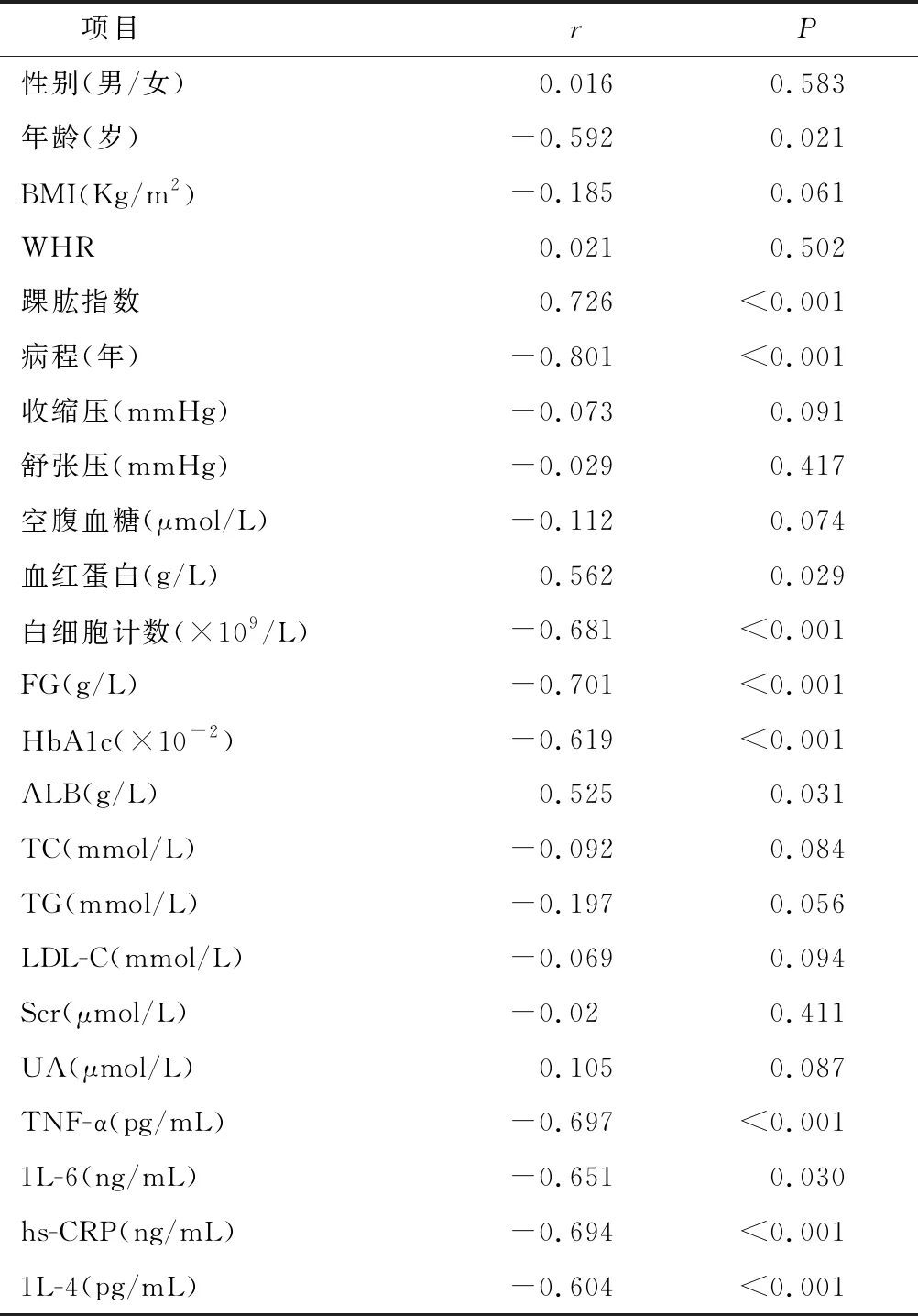
表2 临床特征与HOX13的相关性分析
2.3 免疫组化检测HOX13在糖尿病足组、糖尿病非病足组、对照组组织中表达 HOX13呈棕色颗粒表达于细胞核,相较于糖尿病非病足组与对照组,HOX13在糖尿病足组中的颜色深度明显变浅,染色面积明显下降,可见HOX13的表达量明显影响糖尿病患者足的破损情况,差异有统计学意义(P<0.05),见图1。

图1 免疫组化检测HOX13在不同组别中表达(200×)
2.4 组织中HOX13蛋白表达 收集3组新鲜组织,提取总蛋白后,通过western blot检测HOX13蛋白的表达水平,与对照组相比,糖尿病非病足组与糖尿病足组的HOX13蛋白表达水平明显降低,其中表达更低的为糖尿病足组(P<0.05),见图2。
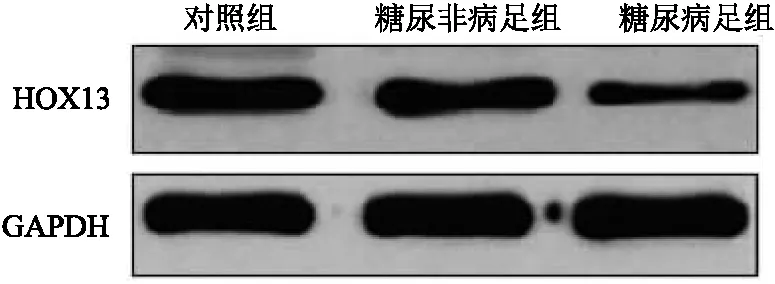
图2 Western blot检测各组HOX13蛋白表达
2.5 体外细胞模型
2.5.1HOX13基因转染效率鉴定 过表达组、敲除组、空白组HOX13基因mRNA表达量分别为(2.36±0.80)、(0.44±0.12)、(1.65±0.51),组间比较差异均有统计学意义(F=13.207,P<0.001)。过表达组HOX13基因mRNA表达量显著偏高,敲除组HOX13基因mRNA表达量显著偏低。提示细胞模型构建成功。
2.5.2 过表达组、敲除组、空白组间细胞炎性因子比较 ELISA法检测各组炎症因子,较于空白组,过表达组TNF-β、hs-CRP、1L-6、1L-4显著偏低(P<0.05);敲除组TNF-β、hs-CRP、1L-6、1L-4显著升高(P<0.05)。western blot检测各组TNF-β、hs-CRP、1L-6、1L-4蛋白表达,与空白组比较,敲除组显著升高,过表达组显著降低(均P<0.05)。见表3、图3。
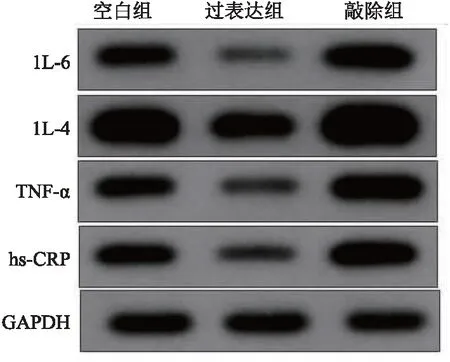
图3 Western blot检测3组间细胞内炎症因子
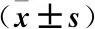
表3 3组间细胞内炎症因子比较
2.5.3 3组细胞凋亡相关蛋白表达 Western blot检测各组细胞目的蛋白表达,较于空白组,敲除组Caspase-3、Caspase-9、Bax蛋白表达显著偏高,Bcl-2蛋白表达显著偏低(均P<0.05);较于空白组,过表达组Caspase-3、Caspase-9、Bax蛋白表达显著偏低,Bcl-2蛋白表达显著偏高(均P<0.05)。见图4。
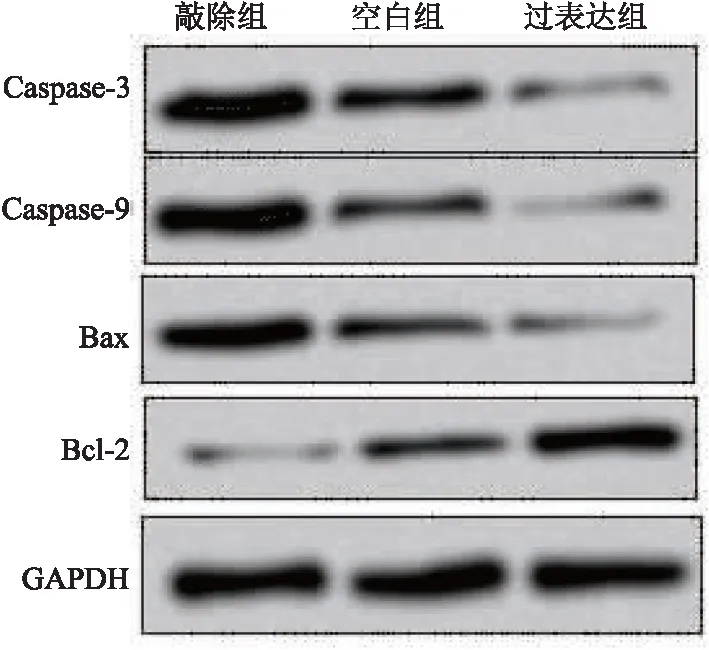
图4 Western blot检测各组细胞凋亡蛋白表达
2.5.4 3组细胞凋亡率比较 相较于空白组与过表达组,HOX13敲除组的糖尿病足组Q4象限正常细胞占比明显下降,表明HOX13低表达明显促进细胞凋亡,(F=6.791,P<0.001),见图5。
图5 各组细胞凋亡情况比较
2.6 3组间细胞增殖影响 CCK-8实验结果表明,过表达组细胞增殖状态较空白组显著增高(F=6.842,P<0.001),敲除组较空白组显著降低(F=8.537,P<0.001)。见图6。
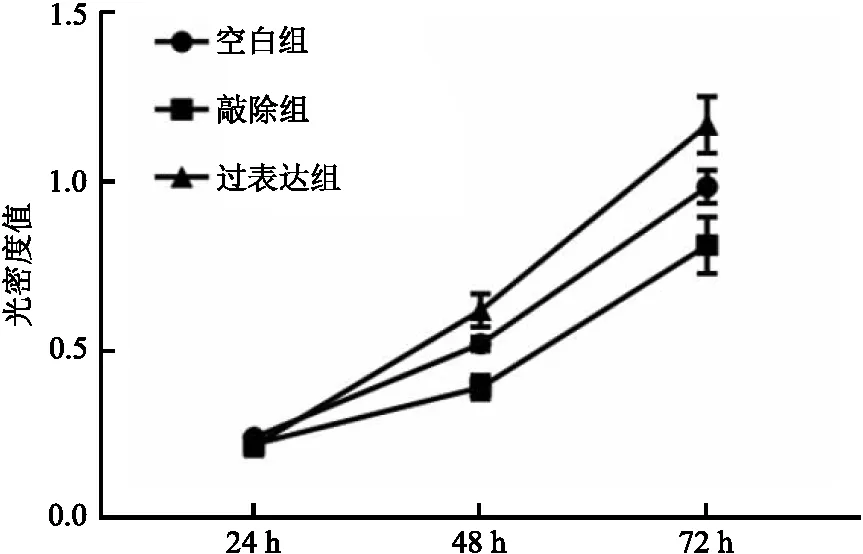
图6 CCK-8实验检测细胞增殖情况
2.7 EDU标记实验检测细胞增殖情况 与空白组比较,敲除组EDU标记的细胞数目明显降低(P<0.05);过表达组EDU标记的细胞数目明显升高(P<0.05)。由此说明HOX13低表达的糖尿病足细胞增殖能力明显降低。见图7。

图7 EDU标记实验检测细胞增殖情况(200 μm,200×)
3 讨论
糖尿病足是以足部保护性感觉丧失为特征的神经病变,常伴有外周动脉疾病的血流受限,严重者可能会感染并导致截肢[13]。糖尿病足具体调控机制尚未完全明确,已有研究表明细胞过度凋亡是其重要的病理特征。多项研究证实HOX13可参与细胞增殖及凋亡的调控[14-15],而细胞凋亡对维持细胞的正常形态与功能,维持机体稳定具有重要作用,细胞凋亡的调控机制发生紊乱可诱导产生多种疾病[16]。
糖尿病足的发生发展受多种因素共同作用[17],本研究结果表明糖尿病足组患者较其他组患者年龄偏大,病程较长。与费扬帆等[18-19]研究结果一致。另外本研究还发现WBC、FG、HbA1c水平也较其他组高,分析机制可能为就理论上血糖控制不佳,患病时间较久,机体免疫抵抗能力降低,进而导致糖尿病足等相关并发症发生率升高,而白细胞计数可以对感染情况进行评估。糖尿病足组HbA1c显著偏高,分析可能血糖长期控制水平与糖尿病足发生显著相关,外周动脉粥样硬化可由长期高血糖引起,肢体溃疡坏死风险随之增加。这与既往研究[20-21]结果类似。同时因糖尿病患者的机体长期在高血糖条件下,其具有血管内皮功能障碍加重,脂质过氧化,黏附因子水平升高,血液凝固型增高等一系列病理生理变化,下肢缺血性病变随之加快,糖尿病足发生率升高。而糖尿病足组FG显著偏高可导致血液黏度增加,随之血管内皮细胞损伤增加,病灶内血栓形成,这与李惠琴等[22]相关研究相一致。可见年龄、WBC、FG、HbA1c、病程等升高,可加大发生糖尿病足的风险。本研究还发现糖尿病足组患者踝肱指数、Hb、ALB较其他组显著偏低。分析原因可能低ALB及低HB可加重血脂紊乱及感染。提示踝肱指数、低ALB、低HB偏低可加大发生糖尿病足的风险。
有研究[23]发现成人成纤维细胞可在体内和多层体内维持胚胎HOX模式的特征,这表明它们是跟踪转录记忆机制的有价值的系统。而HOX13可实现对多项关键基因的表达调控疾病的发生发展[24]。有研究[25]发现在解剖远端部位出生后的人类皮肤中,HOXA13蛋白在表皮中不表达,而在真皮中表达。但是否与糖尿病足发生和创面的溃疡加重及愈合等相关还不清楚。本研究发现,相较于糖尿病非病足组与对照组,糖尿病足患者的HOX13表达显著降低,且HOX13表达与年龄、病程、白细胞计数等呈负相关,踝肱指数、白蛋白与HOX13呈正相关。这提示HOX13可能与DF的发生相关,其可能对DF的治疗和预后监测具有指导作用。有研究[26-27]发现随着累积血糖负荷的加重,足部溃疡的发病率也在增加,而糖基化终末产物的启动因子可能促进了炎症的发生,同时也通过细胞增殖促进了血管壁基质增生,另外还对血管内皮细胞凋亡具有重要影响。本研究发现病足患者TNF-β、hs-CRP、1L-6、1L-4显著偏高,且与HOX13呈负相关,说明HOX13可能加重了糖尿病足的发生进而促进炎症反应,且细胞实验也发现HOX13敲除时TNF-β、hs-CRP、1L-6、1L-4显著偏高,HOX13过表达时,TNF-β、hs-CRP、1L-6、1L-4显著降低。进一步提示HOX13可能可能会加重炎症反应,进而加重糖尿病足的溃疡。
在成人成纤维细胞中的特异性HOX基因的表达可作为稳态和再生期间皮肤的位置记忆源[28]。有研究[30]发现HOXA13对成纤维细胞WNT5A的调控是调控位点特异性表皮分化的机制之一,HOXA13可能决定了诱导成年人成纤维细胞WNT5A表达是否继续提供远端特异性功能,而HOXA13的表达可能与伤口难愈与细胞增殖减慢及细胞凋亡增加有关。且已有多项研究[31]表明HOX13可诱导细胞凋亡,HOX13调控细胞的增殖与凋亡通过多种通路。本研究也发现较于空白组,HOX13敲除时明显增加细胞凋亡,过表达时显著抑制凋亡,经典凋亡因子Caspase-3、Caspase-9、Bax蛋白在HOX13敲除组表达显著偏高,Bcl-2蛋白表达显著偏低,当HOX13过表达时以上凋亡因子出现显著相反的结果。提示HOX13可能控制了糖尿病足细胞的凋亡,这与以往研究结果具有一致性。本研究提示HOX13敲低的糖尿病足成纤维细胞增殖能力明显降低,这与CCK-8实验结果一致。可见HOX13在细胞的增殖和凋亡中发挥重要作用,这与其他研究[32]发现的HOX基因可诱导人脂肪肉瘤、白血病细胞等多种细胞增殖和凋亡的结果一致。但本研究样本量较少,导致结果具有一定偏奇性,另外基础研究方法较为简单,实验具有一定局限性,将在后续研究中优化这些问题,为糖尿病的研究提供更多可靠信息。
4 结论
HOX13在糖尿病足中呈低表达,HOX13高表达可促进糖尿病足成纤维细胞的增殖,抑制凋亡,并抑制炎症因子的表达。HOX13表达变化量与糖尿病足发生发展密切相关,HOX13有希望成为糖尿病足治疗和预后监测的新靶点因子,可为糖尿病足发病机制提供新思路。

