多发性骨髓瘤的CAR-T治疗研究进展*
何爱丽 付冰洁
(西安交通大学第二附属医院血液科,陕西 西安 710004)
多发性骨髓瘤(Multiple myeloma,MM)是一种浆细胞恶性增殖性肿瘤,以骨髓中单克隆浆细胞异常积聚并产生单克隆免疫球蛋白或其片段(M蛋白)为特点,并导致相关器官或组织损伤,临床表现为高钙血症、肾功能不全、贫血和骨质破坏等。多发性骨髓瘤占肿瘤疾病的1%,从1990—2016年,全球多发性骨髓瘤的发病率增加了126%[1]。尽管蛋白酶体抑制剂、免疫调节剂、单克隆抗体等药物的应用显著改善了MM患者的生存及质量,但疾病的复发和耐药性的出现使得MM目前仍无法治愈[2]。
随着基因工程的发展,嵌合抗原受体T(Chimeric antigen receptor T, CAR-T)细胞成为当今最为前沿的治疗肿瘤的方法。CAR-T疗法的出现,改变了非霍奇金淋巴瘤、B淋巴细胞白血病及多发性骨髓瘤的治疗格局[3],为多发性骨髓瘤治疗带来突破性进展。然而CAR-T在实际应用过程中存在一系列不良反应及复发问题[4-5]。为了提高CAR-T的抗肿瘤能力和敏感性,研究者们开始着眼于多靶点CAR-T尤其是双靶点CAR-T的开发。本文对现阶段CAR-T治疗多发性骨髓瘤的研究进展做一述评,旨在为临床提供一定的参考。
1 CAR-T治疗原理
CAR-T细胞疗法是将采集的患者外周血中的T细胞分离出来,通过基因转导技术使分离出的T细胞得以表达CAR,再将这些细胞回输到患者体内进行抗肿瘤治疗[6]。CAR是合成受体,由肿瘤相关抗原结合域(单链可变片段,ScFv)、细胞外铰链域、跨膜区域和细胞内信号转导域四部分组成[7]。CAR共有四代,第一代CAR只包含一个细胞内信号域,第二代增加了共刺激结构域CD28或4-1BB等来增强CAR-T的抗肿瘤效应[8],第三代将共刺激结构域增加为2个以促进CAR-T的增殖和活化,第四代在第三代的基础上增加细胞因子以增强CAR-T对肿瘤的杀伤力。CAR-T输注入患者体内后,可以特异性识别并通过细胞溶解、释放细胞因子和Fas/FasL三种途径杀死表达特异性抗原的肿瘤细胞,且不受主要组织相容性复合体(Major histocompatibility complex, MHC)的限制[7-9]。
2 MM CAR-T治疗靶点
理想情况下,CAR-T的治疗靶点是在MM肿瘤细胞上特异性均匀表达但在正常细胞中不存在的表面抗原[10]。目前,B细胞成熟抗原(B cell maturation antigen, BCMA)、信号淋巴细胞激活分子家族成员F7(Signaling lymphocyte activation molecule family member F7,SLAMF7)、G蛋白偶联受体C类第5组成员D (G protein-coupled receptor class C group 5 member D, GPRC5D)、CD38、CD19等已被用作MM CAR-T治疗的靶点(见图1),其中BCMA-CAR-T产品bb2121已于2021年3月被批准上市,2022年2月另一项产品cilta-cel也被批准上市,其他几种抗原的研究也在进行中。
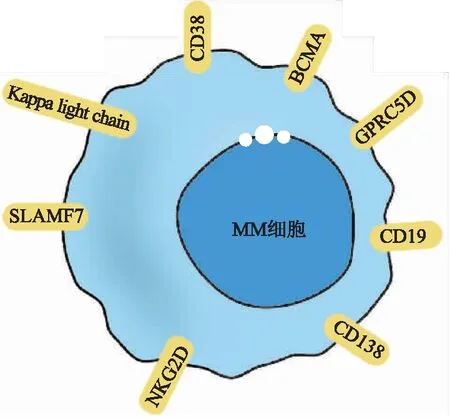
图1 MM治疗靶点
2.1 BCMA BCMA是肿瘤坏死因子受体(Tumor necrosis factor receptor, TNFR)家族的成员,在B细胞成熟末期表达上调,尤其是在浆细胞上选择性表达,且在大多数多发性骨髓瘤细胞上高水平表达,但在幼稚B细胞、记忆B细胞及其他正常组织细胞上基本不表达。BCMA通过与B细胞活化因子(B cell ac-tivating factor, BAF)结合,激活NF-κB和MAPK/JNK通路调节长寿浆细胞的存活,也可以通过结合增殖诱导配体(A proliferation-inducing ligand,APRIL)促进骨髓微环境中MM细胞的增殖[6]。
bb2121是一种由含有BCMA CAR的慢病毒载体转导的CAR-T产品, Raje等[11]报告了一项bb2121治疗复发/难治性多发性骨髓瘤(Relapsed and refractory multiple myeloma,RRMM)的研究。患者在接受氟达拉滨和环磷酰胺处理后输注bb2121,输注的剂量为50×106、150×106、450×106、800×106,在剂量扩展阶段输注的bb2121剂量为150×106~450×106。36例复发难治MM患者纳入研究,3例患者因疾病进展退出研究,其余33例患者的总体缓解率(Overall response rate,ORR)为85%,完全缓解(Complete response,CR)率为9%,严格完全缓解(Stringent complete response,sCR)率为36%。bb2121输注后的中位随访时间为11.3个月,中位无进展生存期(Median progression-free survival,mPFS)为11.8个月(95%CI, 6.2~17.8个月),且40%的患者在12个月时无进展。强生公司生产的cilta-cel是另一种靶向BCMA的CAR-T产品,与其他BCMA-CAR-T疗法不同的是,它直接针对两个BCMA表位(VH1和VH2),提高了对表达BCMA的细胞的亲和力[12-13]。Lin等[14]研究结果提示,97例患者在淋巴清除5~7 d后接受0.75×106/kg cilta-cel单次输注,ORR为97.9%(95%CI:92.7%~99.7%),其中94.9%的患者达到了VGPR,82.5%的患者达到了sCR。在61例骨髓微小残留病(Minimal residual disease, MRD)可评估的患者中,92%的患者MRD呈阴性,其中44%的患者(27/61)MRD阴性持续≥6个月,其2年PFS率为91%;18%的患者MRD阴性持续≥12个月,其2年PFS率为100%。以上研究可以看出,靶向BCMA的CAR-T疗法在MM治疗中取得了令人满意的临床疗效,RRMM患者也可在BCMA CAR-T治疗中显著获益。研究者仍在不断改进BCMA CAR-T疗法。为进一步提高其安全性,2021年的一项研究[15]成功构建了表达全人源化BCMA特异性的ScFv(25C2)的自体CAR-BCMA-T细胞(CT053),结果说明CT053成功降低了非人类来源成分的免疫原性,提高了CAR-T疗法的安全性。在提高BCMA CAR-T疗效方面,Janine等[16]使用了一种从D域噬菌体中发现的一种新型BCMA结合域,与4-1BB共刺激结构域和CD3ζT细胞激活域结合构建出了ddBCMA CAR-T,相较于传统的ScFv BCMA结合域,ddBCMA可以促进更高水平的细胞表面CAR表达,且不会引起任何功能的丧失。Frigault团队[17]进行了剂量递增的CART-ddBCMA首次I期人体试验,截至2022年1月25日,25例患者(19 DL1;6 DL2)可评估安全性,24例(18 DL1;6 DL2)可进行疗效分析,ORR为100%,67%的患者达sCR或CR,88%的患者达到非常好的部分缓解(Very good partial response,VGPR),为其临床有效性提供了数据支持。Pont等[18]则发现将MM患者肿瘤样本暴露于多亚基γ-分泌酶抑制剂可以减少BCMA从MM细胞脱落,增加BCMA表面表达,并增强CAR-T细胞在体外和体内对MM的识别,提高靶向BCMA的CAR-T细胞疗法的抗肿瘤功效,为临床增加疗效提供可能。在2019年美国血液学会年会上,Cowan[19]报告了一项γ分泌酶抑制剂和BCMA CAR-T联合应用于MM患者的I期临床试验提示,患者接受3次口服γ分泌酶抑制剂治疗后,骨髓瘤细胞表面BCMA表达从75%增加到99%,可溶性BCMA水平下降了2倍。与BCMA CAR-T细胞联合治疗,ORR为100%(1 VGPR,1 PR),5例达到MRD阴性。中位随访5个月(1~11个月),没有患者复发。这项研究启示我们,除了专注于CAR-T本身,也可以将CAR-T疗法与其他治疗手段联合应用也可增强其临床疗效。
2.2 SLAMF7 SLAMF7又称CD319、CRACC、CS-1,是信号淋巴细胞激活分子(Signaling lymphocyte activation molecule,SLAM)家族的成员,参与免疫细胞功能的调节。SLAMF7在正常组织内的表达仅局限于造血系统,包括自然杀伤(Natural killer,NK)细胞、部分T细胞和B细胞、单核细胞、巨噬细胞和树突状细胞。在正常B细胞的生命周期中,SLAMF7在前B细胞和浆细胞中高表达,且在多发性骨髓瘤及意义未明的单克隆丙种球蛋白病和冒烟型骨髓瘤阶段的恶性浆细胞中都高水平表达[20]。
O’Neal等[21]设计了靶向SLAMF7远端可变结构域的Luc90-CS1-CAR-T细胞,实验证实CS1-CAR-T在体外可以杀死表达CS1的MM细胞;在构建的MM小鼠模型体内,与对照组相比,接受Luc90-CS1-CAR-T治疗的小鼠肿瘤负荷显著减轻,生存时间明显延长,中位生存期达到了50 d。Gogishvili等[20]将SLAMF7-CAR-T与骨髓瘤细胞系共培养时发现,SLAMF7-CAR-T细胞可以分泌更多的的IFN-γ和IL-2,显示出强大的细胞毒性;在MM异种移植小鼠模型中,通过生物发光技术观察到,相较于未治疗或给予CD19-CAR-T治疗的小鼠,接受SLAMF7 CAR-T细胞治疗的小鼠的体内代表骨髓瘤负荷的生物发光信号均减少,且在8周观察期结束时,该组小鼠全部存活。在这些临床前实验取得可喜成就的基础上,SLAMF7 CAR-T疗法的临床研究稳步推进。德国研究人员在CARAMBA项目中将无病毒睡美人(Sleeping Beauty,SB)基因转移技术应用于制备SLAMF7特异性CAR-T。CARAMBA细胞的制造总共需要14 d。从患者体内分离出≥5×109个白细胞后,将其分为两部分,使得这两部分包含大约相同数量的CD4+T细胞和CD8+T细胞。T细胞经富集并活化后,通过电穿孔将编码SB100X转座酶的mRNA和编码SLAMF7 CAR的微型环载体转导到这些活化的T细胞中,然后将产生的SLAMF7 CAR-T细胞在体内进行扩增。CARAMBA临床试验包括I期剂量递增部分和IIa期剂量扩大部分,计划将招募38例MM患者[22],目前该项目正在稳步推进中,期待CARAMBA临床试验结果。
2.3 GPRC5D GPRC5D是一种跨膜受体蛋白,主要在浆细胞表面表达,且在MM细胞中表达水平显著高于正常细胞,也被认为是MM CAR-T治疗的一个潜在靶点[23]。免疫组化显示GPRC5D在恶性骨髓瘤细胞上普遍表达,分布类似但独立于BCMA,且在正常组织表达仅限于毛囊。基于此,研究者设计了一种包含七种靶向GPRC5D 的人类ScFvs的CAR-T,可以根除异种移植MM小鼠模型中的MM细胞,并且使小鼠实现了长期存活,在注射GPRC5D-CAR-T 100天时保持100%的存活率,且没有引起脱发或皮肤损伤症状[24],这为GPRC5D成为MM免疫治疗的重要临床靶点提供了重要临床前证据。
浙江大学医学院附属第一医院进行了一项输注自体靶向GPRC5D CAR-T细胞(OriCAR-017)的临床Ⅰ期研究。自2021年6月9日—2022年1月31日,9例患者完成输注,8例患者可用于疗效和安全性评估,其中4例接受过BCMA CAR-T治疗的患者3例可评估疗效。中位随访时间为109.5 d(32~195 d),ORR为100%,其中3例CR/sCR,2例VGPR,3例PR,并通过qPCR检测到8例患者外周血中OriCAR-017稳健扩增,中位峰值扩增时间为第10 d(第7~14 d)[25]。这项I期研究结果说明,OriCAR-017疗法应用在RRMM患者中安全且疗效显著,且接受BCMA CAR-T治疗后复发的患者仍可从OriCAR-017的治疗中获益,是一项非常有前景的疗法。
2.4 CD38 CD38是一种跨膜糖蛋白,在B细胞、浆细胞、T细胞、NK细胞和骨髓祖细胞上表达,但表达水平远低于MM细胞[26]。Daratumumab等[27]抗CD38单克隆抗体已被FDA批准用于治疗新诊断的MM和RRMM,在一定程度上推动了CD38 CAR-T疗法的发展。Li等[26]通过逆转录病毒载体转导成功构建了两种人类ScFv衍生的靶向 CD38的新型二代CAR-T细胞。CD38 CAR-T细胞在体外经CD38阳性肿瘤细胞刺激后可有效活化,并分泌大量IFN-γ、TNF-α、IL-2等细胞因子促进肿瘤细胞凋亡;在体内可以快速激活分泌IFN-γ并消除肿瘤。Drent等[28]使用了三种不同CD38抗体的可变重链和轻链序列构建出与Daratumumab亲和力相当的包含4-1BB (CD137)和CD3ζ激活结构域的CD38 CAR-T,该CAR-T具有高度增殖能力,可产生炎症性Th1样细胞因子,并以CD38依赖性方式有效杀死恶性细胞,更重要的是,CD38 CAR-T细胞似乎能够消除对各种化学疗法产生耐药性的患者的原代CD38阳性MM细胞;同时,该团队通过将诱导型caspase-9(iCasp9)自杀基因导入CD38-CAR-T有效控制了治疗时对CD38+的T细胞、B细胞及NK细胞的毒性作用。这些临床前实验说明CD38 CAR-T疗法具有非常好的临床潜力,期待CD38 CAR-T疗法临床试验的开展。
2.5 CD19 CD19是一种存在于大多数B细胞恶性肿瘤中的表面分子,且其表达相对较高[29]。近年来,靶向CD19的CAR-T在治疗B细胞急性淋巴细胞白血病、弥漫性大B细胞淋巴瘤等方面展示出良好疗效[30]。相比之下,CD19在多发性骨髓瘤中却是一种表达很少的靶向抗原,常规流式细胞术几乎无法检测到多发性骨髓瘤表面CD19的表达。Garfall等[31]报告的1例RRMM患者,在接受清髓性化疗和自体干细胞移植后进行自体抗CD19嵌合抗原受体T细胞(CTL019)治疗获得完全缓解,且在治疗后12个月的评估中,没有发现疾病进展的证据,在血清和尿液中没有发现蛋白克隆。CD19 CAR-T疗法在该病例身上取得的临床效果令人鼓舞,但是否具有普遍意义仍需更多的临床试验来进行验证。另一项研究中,Nerreter等[32]通过超分辨率显微镜对14例MM患者的骨髓瘤样本进行检测,只在其中10例患者样本中检测到CD19的表达。且在体外实验中,虽然表达CD19的骨髓瘤细胞亚群容易被靶向CD19的CAR-T细胞清除,但也有小部分CD19阴性的肿瘤细胞未被清除。这提示单独靶向CD19的CAR-T治疗可能无法使MM患者获得完全缓解,需要与其他药物联合使用才能获得满意的临床疗效。
3 MM双靶点CAR-T
尽管MM患者接受CAR-T治疗后最初的反应率很高,但在临床研究中观察到因抗原逃逸而复发的患者比例也很高[33],其机制可能与CAR-T细胞体内扩增与持久性较差、肿瘤相关抗原的丢失或者表达下调[4,34-35]以及肿瘤微环境中普遍存在的免疫抑制因子有关[36]。由于已经批准的治疗方法很少,所以多数复发患者预后很差。一个明显的解决CAR-T治疗后抗原丢失问题的方法便是针对多个抗原受体的多靶点CAR-T的开发,以减少抗原逃逸的可能,主要集中在双靶点CAR-T的开发。目前研究出的双靶点CAR有以下几种形式:①CAR pool,又称联合CAR-T疗法,即相继或同时输注2种或者多种针对不同靶抗原的CAR-T细胞[37]。②Dual-CAR,采用双顺反子表达载体制备包含两种独立的CAR结构,它们针对肿瘤细胞上的两种不同抗原。③Tan CAR,又称串联CAR,由拥有两个独立的抗原识别结构域的单一受体构成,抗原结合域为单链跨膜糖蛋白,其抗肿瘤功能通过同时结合两种肿瘤抗原发挥作用[38]。
大量临床研究证实BCMA-CAR-T用于MM患者治疗具有良好的临床疗效,所以目前所进行的MM双靶点CAR-T研究多着眼于在靶向BCMA的基础上增加对另一种抗原的靶向,进而扩大对MM细胞靶点的覆盖范围,希望可以在一定程度上提高RRMM患者的缓解率,延长其生存期。
3.1 靶向BCMA+TACI 跨膜激活剂及钙调节剂和亲环素配体(Transmembrane activator and calcium modulator and cyclophilin ligand, TACI)也是一种TNFR超家族成员,几乎仅在浆细胞上表达,且在大多数骨髓瘤细胞中高水平表达。增殖诱导配体APRIL由骨髓中的骨髓细胞产生并以三聚体形式分泌,是BCMA和TACI的天然高亲和力配体,可以同时结合BCMA和TACI两种抗原[39-40]。
Lee等[39]使用截短形式的APRIL作为肿瘤靶向结构域(ACAR),可以同时识别MM细胞上的BCMA和TACI。ACAR-T细胞能够杀死表达任一受体的靶标,这有助于在BCMA下调或两种抗原同时表达的患者失去BCMA表达的情况下继续抑制疾病。另外,在肿瘤逃逸模型中,与以BCMA为靶点的CAR相比较,ACAR-T细胞对肿瘤清除更加迅速且完全。Schmidts等[40]设计了第二代具有三聚体APRIL(TriPRIL)结构域的CAR-T,证明了MM细胞在没有BCMA表达的情况下保留了TACI表达。与单体APRIL作为抗原结合域的CAR-T相比,TriPRIL-CAR-T与BCMA和TACI的结合及体内外针对MM的活性均增强。这些研究说明BCMA和TACI双靶点的CAR-T与单独靶向BCMA的CAR-T相比,对骨髓瘤细胞的清除效果更显著,提示BCMA和TACI双靶点CAR-T可以作为一项新型有效的MM治疗方式。
3.2 靶向BCMA+CD19 苏州大学第一附属医院进行了一项序列输注CD19-CAR-T和BCMA-CAR-T的临床试验[41],10例RRMM患者纳入该研究,7例接受自体输注,3例接受异体输注,结果提示,中位随访期为20个月,ORR为90%(5例PR和4例sCR),达到sCR的4位患者中3例患者无进展生存期超过2年。在该医院另外一项纳入16例RRMM患者的临床试验[42]中,采取了同样的方法输注CD19-CAR-T和BCMA-CAR-T细胞后,虽然观察到细胞因子释放综合征(Cytokine release syndrome,CRS),患者的体温及炎症因子水平均升高,但经过适当的治疗及护理后均恢复正常水平。这些临床试验结果初步证明了序贯输注CD19-CAR-T和BCMA-CAR-T可以使RRMM患者获得良好的临床疗效,且输注后的CRS可控,具有良好的耐受性和安全性。
徐州医科大学在2017年5月~2019年1月进行的一项Ⅱ期临床试验[43]中,21例RRMM患者淋巴细胞清除后,同时输注人源化抗CD19 CAR-T细胞和鼠抗BCMA CAR-T细胞。在179 d的中位随访中,ORR为95%,其中9例(43%)达sCR,3例(14%)达CR,5例(24 %) 达VGPR,3例(14%)达PR。Du等[44]开发了一种名为GC012F的Dual-CAR-T,同时靶向BCMA和CD19,纳入研究的28例RRMM患者被分为三组,淋巴细胞清除2~3 d后分别接受剂量为1×105/kg(DL1,n=2)、2×105/kg(DL2,n=10)和3×105/kg(DL3,n=16)的GC012F单次输注。中位随访6.3(1.8~29.9)个月时,DL1 ORR为100%(2/2),DL2 ORR为80%(8/10),DL3 ORR为93.8%(15/16)。GC012F输注后,共有25例患者出现了CRS,但多为低级别,说明GC012F具有良好的安全性。以上研究结果证实BCMA-CD19双靶点CAR-T是RRMM患者一种有希望的治疗选择。
3.3 靶向BCMA+CD38 有研究构建了一种新型靶向BCMA和CD38的BCMA-OR-CD38 Tan-CAR-T,当靶细胞上存在BCMA或CD38时,Tan-CAR T细胞可以触发强大的T细胞介导的细胞毒性和细胞因子产生;当同时遇到BCMA和CD38抗原时,这些Tan CAR-T比单靶向CAR-T细胞具有显著更高的细胞毒性和增殖能力。在体内试验中,BCMA-OR-CD38 Tan CAR-T细胞对携带骨髓瘤的异种移植NPG小鼠模型表现出强大的治疗作用,在给予第二剂Tan-CAR-T细胞后4 d即可实现肿瘤的完全清除,且没有观察到复发[35]。另外一项研究[45]中设计了一种靶向BCMA和CD38的人源化双特异性BM38 CAR,相较于表达单个BCMA或CD38 CAR的T细胞,BM38 CAR-T对异质MM细胞的体外细胞毒性更强,且在异种移植小鼠模型中也表现出有效的抗骨髓瘤活性。长江大学第二附属医院进行的一项临床研究[46]中设计了的一种抗BCMA和低亲和力抗CD38的CAR-T,与单靶向BCMA或CD38的CAR-T细胞相比,该BCMA-CD38 CAR-T细胞在体外对BCMA阳性与CD38阳性的细胞表现出更强的杀伤作用。在体内抗肿瘤活性的研究中,本次临床试验招募了16例RRMM患者,输注BCMA-CD38 CAR-T细胞后,ORR为87.5%,1年PFS率为68.8%,且在中位随访11.5个月时,在13例实现sCR的患者中,76.9% (10/13)的患者在随访期间没有复发或进展。以上研究结果说明BCMA-CD38 CAR-T相较于BCMA单靶点CAR-T其抗肿瘤活性更强,在RRMM治疗中具有较高的临床疗效。
3.4 靶向BCMA+CS1(SLAMF7) Golubovskaya等[47]制造了一种新型双特异性CS1-BCMA串联CAR-T,靶向BCMA阳性和CS1阳性的MM细胞系,可以有效阻断MM异种移植小鼠模型肿瘤的生长。Zah等[48]设计了一种BCMA/CS1 OR-gate CAR-T(Dual-CAR-T),该细胞可以有效地靶向表达BCMA或CS1的肿瘤细胞,同时保持强大的离体扩增,并且减少自相残杀的副作用。与同时表达两种靶向BCMA和CS1的单独CAR的T细胞相比,BCMA/CS1 OR-gate CAR-T 细胞具有更好的CAR表达和增殖能力,在体内实验中可以更好地控制MM肿瘤的生长,明显延长小鼠生存期。他们还证明了BCMA/CS1 OR-gate CAR-T与抗PD-1抗体联合治疗可以进一步加快体内初始肿瘤的清除率。Li等[49]设计了一种鼠源化双特异性CS1-BCMA串联CAR-T,共13例患者接受了CS1-BCMA CAR-T细胞输注,ORR为76.9%(10/13),其中4例达到sCR,2例VGPR,4例PR。9个月时PFS为77.1%。在接受CAR-T输注后,4例患者(31%)发生CRS,但未观察到神经毒性。该研究表明双特异性CS1-BCMA CAR-T细胞在经过大量预处理的MM患者中具有良好的临床活性和安全性。
3.5 靶向BCMA+GPRC5D 为探讨两种单靶向CAR-T混合,双顺反子CAR-T和串联CAR-T的活性,Larrea等[50]设计了不同形式的BCMA和GPRC5D双靶向CAR-T细胞,他们发现在异种移植骨髓瘤模型小鼠中,BCMA-GPRC5D-CAR-T在有效清除体内肿瘤的同时可以有效防止由BCMA逃逸介导的肿瘤的复发。该研究同时还证明了在靶向BCMA阴性疾病时,双顺反子和混合方法的CAR-T疗法疗效较高;对于双抗原表达疾病,双顺反子方法比混合方法更有效。
4 小结
CAR-T细胞治疗是目前MM免疫治疗中最具前景的疗法,相较于传统的蛋白酶体抑制剂、单克隆抗体、免疫调节剂等治疗手段,CAR-T细胞疗法对骨髓瘤细胞表现出显著的靶向性及更强的杀伤能力,使MM患者的缓解深度及生存期得到持续改善。但CAR-T治疗后因肿瘤细胞免疫逃逸等而导致的复发问题仍是研究者们面临的巨大挑战,目前针对该问题所开发的MM多靶点尤其是双靶点CAR-T的临床研究已初见成效,增加MM细胞的抗原表达是另一解决问题的方向;其次,由于抑制性骨髓微环境、先前治疗引起的T细胞功能受损等因素,CAR-T细胞输注后常出现CAR-T耗竭与功能紊乱等,所以如何提高CAR-T细胞治疗疗效的持久性兹待解决;另外,相较于单靶点,双靶点CAR-T制备的难度和成本大大增加,为解决此问题,需要积极开发无病毒转染技术等以降低生产成本,提高其临床可行性;最后,CAR-T治疗的不良反应如CRS、神经系统事件等提示CAR-T治疗相关技术需要进一步优化与完善,而且双靶点CAR-T是否会增加这些不良反应发生的风险也待进一步考究。综上,CAR-T疗法治疗MM有广阔的研究空间,相信随着未来更多研究和临床试验的进行,CAR-T细胞治疗的安全性和有效性会进一步提升,为MM患者带来更多的希望。

