投喂频率对珍珠龙胆石斑鱼生长影响的代谢组学分析
程学文,史存卓,刘鹰,傅松哲,张磊,田野,熊玉宇*
(1.大连海洋大学 水产与生命学院,辽宁 大连 116023;2.设施渔业教育部重点试验室(大连海洋大学),辽宁 大连 116023;3.浙江大学 生物系统工程与食品科学学院,浙江 杭州 310058;4.大连海洋大学 海洋科技与环境学院,辽宁 大连 116023)
投喂频率是养殖管理中的重要环节,对养殖鱼类的摄食、生长、饲料利用和代谢等具有重要影响[1-3]。适宜的投喂频率可以提高鱼类的生长速率,降低饲料系数,减少水质污染物[4]。在鱼类养殖生产过程中,饲料成本约占总成本的60%,因此,开展投喂策略研究,可以大幅降低饲料成本,提高养殖效益[5]。
珍珠龙胆石斑鱼(Epinepheluslanceolatus♂×E.fuscoguttatus♀),又称“龙虎斑”或“珍珠斑”,是由棕点石斑鱼(E.fuscoguttatus♀)与鞍带石斑鱼(E.lanceolatus♂)杂交繁育的新品种,在温度为14~35 ℃、盐度为1~55的海水中均能存活和摄食,最适宜温度为25~35 ℃,最适宜海水盐度为4~45[6]。珍珠龙胆石斑鱼生长速率较快,同时拥有母本良好的抗病能力和肉质细嫩的特点,是适宜工厂化循环水养殖的重要对象之一[7]。对珍珠龙胆石斑鱼最适投喂频率的研究表明,在饱食投喂条件下,投喂频率为2~4次/d时,珍珠龙胆石斑鱼具有较高的特定生长率和较低的饲料系数[4,8-9]。在鱼类工厂化循环水养殖中,高投喂频率有利于水质稳定,且实际投喂率低于饱食投喂率,但在低投喂率条件下提高投喂频率对鱼类生长的影响及机制尚不清楚。
代谢组学能揭示基因型和表型之间的联系,基因组和蛋白质组的细微功能变化可以在代谢层面上放大,使检测更容易[10]。利用代谢组学技术方法,可以清晰地研究外界因子如何影响鱼类的代谢和生长。如Zhang等[11]使用代谢组学技术研究了温度对欧洲舌齿鲈(Dicentrarchuslabrax)生长发育和肝脏代谢的影响。代谢组学技术在黄姑鱼(Nibeaalbiflora)对寒冷和饥饿的生理反应[12],以及易逝期贝类活品品质变化机制[13]等研究中也得到了广泛应用。应用代谢组学技术,可为研究投喂频率对水产动物生长的影响提供新的方法,但有关该方面的研究尚未见报道。
本研究中,模拟工厂化循环水养殖生产条件,在低于饱食投喂率条件下,比较了高、中、低3种不同投喂频率对珍珠龙胆石斑鱼生长的影响,并采用TM广靶代谢组学方法进行代谢组学分析,以期解析投喂频率影响鱼类生长的代谢机制,为科学制定工厂化循环水养殖珍珠龙胆石斑鱼的适宜投喂频率提供参考依据。
1 材料与方法
1.1 材料
试验用珍珠龙胆石斑鱼由大连富谷水产有限公司于2019年繁育,并于当年11月运回设施渔业教育部重点试验室(大连海洋大学),在循环水养殖系统中暂养。试验鱼在暂养期间,每天投喂2次(8:00和17:00)海水鱼膨化配合饲料,饲料营养成分:粗蛋白质43.0%,粗脂肪5.0%,粗灰分15.0%,赖氨酸2.2%,水分12.0%,总磷1.00%,钙1.00%~4.00%,氯化钠0.50%~3.00%(均为质量分数)。2021年4月15日挑选出180尾健康无伤的试验鱼进行投喂频率试验。试验鱼的初始体质量为(469±75)g,体长为(245±14)mm。为追踪个体生长信息,所有试验鱼均注射电子芯片标记(PIT)。
1.2 方法
1.2.1 循环水养殖系统 为了保持养殖环境稳定一致,试验使用了3套相同的循环水养殖系统,每个养殖系统包括3个相同的养殖桶(图1)。循环水养殖系统由养殖桶、旋涡式固液分离器、履带式微滤机、蛋白分离器、生物滤池、调温冷暖机、增氧装置、紫外线杀菌器、LED灯、水质在线监测系统和自动控制系统等单元组成。养殖桶为蓝色塑料(PVC)材质,上部为圆柱体,下部近似圆锥体,直径为0.93 m,最大水深为1.00 m,有效养殖水体为0.64 m3,进水量为0.8 m3/h。养殖系统自动排污补水,源水为经过沉淀的天然海水。养殖桶上方加盖以遮蔽室内光源,养殖光源为全光谱LED灯,灯的开关自动控制,光照时间设定为7:30—19:30,水面最大光照强度为372 lx。试验期间,水温为(25.7±1.3)℃,溶解氧为(4.19±0.85)mg/L,盐度为(31.43±0.34),pH为(7.61±0.14)。
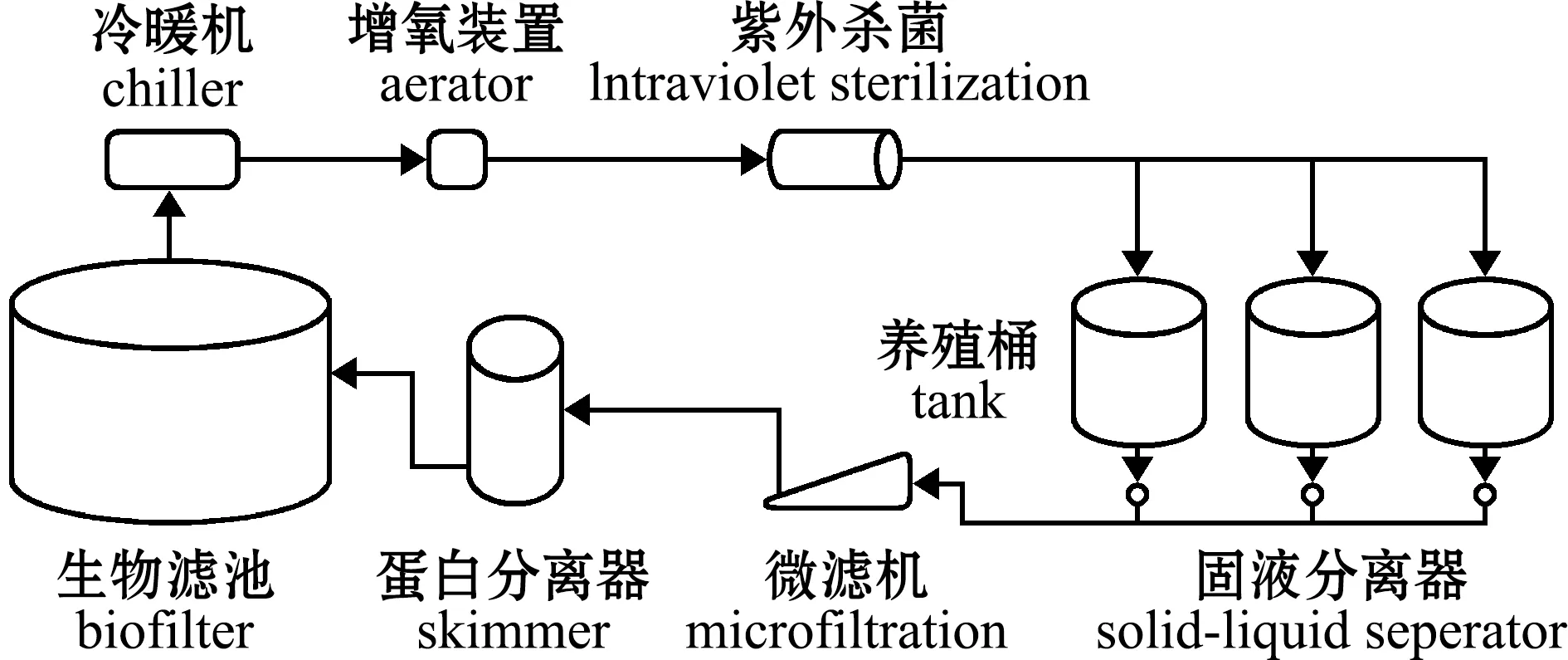
图1 循环水养殖系统Fig.1 Recirculating aquaculture system
1.2.2 试验设计 试验设置F1组(1次/d,8:00,低频率投喂组)、F2组(2次/d,8:00,17:00,对照组)和F4组(4次/d,8:00,11:00,14:00,17:00,高频率投喂组)3个投喂频率组,每组设置3个平行,每个平行放试验鱼20尾。3组分别在3套循环水养殖系统中饲养60 d。为了满足试验期间投喂率低于饱食投喂率,参照仇登高等[7]饱食投喂条件下珍珠龙胆石斑鱼(体质量为298~503 g)的摄食率(1.07%~1.24%),各处理组的投喂率均设定为0.90%。投喂过程中观察摄食情况,并记录投喂饲料量和剩余饲料量,用于计算摄食量。分别在试验的第0、17、30、45、60天时测量每个养殖桶每尾试验鱼的体质量,并进行生长性能分析,取第60天时F1和F4组鱼的肝脏组织,液氮中速冻后于-80 ℃下保存,用于代谢组学分析(表1)。测量前一天和当天禁食,测量后根据每个养殖桶鱼的总体质量调整投喂量,各组日投喂率均为0.90%。试验鱼先用丁香酚麻醉后再进行体质量测量。

表1 生长测量和取样流程
1.2.3 摄食与生长性能指标计算 摄食率(RC,%)、特定生长率(RSG,%/d)和饲料系数(RFC)计算公式为
RC=(F-R)/Wt1×100%,
RSG=(lnWt2-lnWt1)/(t2-t1)×100%,
RFC=(F-R)/(Wt2-Wt1)。
式中:F和R分别为投喂饲料量和剩余饲料量(g);Wt2和Wt1分别为t2和t1时对应的体质量(g)。
1.2.4 代谢组学分析
1)样品提取。从-80 ℃超低温冰箱中取出样品置于冰上解冻,将样品切碎混匀,多点取样称量(20±1)mg置于对应编号离心管中;加入一粒钢珠,用球磨仪(30 Hz)匀浆20 s,4 ℃条件下以3 000 r/min离心30 s;弃去上清液后,加入体积分数为70%的甲醇水内标提取液400 μL,以1 500 r/min振荡5 min,冰上静置15 min;4 ℃下以12 000 r/min离心10 min,移取上清液300 μL到另一对应编号离心管中,-20 ℃下静置30 min;4 ℃下以12 000 r/min再离心3 min,移取上清液200 μL到对应进样瓶内衬管中,用于上机分析。
2)数据采集仪器。数据采集仪器系统主要包括超高效液相色谱(Ultra Performance Liquid Chromatography,UPLC,ExionLC AD,https://sciex. com.cn/)和串联质谱(Tandem Mass Spectrometry,MS,QTRAP®sciex.com/)。
3)数据检测与分析。采用Analyst 1.6.3软件处理质谱数据。基于迈维(武汉)生物技术有限公司自建靶向标品数据库MVDB 及整合公共数据库MHK、MetDNA进行定性分析,并提取出鉴定代谢物的多离子对信息及保留时间RT (retention time),结合靶标数据库,同时在Q-Trap进行定量分析。利用R软件(www.r-project.org)对两组样品进行主成分分析(PCA)、聚类分析(HCA)。采用正交偏最小二乘法判别分析(OPLS-DA)分析相关性较小的变量,并对模型进行验证[14]。代谢物差异倍数值(fold change)为2倍以上或0.5以下时,认为有显著性差异。采用KEGG数据库[15]对筛选出的差异代谢物进行注释、分类、聚类、富集分析和代谢通路整体变化分析。采用Pearson相关系数描述相关分析结果。
1.3 数据处理
试验数据均以平均值±标准差(mean±S.D.)表示。采用SPSS 19.0软件进行单因素方差分析(ANOVA),采用最小显著差数法(LSD)进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 生长与摄食
从表2可见:经过60 d的饲养,投喂频率对珍珠龙胆石斑鱼生长有显著性影响(P<0.05);各组体质量均随养殖时间的延长而增大,自30 d开始,高频率投喂组F4的体质量显著高于其他两组(P<0.05);随着投喂频率增加,珍珠龙胆石斑鱼各时间段的SGR总体有升高趋势。
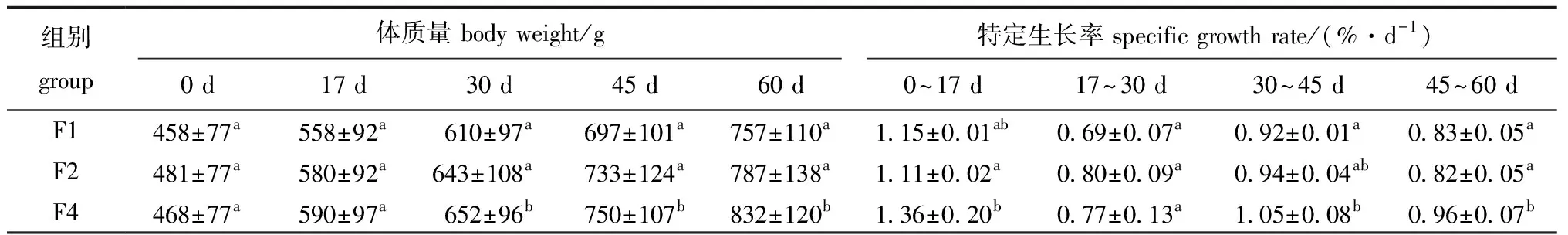
表2 投喂频率对珍珠龙胆石斑鱼体质量和特定生长率的影响Tab.2 Effects of feeding frequency on the body weight and specific growth rate of pearl gentian grouper
从表3可见:投喂频率对珍珠龙胆石斑鱼的摄食率无显著性影响(P>0.05),各组的摄食率均随鱼体生长逐渐降低;不同生长阶段的FCR波动较大,各组FCR随养殖时间延长总体呈现升高趋势,即在0~17 d时FCR较低,在45~60 d时FCR较高,但组间差异随养殖时间延长而减小,F4组在0~17 d时的FCR显著低于F1和F2组(P<0.05),但在17~30 d、30~45 d和45~60 d时的FCR与其他两组无显著性差异(P>0.05)。
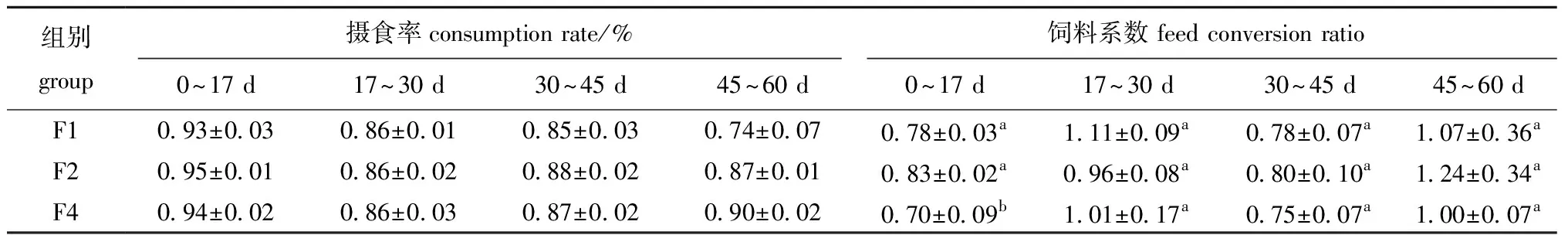
表3 投喂频率对珍珠龙胆石斑鱼摄食率和饲料系数的影响Tab.3 Effects of feeding frequency on the consumption rate and feed conversion ratio of pearl gentian grouper
2.2 代谢组学分析
基于迈维自建靶标数据库MVDB,对肝脏样品代谢物进行质谱定性和定量分析,共检测到1 213个代谢物。
通过OPLS-DA等方法对代谢组学数据进行分析,结果显示,F1组和F4组组内聚集性较好,组间存在显著性差异(图2)。
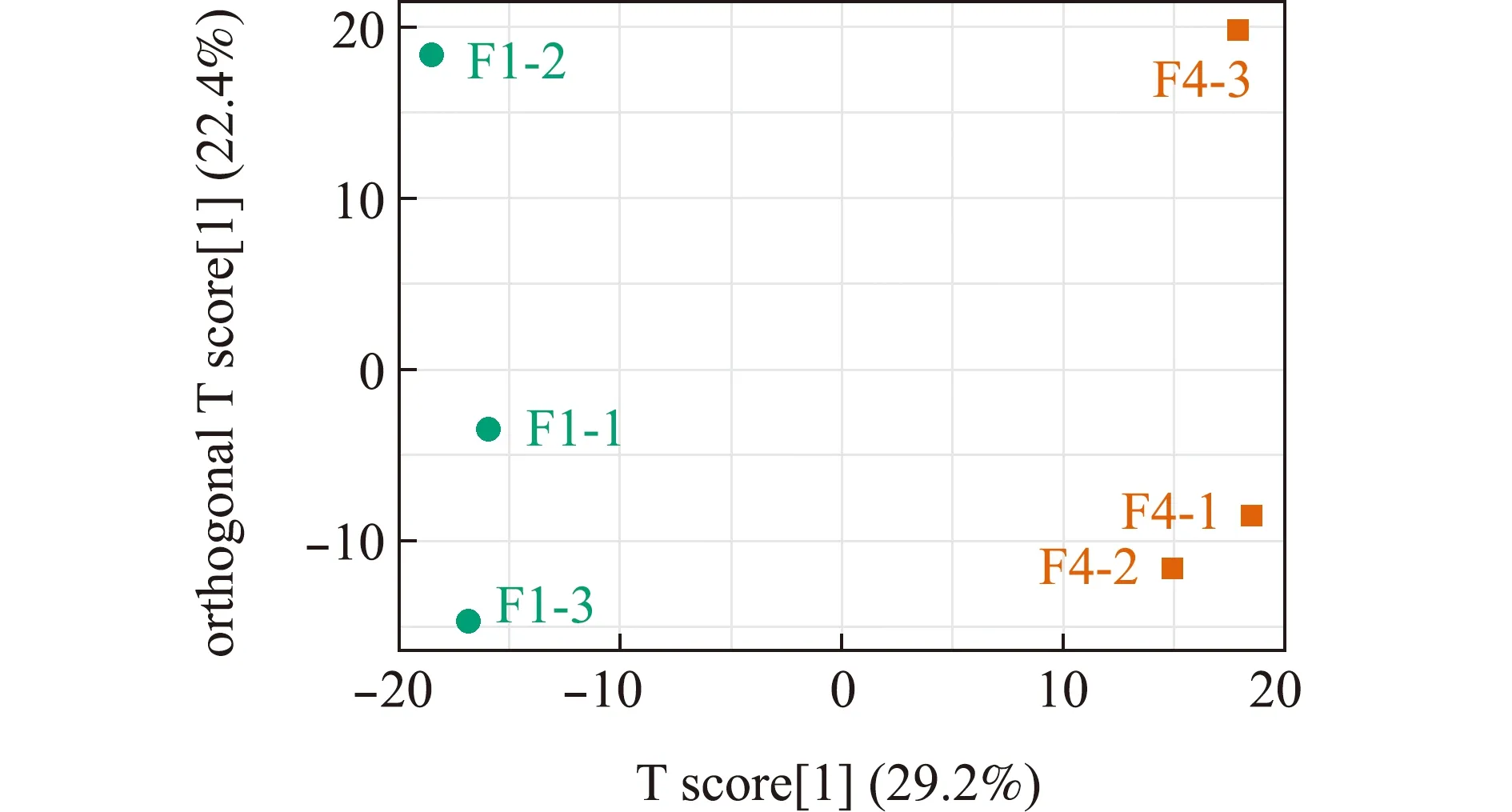
图2 F1组和F4组代谢组学数据的OPLS-DA得分Fig.2 OPLS-DA score plot of metabolomics data in groups F1 and F4
根据OPLS-DA分析结果,对F1组和F4组间的差异代谢物进一步进行筛选和分类,共发现157个差异代谢物。从图3可见,121个差异代谢物相对含量上调,36个差异代谢物相对含量下调。
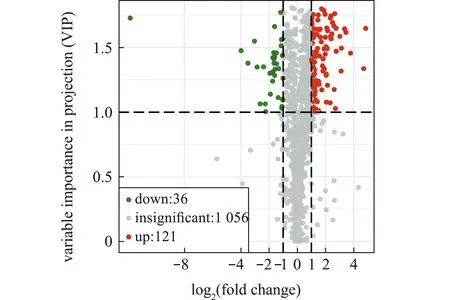
图3 F1组和F4组差异代谢物火山图Fig.3 Volcano plot of differential metabolites in groups F1 and F4
为方便观察代谢物相对含量的变化规律,对应用筛选标准鉴定得到的差异代谢物的原始相对含量采用标准化处理(unit variance scaling,UV scaling),通过R软件的Heatmaply和ComplexHeatmap包绘制聚类热图(图4),F1组和F4组差异代谢物种类主要有脂肪酰类(14.0%)、有机酸及其衍生物(11.4%)、氨基酸及其代谢物(10.1%)和核苷酸及其代谢物(7%)。随着投喂频率增加,肝脏代谢物中二十碳四烯酸、L-乳酸、丙二酸、L-甲状腺素、D-甘露醇、牛磺胆酸、黄嘌呤核苷、马尿酸、犬尿氨酸、亚叶酸、戊二酸、L-苹果酸和UDP葡萄糖等121个差异代谢物相对含量上调,莽草酸、乳清酸、L-天冬氨酸、胍基乙酸和5-氨基戊酸等36个差异代谢物相对含量下调。

Scale为代谢物相对含量标准化处理后得到的数值(颜色越红表示含量越高)。Scale is the value obtained by standardizing the relative content of metabolites (the redder the color is,the higher the content is).图4 F1组和F4组差异代谢物聚类热图Fig.4 Heatmap of differential metabolites in groups F1 and F4
为探索珍珠龙胆石斑鱼肝脏对不同投喂频率响应的潜在代谢途径,将筛选出的差异代谢物与KEGG数据库中的代谢途径相关联,以识别与投喂频率相关的潜在生物标记物的代谢途径。对代谢组学数据进行处理,绘制差异代谢物KEGG分类(图5)和KEGG富集图(图6)。从图5可见,F1组和F4组肝脏差异表达代谢物的相关代谢通路分为5类,即生物体系统(organismal systems)、新陈代谢(metabolism)、人类疾病(human diseases)、遗传信息处理(genetic information processing)和环境信息处理(environmental information processing)。其中,代谢类中的代谢途经和生物合成辅助因子通路的差异代谢物个数较多,分别为45、13个。
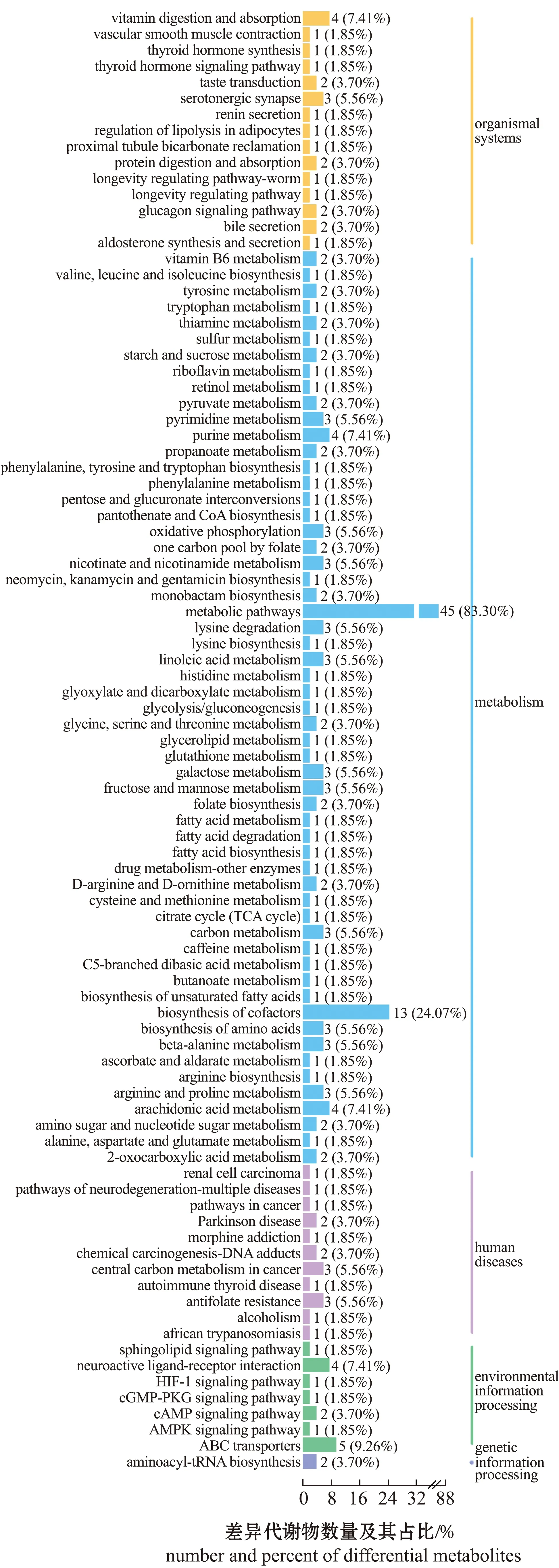
图5 F1和F4组肝脏样品差异代谢物KEGG分类Fig.5 KEGG classification of differential metabolites in liver samples in groups F1 and F4
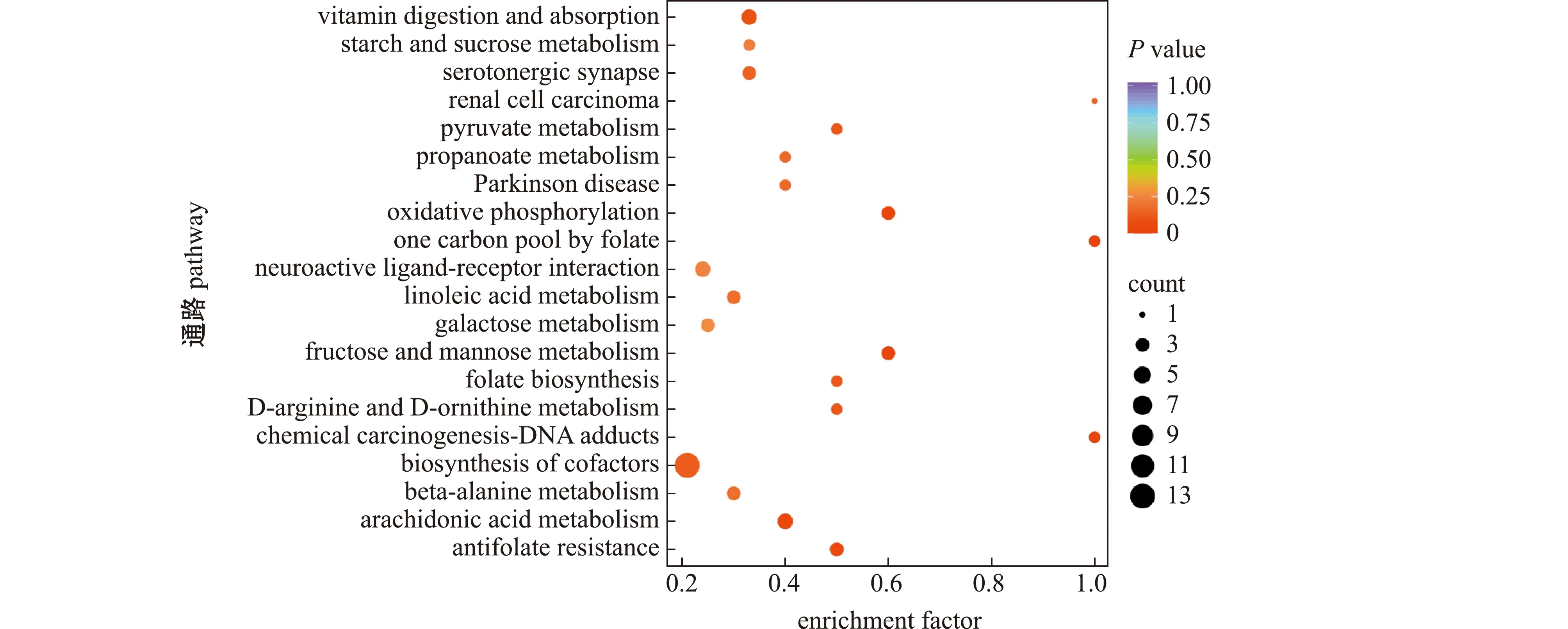
点的颜色为P value,其颜色越红表示差异代谢物富集越显著;点的大小代表富集到的差异代谢物的个数。The color of the point indicates the P-value,and the redder means the more significant the enrichment.The size of the dot represents the number of differential metabolites enriched.图6 F1和F4组肝脏样品差异代谢物KEGG富集通路(前20)Fig.6 KEGG enrichment path way of differentially expressed metabolites in liver samples of groups F1 and F4(top 20)
由图6可见,差异代谢物被显著地富集到维生素消化吸收、淀粉与糖代谢、5-羟色胺神经元、丙酮酸代谢、氧化磷酸化、叶酸一碳单位库、果糖与甘露糖代谢、叶酸生物合成、精氨酸与鸟氨酸代谢、生物合成辅助因子、β-丙氨酸代谢和花生四烯酸代谢等代谢通路。其中,与新陈代谢相关的氧化磷酸化、叶酸一碳单位库、果糖与甘露糖代谢和花生四烯酸代谢4个信号通路的富集程度较大。
根据筛选出的肝脏差异代谢物代谢途径的相关性,绘制F1组和F4组肝脏样品KEGG代谢通路图(图7)。其中,主要涉及的代谢通路包括半乳糖代谢、糖酵解/糖异生代谢、苯丙氨酸代谢、牛磺酸代谢、胆汁分泌代谢和鸟氨酸循环代谢等,均与能量代谢和生长有关。共识别出8个关键差异代谢物,其中,牛磺胆酸、UDP-葡萄糖、L-乳酸和L-甲状腺素4个差异代谢物相对含量上调,莽草酸、天冬氨酸、乳清酸和胍基乙酸4个差异代谢物相对含量下调。UDP-葡萄糖相对含量上调,可促进葡萄糖的合成,通过糖酵解增加能量供应。其中,L-乳酸相对含量上调,经多步酶促反应形成磷酸烯醇丙酮酸,经糖异生合成葡萄糖,提供能量储备。UDP-葡萄糖和L-乳酸相对含量上调,通过多步反应,最终促进合成L-甲状腺素。L-甲状腺素相对含量上调,可促进生长代谢。而天冬氨酸相对含量下调,可减少精氨酸合成,从而减少胍基乙酸合成。胍基乙酸相对含量下调,可减少肌酸合成。牛磺胆酸相对含量上调,可增加腺苷蛋氨酸的消耗,从而减少肌酸合成。表明这些代谢物相对含量上调或者下调,可能减少氨基酸代谢供能,增加了糖代谢供能,从而促进鱼类生长。
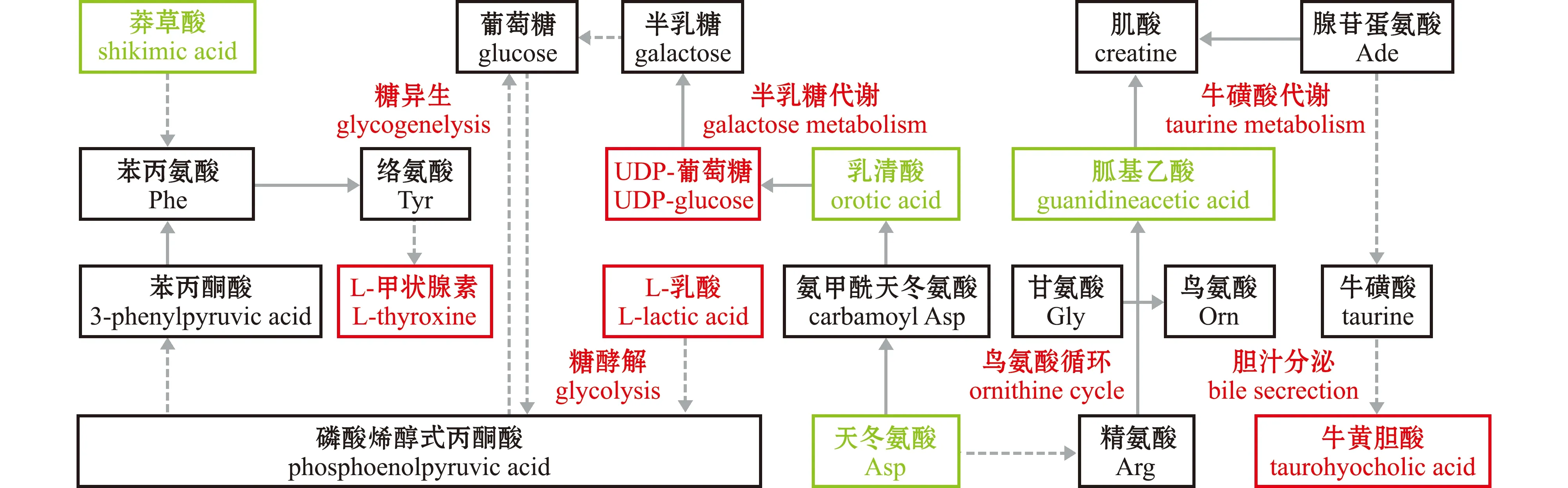
相对含量上调的代谢物用红色表示,相对含量下调的代谢物用绿色表示;实线表示可以通过一步酶促反应得到对应代谢物,虚线表示通过多步酶促反应得到对应代谢物。Up-regulated metabolites are shown in red,and down-regulated metabolites are shown in green;The solid line indicates that the corresponding metabolite can be obtained by one-step enzymatic reaction,and the dotted line means that the corresponding metabolite can be obtained by multi-step enzymatic reaction.图7 F1组和F4组肝脏样品KEGG代谢通路Fig.7 Metabolic pathway diagram of KEGG in liver samples of groups F1 and F4
2.3 生长与代谢的关系
为了探讨生长与代谢的关系,对代谢组学分析样品的SGR与关键差异代谢物的丰度进行了相关性分析。从表4可见:对6个样品生长信息进行统计分析发现,0~60 d时,F4组的SGR显著高于F1组(P<0.05),在此期间,SGR的组间差异随着养殖时间的延长而减小,在前期(0~30 d)和后期(30~60 d),F4和F1组SGR的差值分别为0.47和0.12。
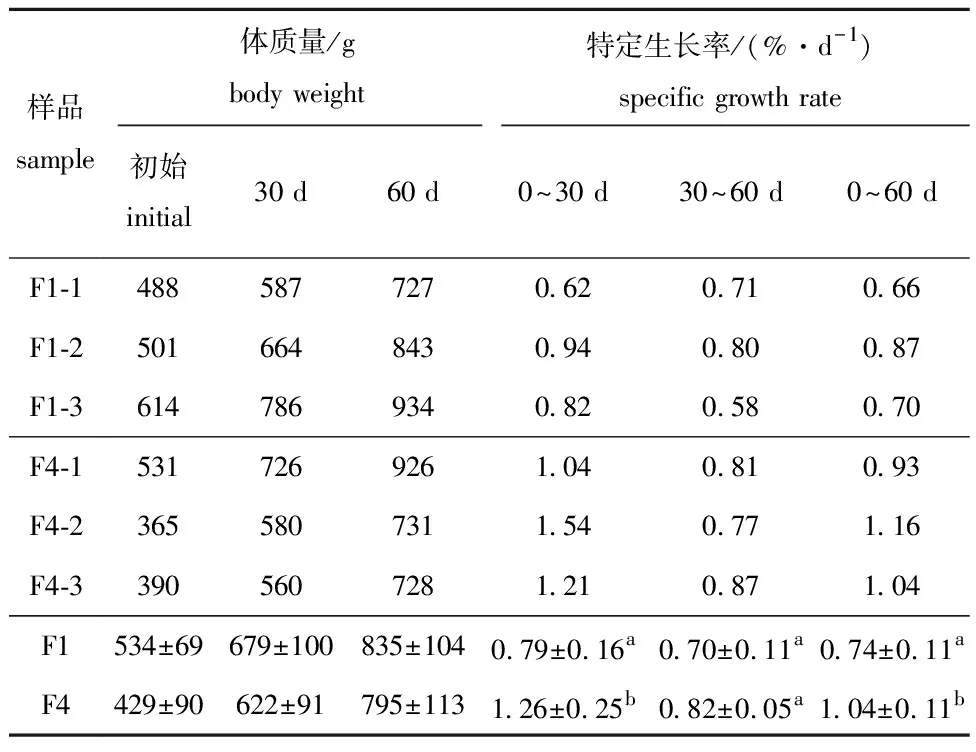
表4 用于肝脏靶向代谢组学分析的6尾试验鱼个体体质量及生长的跟踪测量
关键差异代谢物中,L-甲状腺素和胍基乙酸分别与生物合成和能量代谢有关。Pearson相关性分析表明,6个样品的SGR(0~60 d)与L-甲状腺素丰度呈显著正相关(r=0.929),与胍基乙酸丰度呈显著负相关(r=-0.809)。
3 讨论
3.1 投喂频率对珍珠龙胆石斑鱼生长的影响
投喂频率对大多数鱼类的生长具有显著影响[16]。本研究表明,在低于饱食投喂率条件下,珍珠龙胆石斑鱼特定生长率随投喂频率的增大呈逐渐升高趋势,这与朱晓芳等[4]对珍珠龙胆石斑鱼幼鱼投喂频率的研究结果一致。但本研究中,珍珠龙胆石斑鱼的最大特定生长率出现在投喂频率为4次/d时,且4次/d组显著高于2次/d组(表2),这与珍珠龙胆石斑鱼最佳投喂频率为2次/d的观点不一致[8]。有关珍珠龙胆石斑鱼最佳投喂频率研究大多在饱食投喂条件下进行。王成桂等[8]研究表明,当投喂频率为2次/d时,特定生长率达到最大值,且在一定范围内,摄食率随投喂频率增加而升高。而特定生长率又随摄食率的升高呈先升高后下降的变化规律[1],故在饱食投喂条件下,4次/d组摄食率比2次/d组高,其特定生长率反而比2次/d组低。本研究中,投喂率低于饱食投喂率,各组的投喂率相同,而且实际摄食率组间无显著性差异,排除了投喂率或摄食率的影响,所测定的特定生长率变化能够更好地反映投喂频率的影响。唐怀庆等[9]研究表明,投喂频率对鱼类生长的影响与投喂率或摄食率有关,珍珠龙胆石斑鱼幼鱼在投喂水平为81.24%饱食条件下的特定生长率最高。因此,在珍珠龙胆石斑鱼工厂化循环水养殖生产中,鉴于实际投喂率通常低于饱食投喂率,建议将投喂频率增加到4次/d,以提高其生长率。
从生物能量学角度看,生长可看作食物能与能量收支其他组分之差,同种鱼类不同个体生长差异主要是由摄食率差异或者摄食代谢占食物能比例的差异造成的[17]。珍珠龙胆石斑鱼为肉食性凶猛鱼类,存在明显的集群现象,在高密度养殖条件下,攻击抢食现象明显[18]。其生长受投喂频率影响,一般认为与摄食率不同有关[7-9]。本研究中,不同投喂频率组试验鱼的摄食率相同,但生长率仍有显著性差异。因此,低投喂率条件下,珍珠龙胆石斑鱼幼鱼生长差异可能主要是由摄食代谢差异造成的。从摄食代谢方面看,相对于1次/d组,4次/d组的投喂间隔时间较短,饥饿导致的饵料竞争可能较小,从而降低了用于摄食活动的能量消耗。
3.2 投喂频率对肝脏代谢的影响
在不同的投喂频率条件下,鱼体的能量代谢可能不同。本研究中,通过肝脏代谢组学分析发现,投喂频率组间的差异代谢物主要为新陈代谢类,主要富集在代谢途径和生物合成辅助因子代谢通路,且显著富集于氧化磷酸化、叶酸一碳单位库、果糖与甘露糖代谢及花生四烯酸代谢等与能量代谢相关的代谢通路。随着投喂频率增加,牛磺胆酸、UDP-葡萄糖、L-乳酸和L-甲状腺素4个差异代谢物相对含量上调,莽草酸、天冬氨酸、乳清酸和胍基乙酸4个差异代谢物相对含量下调。这些结果表明,投喂频率对珍珠龙胆石斑鱼的能量代谢有显著影响。
肝脏是糖脂代谢调控的中枢器官,糖脂代谢的稳态调控是维持机体基本生命活动的基础。本研究中发现,珍珠龙胆石斑鱼花生四烯酸代谢通路受投喂频率的影响显著,其中,二十碳四烯酸、二十碳五烯酸与二十二碳六烯酸在4次/d组中下降为不足原来的三分之一。不同投喂频率条件下,试验鱼受到的饥饿胁迫程度不同,投喂频率对脂代谢的影响可能与饥饿程度不同有关。张彦坤等[19]在剑尾鱼(Xiphophorushelleri)饥饿胁迫试验中发现,肝脏不饱和脂肪酸的生物合成代谢通路受饥饿胁迫影响。花生四烯酸是一种ω-6多不饱和脂肪酸,在生物体内主要以磷脂的形式存在于细胞膜上,在细胞内主要通过环氧合酶、脂氧合酶和细胞色素P450单氧化酶途径等进行代谢[20]。提高投喂频率,可能会降低相应代谢通路的物质能量消耗。
UDP-葡萄糖可以通过糖原合酶合成糖原,作为动物细胞中的次要短期能量储存。剑尾鱼遭受饥饿胁迫后,肝脏中UDP-葡萄糖相对含量显著下调[19]。与此研究结果一致,本研究中,高投喂频率组的UDP-葡萄糖相对含量上调,表明糖原合成减少,或者其短期能量储存较少。这是因为高投喂频率组与低投喂频率组相比,受到的饥饿胁迫程度较小。因此,UDP-葡萄糖相对含量上调或下调不仅能够指示饥饿程度,还能反映投喂频率对糖代谢的影响。蔡春芳等[3]研究结果表明,增加投喂频率能显著改善彭泽鲫对饲料糖的利用。孙金辉等[21]研究表明,在固定日投喂率的情况下,饲料糖水平为10%时,最佳投喂频率为4次/d。在饲料中添加有机酸(如丁酸钠)可以增加鲤机体对葡萄糖的耐受力,从而促进其生长[22]。因此,提高投喂频率促进鱼类生长,可能与饲料糖的利用效率提高有关。
牛磺酸与抗氧化、线粒体代谢调控有关。在饲料中添加牛磺酸对斜带石斑鱼(Epinepheluscoioides)肝脏组织代谢有积极调控作用[23],对鱼肠组织中的代谢物也有显著影响[24]。本研究中也发现,高投喂频率组牛磺胆酸显著上调,说明增加投喂频率能够改善肝脏组织代谢。
胍基乙酸是肌酸的直接前体物质,而肌酸是肌肉和神经组织能量代谢中的一种重要化合物[25]。胍基乙酸广泛分布在动物全身的各个器官中[26],肝脏中的胍基乙酸,在腺苷甲硫氨酸-胍基乙酸N-甲基转移酶的催化下生成肌酸[27]。肌酸和磷酸肌酸一起组成磷酸原系统,促进能量代谢。本研究中,高投喂频率组胍基乙酸相对含量下调,表明增加投喂频率可减少体内胍基乙酸合成。在植物蛋白源饲料中添加胍基乙酸,对卵形鲳鲹生长有促进作用[28]。因此,笔者认为,通过提高投喂频率,与饲料中添加胍基乙酸一样,能够减少体内胍基乙酸合成,从而促进鱼类生长。
综上,花生四烯酸、UDP-葡萄糖、牛磺胆酸和胍基乙酸等代谢物均与能量代谢通路相关,因此,本研究结果支持投喂频率影响鱼类摄食能量代谢的观点,为解析投喂频率影响鱼类生长的机制提供了新的试验证据。
3.3 投喂频率影响鱼类生长的机制
投喂频率影响鱼类的摄食量和觅食活动能量消耗。投喂频率增加,在一定范围内可以增加摄食量,从而影响鱼类生长。但在摄食量相同的情况下,投喂频率对生长的影响可能主要与食物消化代谢和合成代谢有关。本研究中,在相同的低投喂率(0.9%)条件下,发现投喂频率对生长仍然具有显著影响。通过肝脏代谢组学分析发现,L-甲状腺素、胍基乙酸与生长速率有关,前者随生长速率增大相对含量表现上调,且在高投喂频率组中的含量较高;后者随生长率增高相对含量表现下调,且在低投喂频率组中含量较高。降低投喂频率可能迫使鱼类分配更多的能量用于合成胍基乙酸,为摄食活动供能,导致生长较慢。L-甲状腺素具有促进生长的功能[29],而胍基乙酸可通过一系列的生化反应增加能量的消耗,从而减慢鱼类生长[27]。因此,增加投喂频率,可能通过改变摄食节律,促进甲状腺素分泌及减少胍基乙酸合成,从而促进鱼类生长;降低投喂频率,可能减少了甲状腺素的分泌,并迫使鱼类分配更多的能量用于合成胍基乙酸为摄食活动供能,从而导致生长减慢。
4 结论
1)在低于饱食投喂率条件下,投喂频率增加到4次/d,有利于工厂化循环水养殖珍珠龙胆石斑鱼的生长。
2)在固定投喂率条件下,投喂频率对生长的影响主要与能量代谢差异有关。
3)L-甲状腺素和胍基乙酸等差异代谢物与投喂频率引起的生长差异相关,可以作为生物标志物,用于最佳投喂频率研究。

