20 种卵菌杀菌剂对海南万宁胡椒瘟病菌的室内抑菌活性
高圣风, 付华菲, 海 龙, 苟亚峰, 孙世伟,刘世超, 薛 超, 田 甜, 温思为
(1.中国热带农业科学院 香料饮料研究所 海南 万宁 571533;2.海南省热带香辛饮料作物遗传改良与品质调控重点实验室海南 万宁 571533;3.云南农业大学 热带作物学院 云南 普洱 665000)
1 材料与方法
胡椒Piper nigrumL.属胡椒科Piperaceae 胡椒属Piper多年生常绿藤本植物,是世界上使用最广泛的香料之一,被誉为“香料之王”[1]。胡椒瘟病具有极强的毁灭性和传播性,于20 世纪70 年代曾在海南省爆发流行,导致种植面积缩减20%[1],是危害胡椒生产的首要病害。但是胡椒瘟病的病原菌物种分类尚存争议,这不利于其机理研究和防控工作的开展。
胡椒瘟病是世界性病害。在国外,胡椒瘟病菌最初因为其玫瑰花瓣状菌落形态被认为是棕榈疫霉Phytophthora palmivora[2],后来发现,马来西亚胡椒瘟病菌游动孢子囊形态更接近于当地的辣椒疫霉P.capsici[3]。在国内,张开明等[4]根据孢子囊特征认为中国华南地区胡椒瘟病的病原菌有2 种,辣椒疫霉和寄生疫霉P.parasitica;桑利伟等[5]调研海南省胡椒病害时发现,胡椒瘟病菌孢子囊形态特征与辣椒疫霉一致,且内转录间隔区(internal transcribed spacer,ITS)序列与辣椒疫霉菌株同源性最高。
辣椒疫霉寄主范围非常广泛,已知寄主多达50 余种作物,包括:辣椒、番茄、茄子等茄科植物,黄瓜、南瓜、西瓜等葫芦科植物,白菜、菜花、胡萝卜等十字花科植物,菜豆、豇豆等豆科植物,以及胡椒、橡胶树、木瓜、可可等热带经济作物,等等[6-8]。目前关于辣椒疫霉致病研究主要集中在辣椒、南瓜等温带瓜菜类作物上,在热带香料作物胡椒上报道极少。而且有研究表明,分离自胡椒上的辣椒疫霉菌在遗传学系统发育树上与温带茄科、葫芦科等作物上的辣椒疫霉菌分属不同的分类亚群[9]。海南岛地处独特的热带岛屿环境,其病原菌普遍存在地域特异性。分析卵菌杀菌剂对胡椒瘟病菌的室内毒力,对认识和针对性地防控海南岛辣椒疫霉病害具有指导意义。
本研究采用生物形态鉴定和分子鉴定相结合方法,对我国胡椒主产区海南省万宁市兴隆镇和南桥镇的胡椒瘟病样本进行分离鉴定,并分析我国当前在农作物疫病上登记使用的20 种卵菌杀菌剂原药对胡椒瘟病菌的室内毒力,以期明确当前主产区胡椒瘟病病原菌种类及其药剂敏感性,为胡椒生产上杀菌剂针对性使用奠定基础。
1.1 供试材料
1.1.1 病原菌培养基 马铃薯葡萄糖琼脂(PDA)培养基[10]:马铃薯200g 洗净切成边长约1cm 的方块,放入1000mL 去离子水中煮沸15min,双层纱布过滤,滤液中加入葡萄糖和琼脂粉各20g,溶解后用去离子水定容至1000mL,分装至三角瓶中,50mL/瓶,封口后用121℃高压蒸汽灭菌20min,于4℃保存。
10%V8 蔬菜汁(V8)培养基[11]:离心去渣的V8蔬菜汁100mL、CaCO31g、琼脂粉20g,用去离子水定容至1000mL,121℃灭菌20min,于4℃保存。
1.1.2 卵菌杀菌剂原药 在中国农药信息网(http://www.chinapesticide.org.cn)查询当前农作物卵菌病害上登记使用的农药种类并统计其有效成分,购置分析纯或更高纯度的原药20 种,药剂名称及CAS 号见表1。按说明书进行保藏和使用。
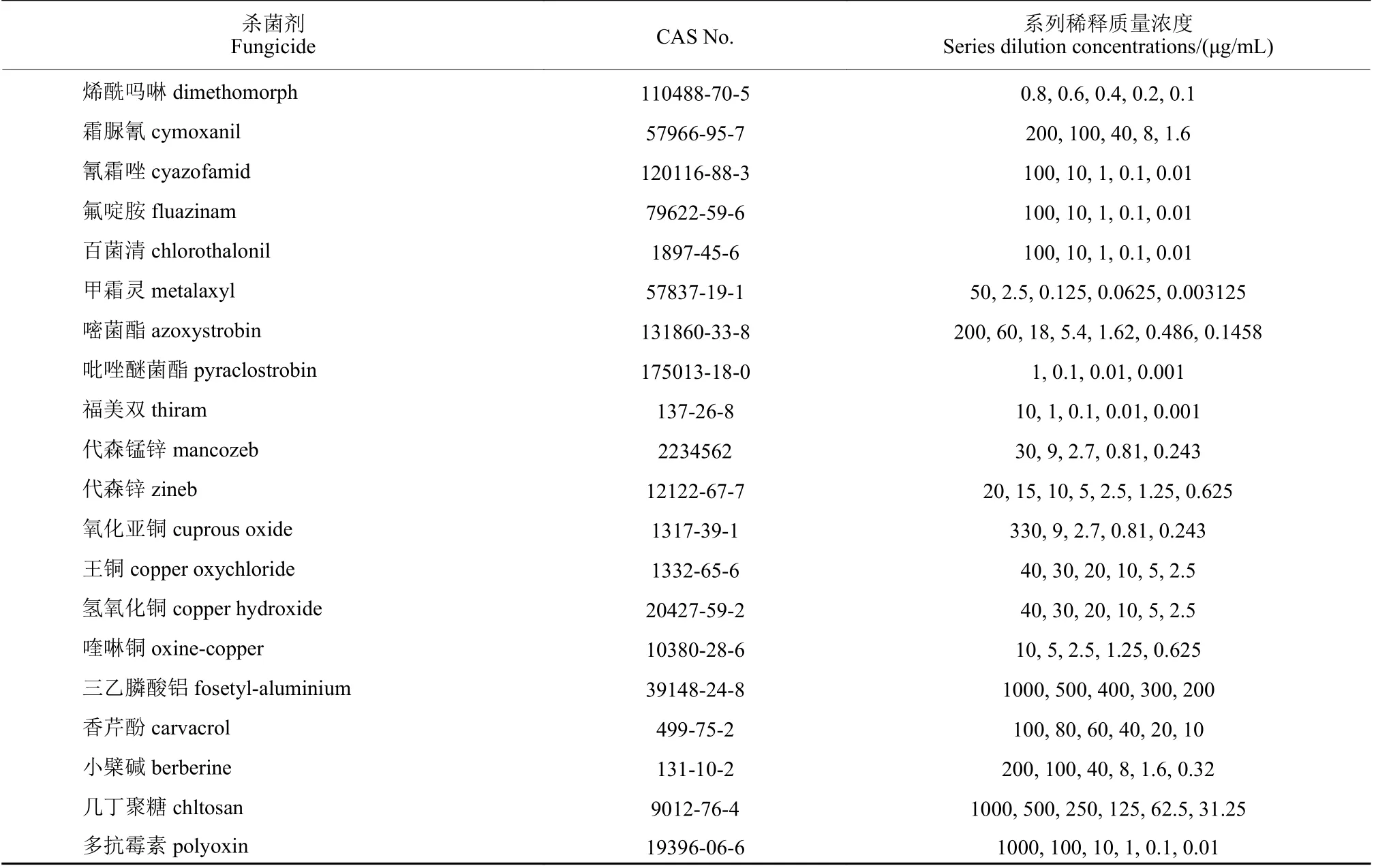
表1 供试卵菌杀菌剂及系列稀释质量浓度Table 1 Series dilution concentrations of the fungicides tested in this study
1.2 研究方法
1.2.1 胡椒瘟病菌的分离纯化 分离纯化:胡椒瘟病感病叶片样本采集自海南省万宁市兴隆镇(18°44′0″N;110°11′40″E)和南桥镇(18°41′43″N;110°10′26″E)。在超净工作台中剪取病斑病健交界处放入75% 酒精中浸泡30s,用无菌水清洗3 次,晾干后剪成边长约0.5cm 的小块,放置在PDA 平板上,26℃恒温培养24h;从长出的菌落边缘挑取菌丝块转接至新PDA 平板上并继续培养24h,重复转接纯化3 次。
回接验证:用无菌打孔器将纯化好的菌落打成直径约0.5cm 的菌丝块。在离体胡椒叶片中央用无菌大头针刺3 个小孔,并将菌丝块覆盖在针孔上,菌丝面与叶片接触,26℃恒温培养72h 后观察发病情况。
菌种保存:将通过验证的病原菌转接至PDA 试管斜面,14℃恒温保存。
1.2.2 病原菌形态学观察 将活化好的胡椒瘟病菌接种至V8 培养基上,用锡纸包裹避光,26℃黑暗培养5 d。于超净工作台中用无菌玻璃棒轻轻抹压,使气生菌丝贴附在培养基表面,在26 ℃、5000 lx 恒温光照条件下培养36 h,诱导孢子囊形成。向平板中加入10 mL 无菌水,先于4 ℃冷藏1 h,再于30 ℃恒温放置30 min,促使游动孢子释放。吸取孢子悬浮液,制作临时装片,用光学显微镜观察游动孢子[10-11]。
1.2.3 病原菌系统发育分析 提取病原菌DNA并采用核糖体DNA 的ITS扩增通用引物(ITS1 和ITS4)进行PCR 扩增。扩增产物委托上海生工生物工程有限公司测序。以GenBank下载的已鉴定菌株序列为参考,通过CLUSTALX2.1软件进行序列两两多重比较分析,通过MEGA7软件采用Neighbor-joining计算方法构建系统发育树,并用Bootstrap(1000 次重复)检验聚类分支自举支持率[12]。
1.2.4 供试卵菌杀菌剂对胡椒瘟病菌的室内活性分析 采用菌丝生长速率法[13]测定供试20 种卵菌杀菌剂原药对胡椒瘟病菌的室内毒力。在无菌条件下,用二甲基亚砜将供试药剂溶解,稀释成系列质量浓度的药液供试。药液的每一步操作均须在涡旋20s 后立即用移液枪吸取添加。将50mLPDA 培养基融化后冷却至50 ℃左右,加入药液混匀后等量倒入3 个直径9 cm 的平板中,制成系列质量浓度的PDA 含药平板,浓度梯度见表1。用无菌打孔器将培养5 d 的菌落打成直径约0.5 cm的菌丝块,菌丝面朝下接种至PDA 平板中央,于26 ℃下培养5 d,用十字交叉法测量菌落直径。以不含药PDA 平板为对照,每处理3 个重复。按公式 (1) 计算各浓度杀菌剂对胡椒瘟病菌菌丝生长的抑制率。
式中:I为菌丝生长抑制率,%;D0为对照菌落直径,cm;Dt为处理菌落直径,cm。
1.3 数据处理
通过IBM SPSS statistics 22 软件采用Probit 回归模型分析抑菌率与药剂浓度 (以10 为底的对数)的线性关系,计算毒力回归方程并进行皮尔逊拟合优度卡方检验,同时计算出EC50值及其95%置信区间 (confidence interval, CI)[14]。
2 结果与分析
2.1 病原菌形态学观察
将从田间样本分离的7 个菌株回接至胡椒叶片,发现3 株可引起胡椒瘟病典型症状,叶斑黑色,近圆形,直径约1.5~3.5 cm,边缘不光滑、有布料线头状毛边 (图1A、1B)。3 个菌株的菌落形态十分相似,均在PDA 培养基上产生带有放射状纹理的圆形菌落,气生菌丝较短、白色 (图1C)。在光学显微镜下,3 株病原菌的形态也无明显差异,均能在V8 培养基上诱导产生洋梨形孢子囊,并释放出圆形游动孢子;但是不同培养批次的孢子囊的长宽比存在差异 (图1D、1E)。其菌落和微观形态与前人报道的中国温带地区的辣椒疫霉P.capsici一致[1,5];但是不同于印度尼西亚的胡椒瘟病菌[2]。

图1 胡椒瘟病症状及其病原菌形态Fig.1 Disease symptom and pathogen morphology of black pepper foot rot disease
2.2 病原菌系统发育分析
对3 株病原菌的ITS 测序结果比对分析,发现3 个菌株的ITS 片段序列片完全一致,择一上传至GenBank,登录号为OQ608808。通过BLAST 比对分析,发现其ITS 基因序列与辣椒疫霉的同源性为100%。从GenBank 下载3 株辣椒疫霉和9 种其他疫霉菌的ITS 序列:P.capsica(MH842159.1、KY575676.1、MT678677.1)、P.c i t r o p h t h o r a(K U 9 3 4 2 1 0.1)、P.m e a d i i(JX155793.1)、P.megasperma(KJ405942.1)、P.sojae(AY590272.1)、P.palmivora(JX155791.1)、P.cactorum(KM085441.1)、P.parasitica(GU111674.1)、P.i n f e s t a n s(G U 2 5 8 1 5 1.1)、P.h e v e a e(EU045747.1)。以烟草霜霉菌 (Peronosporatabacina,DQ067899.1) 为外群构建系统发育树,发现本研究菌株与分离自国内外的3 株辣椒疫霉菌聚类在同一分支,自举支持率为100%。结合形态学观察结果,判定本研究从胡椒上分离的菌株为辣椒疫霉(图2)。
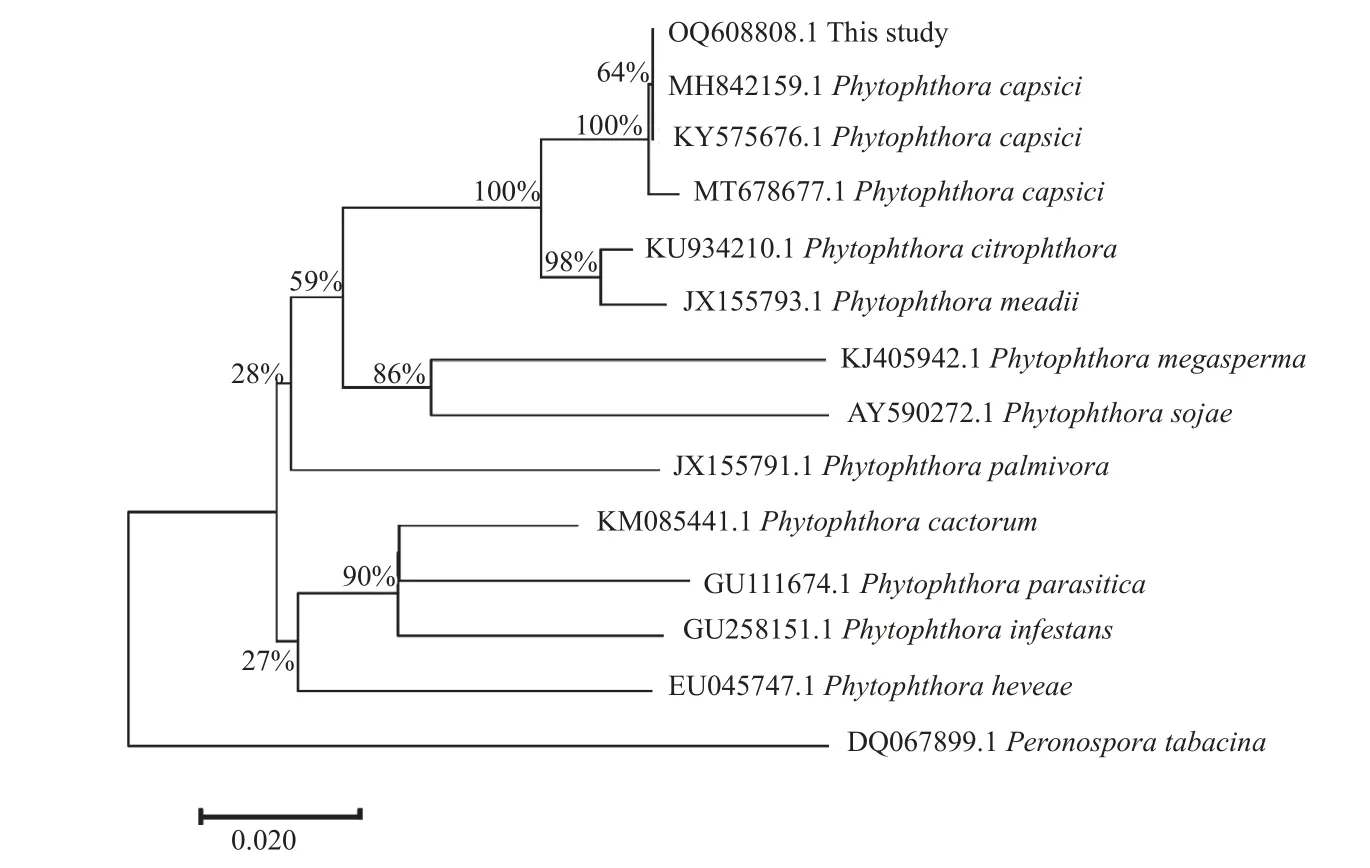
图2 基于rDNA-ITS 序列构建辣椒疫霉菌系统发育树Fig.2 Phylogenetic tree of Phytophthora capsica based on rDNA-ITS sequences
2.3 供试卵菌杀菌剂对胡椒瘟病菌的室内杀菌活性分析
通过菌丝生长速率法计算出20 种供试卵菌杀菌剂对胡椒瘟病菌的毒力回归方程和EC50值 (表2),其中多抗霉素因抑菌很差未进行毒力分析。通过皮尔逊卡方检验零假设模型分析发现,显著性Sig 值均大于0.150,说明毒力回归模型对数据的拟合度较好。按EC50值升序排列,吡唑醚菌酯、氟啶胺、福美双、烯酰吗啉、氰霜唑、甲霜灵等6 种药剂的EC50< 1 μg/mL,抑制菌丝生长效果最好;喹啉铜、百菌清、代森锰锌、代森锌、氢氧化铜等6 种药剂的EC50值处于1~10 μg/mL 之间,抑菌效果较好;氧化亚铜、王铜、嘧菌酯、香芹酚、霜脲氰、小檗碱等6 种药剂的EC50值处于10~50 μg/mL 之间,抑菌效果一般;几丁聚糖、三乙膦酸铝的EC50> 300 μg/mL,抑菌效果较差。
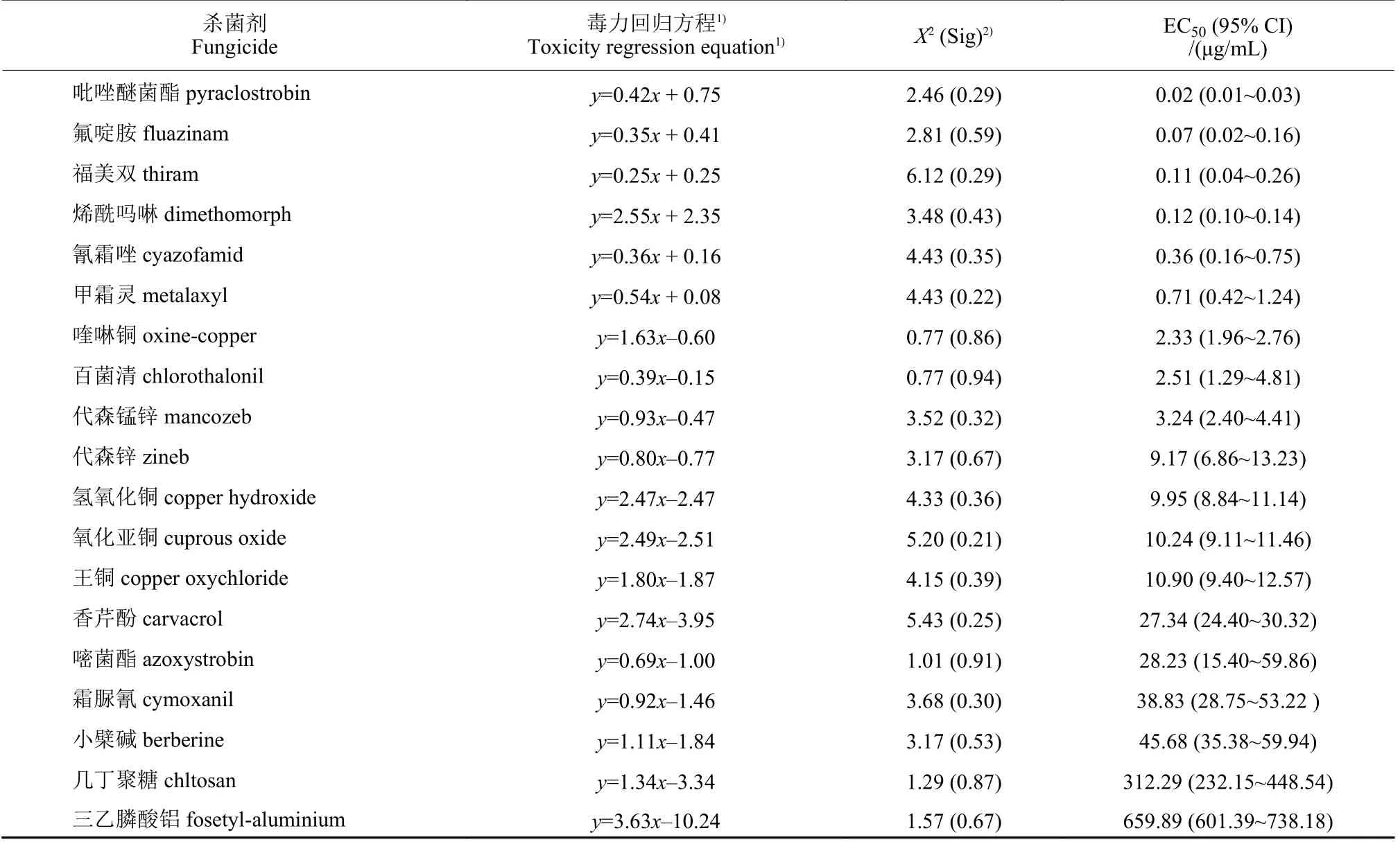
表2 供试20 种卵菌杀菌剂对胡椒瘟病菌的杀菌活性Table 2 Inhibitory activity of 20 oomycete fungicides against P.capsici causing black pepper foot rot disease
3 结论与讨论
本研究将海南万宁胡椒主产区的胡椒瘟病病原菌鉴定为辣椒疫霉P.capsici,发现菌落及孢子囊等形态特征受菌株特异性和环境因素影响较大,仅能作为物种判定的参考[15],ITS 序列等分子鉴定手段更容易区分形态相近的辣椒疫霉、棕榈疫霉及寄生疫霉[1,5]。同时评价了20 种我国当前在农作物疫病上登记使用的卵菌杀菌剂原药对胡椒瘟病菌菌丝生长的抑制效果,发现吡唑醚菌酯、氟啶胺、福美双、烯酰吗啉、氰霜唑及甲霜灵的室内毒力最高,其中吡唑醚菌酯、甲霜灵和嘧菌酯等药剂的抑菌结果不同于其对温带辣椒疫霉上的报道[13,16-18],推测与海南岛胡椒瘟病菌的地域特异性有关。
本研究中,胡椒瘟病菌在PDA 平板上的菌落纹理为放射状 (图1C),与桑利伟等[5]报道的胡椒瘟病菌一致,但不同于Muller[2]报道的印度尼西亚胡椒瘟病菌,有着与棕榈疫霉一致的玫瑰花瓣状纹理。Truong 等[15]将越南全境的204 株胡椒瘟病菌鉴定为辣椒疫霉,但是发现其在PDA 上的菌落纹理存在放射状、玫瑰花瓣状、棉绒状等众多形态,因此推测胡椒瘟病菌的菌落纹理可能存在地域性差异。此外,本研究还发现,同一株胡椒瘟病菌不同观察批次孢子囊的长宽比差别很大,孢子囊形状有时较为狭长、有时略显粗短 (图1D、1E),推测显微视野中的孢子囊长宽比可能与其生长状态或观察角度有关。由此推测,张开明等[4]以孢子囊长宽比为主要参考依据,将胡椒瘟病菌鉴定分为辣椒疫霉和寄生疫霉两类,可能不够精准。通过ITS 序列分析,本研究中的胡椒瘟病菌与国内外辣椒疫霉菌聚类到同一分支,自举支持率达100%,这与桑利伟等[5]和Truong 等[15]的报道一致,说明形态学结合ITS 序列,能够有效区分胡椒瘟病菌与棕榈疫霉、寄生疫霉等形态相近的病原菌。
嘧菌酯在国际杀菌剂市场中占据巨大份额,何烈干等[13]发现,江西省58 株番茄绵疫病菌P.capsici对嘧菌酯 (96%纯度,先正达 (苏州) 作物保护有限公司) 的EC50值介于0.1867~1.6239 μg/mL之间,抗药性风险中等;但在本研究中,嘧菌酯(98%纯度,上海源叶生物科技有限公司) 对海南胡椒瘟病的EC50值高达28.23 μg/mL;而同属于甲氧基丙烯酸酯类杀菌剂的吡唑醚菌酯的抑菌活性最高,EC50值仅为0.02 μg/mL,甚至低于烯酰吗啉 (0.12 μg/mL)。不同于孙平平等[16]、苗建强等[17]报道的烯酰吗啉对温带辣椒疫霉菌丝抑制活性比吡唑醚菌酯高10 倍左右。而氟啶胺在本研究中的抑菌活性 (EC50值为0.07 μg/mL) 高于氰霜唑(EC50值为0.36 μg/mL),与杨叔青等[18]报道的氟啶胺对温带辣椒疫霉的测定结果一致,并未表现出地域性差异。
甲霜灵是当前防控辣椒疫霉病害的主要农药之一,其抗药性问题一直是研究的热点之一。王艺烨[19]在辽宁、甘肃、内蒙古等地发现了8 株辣椒疫霉抗药性菌株;戚仁德等[20]发现,安徽省16 个市 (县) 的125 株辣椒疫霉中敏感菌株、中间菌株和抗性菌株分别占总体的63.2%、30.4%和6.4%,其中最高抗性倍数达90 倍;但是本研究中的3 株辣椒疫霉均是敏感菌株,推测与万宁地区甲霜灵农药使用较少有关。
烯酰吗啉在辣椒疫霉病害防控上广受关注,在本研究中,其对胡椒瘟病菌的EC50值为0.12 μg/mL,该数值与国内外各地辣椒疫霉上的检测结果一致,比如:张世才等[21]检测了重庆地区的102 株辣椒疫霉菌,崔晓岚等[22]检测了125 株分别采自河北、内蒙古、陕西、安徽和北京等地区的辣椒疫霉病菌,马辉刚等[23]调研了江西各地区的辣椒疫霉菌对烯酰吗啉的敏感性,均未发现抗药性亚群体;Jackson 等[24]报道,美国乔治亚州的甜椒和葫芦上辣椒疫霉对烯酰吗啉均具有良好的敏感性,表明烯酰吗啉在辣椒疫霉防控具有地域普适的应用潜力。
一百多年来,铜制剂一直是防控植物疫病的重要药剂,在本研究中喹啉铜、氢氧化铜、氧化亚铜、王铜等铜制剂的EC50值在2.33~10.90 μg/mL之间,对胡椒瘟病菌具有较好的抑制活性。虽然,Torre 等[25]报道,大量使用铜制剂可能影响植物新陈代谢和营养吸收,但是通过与其他药剂复配或轮换使用,可以提高防治效果和大幅降低铜制剂使用量[26],其应用前景依然十分广阔。
植物源农药香芹酚和小檗碱被广泛应用于人类及动物医学上。在农业上,魏敏等[27]发现,使用5%香芹酚水剂在2250 mL/hm2剂量下喷雾,其对马铃薯晚疫病的防效可达83.13%;李宝燕等[28]发现,0.5%小檗碱水剂对葡萄霜霉病菌的EC50值为11.85 μg/mL,以有效成分25 μg/mL 的质量浓度喷雾施用,其田间防效达80%以上。在本研究中,两种药剂的EC50值分别为27.34 和45.68 μg/mL,综合其绿色环保特点,依然具有较好的应用潜力。
几丁聚糖通常作为诱抗剂被大众认知,但其直接抑菌效果也常见报道。贾瑞秀等[29]发现,壳聚糖能够诱导镰孢菌细胞壁中几丁质的酶活,增加细胞膜的通透性,达到抑制菌丝生长效果。本研究结果也表明,几丁聚糖具有一定的抑制辣椒疫霉菌丝生长作用 (EC50值为312.29 μg/mL),其作用机制尚待进一步研究。
但是,三乙膦酸铝——当前我国唯一登记防控胡椒瘟病的药剂,其EC50值高达659.89 μg/mL。尹敬芳等[30]也发现,三乙膦酸铝对辣椒疫霉菌菌丝生长、孢子囊形成、休止孢萌发和孢子囊直接萌发等4 个发育阶段的抑制效果均较弱。同样,多抗霉素是已被多次登记为防控黄瓜霜霉病Pseudopeonospora cubensis、马铃薯和番茄晚疫病P.infestans的药剂,但是在本研究中未检测到其对胡椒瘟病菌有抑制效果。需要注意的是,本研究仅分析了供试药剂对胡椒瘟病菌菌丝生长的抑制活性,评价杀菌剂效果时还需综合考虑其他众多因素,比如对病原菌产孢、孢子萌发等方面的效果,以及药剂的内吸性、传导性等理化性质,等等。此外,还需考虑农药使用限制,比如,福美双、代森锰锌、百菌清等杀菌剂已经逐步在欧盟等国家和地区被限制使用。

