谷朊抗冻多肽对面团冷冻保护作用研究
张艳艳, 郭朋磊, 王文涛, 许铭强, 张斯琦,张 华
(郑州轻工业大学食品与生物工程学院,食品生产与安全河南省协同创新中心,河南省冷链食品质量安全控制重点实验室1,郑州 450002)
(新疆农科院农产品贮藏加工研究所2,乌鲁木齐 830091)
面团是以面筋蛋白网络为骨架,与其他组分相互作用形成的一个复杂体系[1]。面筋蛋白分为麦醇溶蛋白和麦谷蛋白,其中,麦醇溶蛋白赋予面筋黏性,麦谷蛋白赋予面筋抗延伸性,二者是影响面团流变特性和烘焙品质的主要因素[2]。因此,面筋蛋白网络结构的变化直接决定着面团的品质。面团在冷冻过程中冰晶不断生长,对面筋蛋白造成机械伤害,破坏了面筋蛋白分子间的相互作用力,使面筋蛋白分子结构发生改变,网络结构被破坏,从而降低了面团的加工性能[3,4]。
控制冷冻过程中冰晶的生长和重结晶从而减缓冷冻过程对面筋蛋白网络结构的破坏是改善面团品质的关键,而添加适量的冷冻保护剂来提高面筋蛋白的抗冻性是一种切实有效的方法[5]。抗冻多肽因具有抑制冰晶生长和重结晶而保持冷冻产品品质的特点而受到广泛关注,然而抗冻多肽的活性表达并不是整体蛋白质都在起作用,而只是与局部的特异性多肽链结构域有关[6-8]。因此通过酶解食源性蛋白,制备出活性明确的抗冻多肽成为新兴研究热点。
研究表明,采用碱性蛋白酶对谷朊蛋白酶解90 min得到的酶解产物具有显著的抗冻活性和抑制冰重结晶的能力,且对冷冻面团的发酵特性和对酵母细胞具有良好的低温保护作用,故将此种酶解产物命名为谷朊抗冻多肽[9]。为了系统地揭示谷朊抗冻多肽对冷冻面团和面筋蛋白的低温保护机制,研究采用旋转流动仪、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)和原位拉曼光谱仪等分析手段,从流变特性、分子质量分布和蛋白结构的角度,探究谷朊抗冻多肽添加量对面团和面筋蛋白在恒温冻藏和变温冻藏的环境中各个组分的变化,系统地阐述谷朊抗冻多肽对面团和面筋蛋白的低温保护机制,为其在冷冻面制品的应用提参考。
1 材料与方法
1.1 材料与试剂
谷朊粉(蛋白质质量分数85.1 g/100 g)、小麦精制粉、Alcalase蛋白酶(酶活为3.9×105U/mL,经福林法测得)、三羟甲基氨基甲烷(Tris)、甘氨酸(Gly)、十二烷基硫酸钠(SDS)、β-巯基乙醇、丙三醇(甘油)、考马斯亮蓝R250、考马斯亮蓝G250、二硫苏糖醇(DTT),其他化学试剂均为分析纯。
1.2 仪器与设备
HA-3480AS型和面机,Discovery HR-1型旋转流动仪,BWS456-785S型i-Raman plus,Mini-protean型小垂直板电泳槽,Power Pac型电泳仪电源,Chemi Doc XRS+型凝胶成像仪。
1.3 实验方法
1.3.1 谷朊抗冻多肽的制备
参考Zhang等[10,11]的方法,配制质量分数为5%的谷朊蛋白悬浮液0.5 L,恒温搅拌5 min,同时用1 mol/L的NaOH溶液调节其pH至8.5;加入6 080 U/g的Alcalase蛋白酶,采用1 mol/L的NaOH溶液维持酶解体系pH为8.5;在酶解90 min时,将酶解液沸水浴10 min灭酶,冷却后调节pH至7.0,于4 ℃、8 000 r/min条件下离心10 min除去沉淀;将所得上清液在4 ℃去离子水中透析除盐(透析时间24 h)后冷冻干燥,即得谷朊抗冻多肽粉末。
1.3.2 冷冻面团的制备
参考王沛[12]的方法,取240 g小麦粉,按质量分数计,加入1%酵母、1%食盐,谷朊抗冻多肽(0.1%、0.5%、1.0%和1.5%)和45%水(均以小麦粉质量计),和面10 min。和好的面团在30 ℃下平衡5 min,分别进行恒温冷藏(-18 ℃下28 d)和反复冻融(8次)处理。一次冻融循环包括在-18 ℃下23 h的冷冻过程和1 h的解冻过程;冻藏面团也需在测试前解冻1 h。面团解冻均在25 ℃、80%湿度的恒温恒湿箱中进行,未添加谷朊抗冻多肽的面团为对照样品。
1.3.3 面筋蛋白的制备
参考王沛[12]的方法,略有修改。取300 g小麦粉,加入质量分数45%去离子水,和面10 min形成面团。面团静置20 min形成稳定的面筋网络结构后,在2 L去离子水中洗涤,洗涤过程中更换去离子水,直至洗涤后的去离子水不再浑浊,收集湿面筋蛋白,冷冻干燥、粉碎成粉末状并过100目筛[13]。取1 g面筋蛋白粉末与1.5 mL去离子水在平底塑料圆盒中混合,用玻璃棒揉和成比较均匀的湿面筋蛋白(对照组)。添加质量分数分别为0.1%、0.5%、1.0%和1.5%的谷朊抗冻多肽,在4 ℃环境中静置1 h平衡水分、稳定结构,然后转至-18 ℃冰箱中冻藏处理(恒温冷藏28 d和反复冻融8次)。其中,一次冻融循环为-18 ℃下冷冻23 h,25 ℃和80%相对湿度下解冻1 h。恒温冷藏处理的样品在测试前解冻,解冻条件同冻融处理中的解冻条件。解冻后的样品进行冷冻干燥、研磨并过100目筛,待测。
1.3.4 动态流变特性的测定
参考Zhang等[14]的方法,略有修改。实验参数为平板直径20 mm,平板间距1.00 mm,应变0.5%,温度25 ℃,频率为0.1~40.0 Hz。
1.3.5 分子质量分布的测定
参考Wang等[15]的方法,采用质量浓度为4g/100 mL浓缩胶和12 g/100 mL的分离胶对面筋蛋白进行分析。取5 mg蛋白样品置于1.5 mL微量离心管中,加入1 mL样品提取液(非还原性提取液质量浓度:0.1 mol/L Tris-HCl、pH 6.8,含质量浓度2 g/100 mL SDS、10 g/100 mL甘油和0.01 g/100 mL溴酚蓝;还原性提取液还含质量浓度5 g/100 mL β-巯基乙醇)。室温萃取3 h后离心(10 000 r/min、4 ℃、10 min),上清液沸水浴5 min、冷却后上样。上样量为10 μL,80 V电泳30 min,120 V稳压电泳直至溴酚蓝指示剂迁移至胶底时停止电泳。取出凝胶,用R250染色液染色1 h后,脱色数次,直至谱带清晰,照相分析。
1.3.6 拉曼光谱采集
取一定量的面筋蛋白粉末置于i-Ramanplus光纤探头下,采集参数:拉曼位移范围为400~2 000 cm-1;分辨率为3 cm-1;激发波长为785 nm;积分时间为10 s;激光功率为150 mW。蛋白质结构的分析参考皮俊翔[16]的方法。
1.3.7 数据分析与处理
用Microsoft Excel 2016对实验数据进行整理分析,用Origin 2018对数据进行作图。通过SPSS 16.0软件进行显著性分析(P<0.05)。每个实验均重复3次,取平均值,结果表示为平均值±标准差。
2 结果与讨论
2.1 谷朊抗冻多肽对冷冻面团流变特性的影响
图1显示了分别在反复冻融和恒温冷藏处理下面团的流变特性(G′和G″),所有面团的G′远远大于G″,这说明所有面团样品的弹性都大于黏性,表现出典型的黏弹性和类固体行为,主要发生弹性形变[17,18]。此外,面团的模量值对频率具有依赖性,随着频率的增大,面团的G′和G″均提高,表明在频率扫描中面团分子间产生了强烈的交联作用[19]。在给定频率下,面团的G′和G″均随着谷朊抗冻多肽添加量的增加而逐渐下降,这是由于冰晶生长和重结晶导致面团中的面筋蛋白发生解聚,从而引起面团的网络结构遭到破坏[20,21]。其中,质量分数0.1%谷朊抗冻多肽的添加能够减缓冷冻处理对面团流变特性的破坏;此外,质量分数0.5%的谷朊抗冻多肽质量分数对面团流变特性也具有较好的保护作用。添加谷朊抗冻多肽使面团黏弹性下降的原因是谷朊抗冻多肽的存在降低了面团冷冻过程中的干耗,而高水分含量会引起面团体系更容易发生形变,表现为黏弹性的降低[22]。
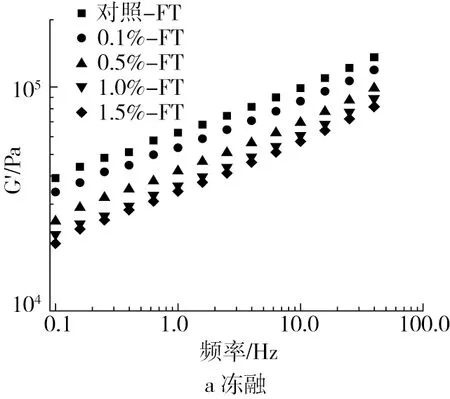
注:G′为弹性模量;G″为黏性模量。对照-FT、0.1%-FT、0.5%-FT、1.0%-FT和1.5%-FT分别指反复冻融处理下含质量分数0.0%、0.1%、0.5%、1.0%和1.5%谷朊抗冻多肽的面团;对照-FS、0.1%-FS、0.5%-FS、1.0%-FS和1.5%-FS分别指恒温冷藏处理下含质量分数0.0%、0.1%、0.5%、1.0%和1.5%谷朊抗冻多肽的面团。
2.2 谷朊抗冻多肽对冷冻面筋蛋白分子质量分布的影响
采用SDS-PAGE测定面筋蛋白的分子质量分布,结果如图2所示。与面筋蛋白的非还原性SDS-PAGE电泳图相比,还原性电泳图中在65~100 ku和40~45 ku范围内明显出现一些条带。根据面筋蛋白中的亚基大小,可知65~100 ku内条带为高分子质量麦谷蛋白亚基(HMW-GS),而40~45 ku内条带为低分子质量麦谷蛋白亚基(LMW-GS),由谷蛋白大分子聚合物(GMP,分子质量较大、处于电泳凝胶顶部)在强还原剂β-巯基乙醇的作用下解聚而成[23]。冻藏处理会破坏面筋蛋白中化学作用力,使蛋白结构舒展、弱化,更容易与SDS结合[10],从而使电泳图中一些条带颜色加深。
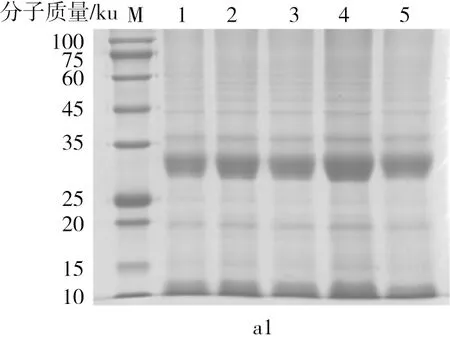
注:a1、a2和a3分别指未冻藏、反复冻融和恒温冷藏处理面筋蛋白的非还原性电泳图;b1、b2和b3分别指未冻藏、反复冻融和恒温冷藏处理面筋蛋白的还原性电泳图;泳道M、1、2、3、4、5分别为maker、未添加和添加质量分数为0.1%、0.5%、1.0%、1.5%谷朊抗冻多肽的面筋蛋白。
在还原性电泳图中,未冷冻的面筋蛋白样品之间没有明显差异,说明不同添加量的谷朊抗冻多肽不会影响面筋蛋白亚基的变化。而在反复冻融处理下,与未添加谷朊抗冻多肽的面筋蛋白相比,添加谷朊抗冻多肽的面筋蛋白中HMW-GS和LMW-GS条带变浅,其中质量分数为0.1%和0.5%时条带最浅,说明谷朊抗冻多肽可以抑制反复冻融过程中GMP的解聚。此外,在恒温冷藏处理下,随着谷朊抗冻多肽添加量的增加,面筋蛋白中LMW-GS条带先变浅后变深,谷朊抗冻多肽质量分数为0.5%时LMW-GS条带最浅,说明谷朊抗冻多肽在此水平下对面筋蛋白的冷冻保护作用最好,可以降低冻藏处理对面筋蛋白结构的破坏。而谷朊抗冻多肽质量分数为1.0%~1.5%时,可能引入了较多的短肽和氨基酸,反而不利于冻藏过程中面筋蛋白的结构[24]。
2.3 谷朊抗冻多肽对冷冻面筋蛋白分子结构的影响
拉曼光谱常用来表征蛋白分子结构的变化,其中500~550 cm-1、760 cm-1与820~860 cm-1和1 600~1 700 cm-1分别表征面筋蛋白中二硫键、色氨酸、酪氨酸以及酰胺Ⅰ带[25]。
2.3.1 二级结构
谷朊抗冻多肽添加量对面筋蛋白的影响结果如图3所示。从图3a可以看出,未冷冻面筋蛋白中二级结构以α-螺旋为主,质量分数为57%。对照组中α-螺旋、β-折叠、β-转角和无规则卷曲的质量分数分别为57.2%、12.7%、10.3%和19.3%。在反复冻融处理后(图3b)的对照组中α-螺旋的质量分数从57.2%下降到55.1%,而无规则卷曲和β-转角相对含量提高;经恒温冷藏处理后(图3c)的对照组中α-螺旋和无规则卷曲相对含量出现一样的变化趋势,β-折叠和β-转角相对含量没有出现明显变化。结果表明,冻藏处理使面筋蛋白的二级结构发生了变化,α-螺旋结构的相对含量下降,蛋白分子结构向β-转角和无规则卷曲转变。这与宋国胜等[26]的报道一致,这种变化主要是由于冻藏过程出现冰晶生长和重结晶,此过程会破坏蛋白分子内维持α-螺旋的氢键,使螺旋结构被破坏,蛋白分子重排以保持相对稳定状态。
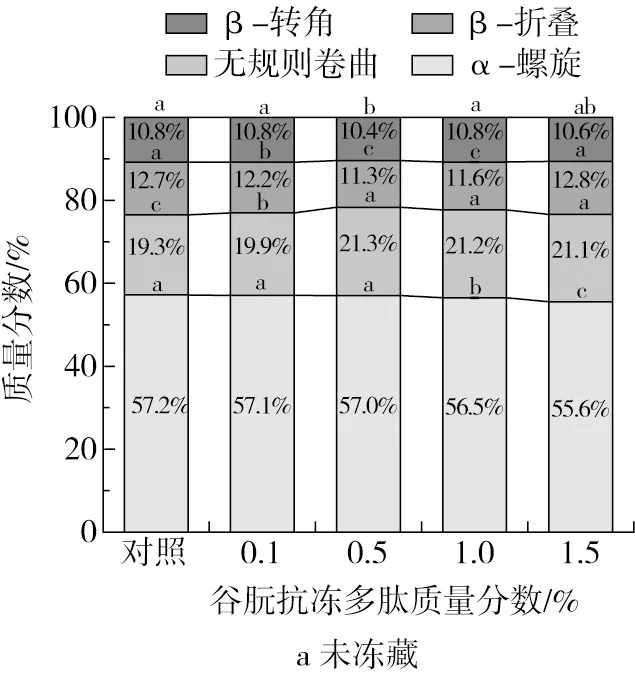
图3 谷朊抗冻多肽对面筋蛋白二级结构的影响
在反复冻融处理样品中,随着谷朊抗冻多肽添加量的增加,面筋蛋白中α-螺旋相对含量均先提高后下降,无规则卷曲相对含量先下降后升高。当质量分数为0.5%时,面筋蛋白中α-螺旋相对含量最高。在恒温冷藏处理样品中,谷朊抗冻多肽添加量对面筋蛋白二级结构的影响也存在相同的变化规律。结果表明,面筋蛋白在冻藏过程中添加一定比例的谷朊抗冻多肽可以抑制冷冻过程中冰晶的生长、降低冷冻对蛋白网络结构的破坏。此外,谷朊抗冻多肽质量分数为0.5%时,其对面筋蛋白的冷冻保护作用最显著,添加量更高反而其冷冻保护作用下降,这可能是因为谷朊抗冻多肽的添加量较高时,引入了较多不利于面筋蛋白结构稳定的短肽和氨基酸[24]。
2.3.2 氨基酸侧链
蛋白拉曼光谱中850 cm-1与830 cm-1附近的特征峰随着微环境变化而改变,两峰的相对强度(I850/I830)反映着酚羟基氢键的相关信息,被广泛用来表征酪氨酸残基的包埋和暴露的程度[27]。当I850/I830>1时,酪氨酸残基趋向于“暴露”态;当I850/I830<1时,酪氨酸残基趋向于“包埋”态。面筋蛋白在冻藏处理后,I850/I830值均有所提高,由“包埋”态趋向于“暴露”态。该结果与李银丽[28]的报道一致,说明冷冻处理破坏了面筋蛋白中的氢键,使面筋蛋白的三级结构受到破坏,酪氨酸残基暴露到蛋白分子的表面。在反复冻融处理下,随着谷朊抗冻多肽添加量的增加,面筋蛋白的I850/I830值先降低后升高,在谷朊抗冻多肽质量分数为0.5%时,I850/I830值最小。此外,恒温冷藏处理下I850/I830出现一样的变化趋势。
拉曼光谱中760 cm-1附近的谱峰归属为色氨酸残基的伸缩振动,峰强度可以反映色氨酸微环境极性的变化。色氨酸残基的暴露表现为I760的降低,而I760的提高则表明色氨酸残基掩埋性的增加[29]。由图4可见,未添加谷朊抗冻多肽的面筋蛋白在冻藏处理后,峰强度I760下降,表明色氨酸残基由相对“包埋”态转变为相对“暴露”态。在反复冻融和恒温冷藏处理下,I760均随谷朊抗冻多肽添加量的增加先提高后降低,质量分数为0.5%时I760值最大。结合酪氨酸残基微环境(I850/I830)的变化结果,表明谷朊抗冻多肽可以抑制冻藏处理对蛋白三级结构的破坏,从而使面筋蛋白拉曼光谱中I850/I830值下降、I760值提高。在质量分数为0.5%时,谷朊抗冻多肽对面筋蛋白的冷冻保护作用最显著。
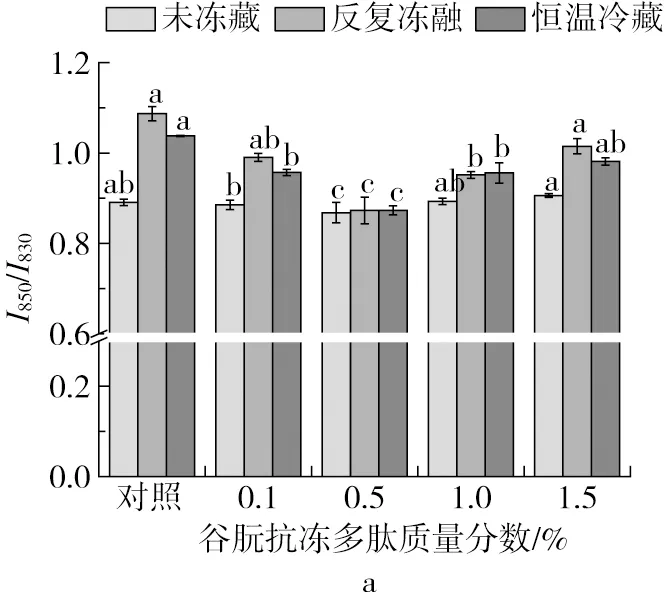
图4 谷朊抗冻多肽对面筋蛋白氨基酸侧链的影响
2.3.3 二硫键构型
面筋蛋白拉曼光谱中500~550 cm-1是二硫键伸缩振动的特征频率,拉曼特征峰的结构可归属为:500~510 cm-1处峰归属为扭式-扭式-扭式(g-g-g)构型,515~525 cm-1处峰归属为扭式-扭式-反式(g-g-t)构型,535~545 cm-1处峰归属为反式-扭式-反式(t-g-t)构型。其中,g-g-g构型是分子内二硫键构型、最稳定,g-g-t构型次之,t-g-t构型是分子间二硫键构型、稳定性最差[25]。
图5a显示了未冷冻面筋蛋白中二硫键构型的相对含量。对照组中二硫键g-g-g、g-g-t和t-g-t构型的质量分数分别为33.4%、40.3%和26.3%。反复冻融处理后(图5b),二硫键g-g-t构型的相对含量下降,而g-g-g和t-g-t构型含量提高。恒温冷藏处理使面筋蛋白中二硫键g-g-g和g-g-t构型含量出现一样的变化趋势,t-g-t构型含量没有明显变化(图5c)。这表明冻藏处理破坏了面筋蛋白分子内二硫键,导致面筋蛋白中二硫键g-g-g构型相对含量的下降。从图5b和图5c可以看出,添加一定比例(质量分数0.1%和0.5%)的谷朊抗冻多肽可以抑制反复冻融和恒温冷藏处理对面筋蛋白中二硫键的破坏,从而维持了面筋蛋白中二硫键g-g-g构型。这是由于谷朊抗冻多肽具有抗冻活性,抑制了冻藏过程中冰晶的生长和重结晶,降低了冰重结晶对面筋蛋白结构的破坏[30]。
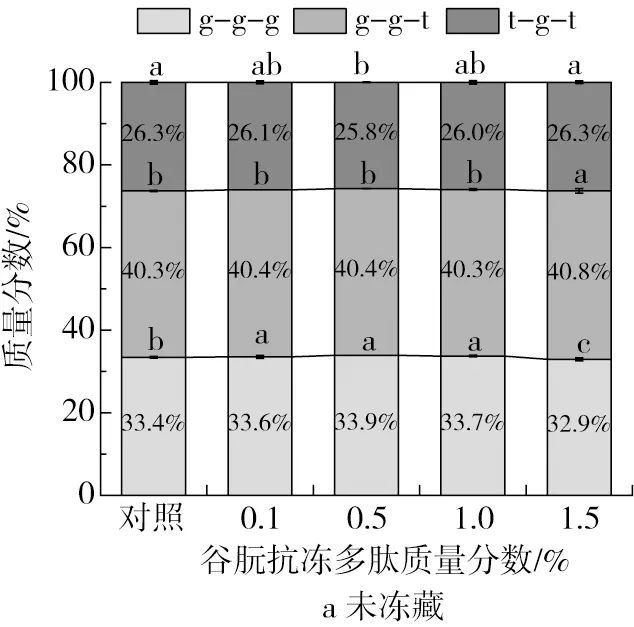
图5 谷朊抗冻多肽对面筋蛋白中二硫键构型的影响
3 结论
系统地阐述了谷朊抗冻多肽对面团和面筋蛋白的冷冻保护机制,流变特性表明经过冷冻处理的面团弹性模量大于黏性模量,当谷朊抗冻多肽质量分数为0.5%时,可以有效地抑制冻藏处理下面团中自由水的形成,在此条件下LMW-GS条带最浅,表明谷朊抗冻多肽在此条件下对面筋蛋白的冷冻保护作用最好。谷朊抗冻多肽的添加有效抑制了冷冻过程中冰晶生长对面团和面筋蛋白网络结构的破坏,保护了面筋网络结构的完整性,维持了面筋蛋白在面团中的骨架作用。

