基于BDNF-SYN 轴探讨功能性电刺激对脑梗死大鼠学习记忆能力及认知能力的作用
胡琪苓,魏艳霞,贾东佩,汪宁,张辉
(1.南阳市中心医院康复医学科,河南 南阳 473000;2.郑州大学附属郑州中心医院,河南 郑州 450000)
脑梗死主要由动脉粥样硬化及高血压小动脉硬化导致,引发血管病变,血液成分改变,病死率约10%~15%,致残率极高且易复发[1]。脑源性神经营养因子(BDNF)是人脑中与空间学习相关的重要物质,神经营养因子中的一种,存在于人的神经系统中,由BDNF 基因合成[2]。突触素(SYN)是一种完整的膜糖蛋白,主要分布于大脑、脊髓、视网膜的突触前小泡,也出现在肾上腺髓质小泡及神经肌肉连接点,参与突触囊泡的形成和胞吐[3]。BDNF-SYN 轴在神经系统的发育、分化及突触可塑性中发挥重要作用[4]。脑梗死目前主要依靠药物进行降压、溶栓治疗,但预后较差,患者常有中枢神经系统异常引起的后遗症[5-6]。功能性电刺激通过低频脉冲电流刺激神经肌肉,同时刺激传入神经,将重复的运动信息传入中枢神经系统,在大脑皮层形成兴奋痕迹,逐渐恢复原有的运动功能,进行功能重建[7-8],但在体内作用机制尚不明确。本研究通过闭塞大脑中动脉构建大鼠脑梗死模型,观察功能性电刺激对脑梗死大鼠学习记忆及认知能力的影响,并初步探讨其调控机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF 级雄性SD 大鼠,60 只,5 周龄,体质量250~350 g,购自山东斯科贝斯生物科技股份有限公司,许可证号SCXK(鲁)2016-0001。
1.1.2 药物、试剂 10%水合氯醛(西安众森医药有限公司)、HE 染色试剂盒(北京索莱宝科技有限公司)、SYBR Green 预混染料,反转录试剂盒(美国Thermo Fisher 公司),兔抗鼠BDNF、SYN 抗体(美国Abcam 公司),ECL 发光试剂盒(美国Biorad 公司),蛋白定量试剂盒(南京诺唯赞生物科技有限公司)。
1.1.3 仪器 LC480 荧光定量PCR 仪(美国Roche公司),电泳系统(上海天能生命科技有限公司),Nano drop 2000 紫外分光光度计(美国Thermo Fisher 公司),化学发光成像仪(美国Bio-rad 公司),脑立体定位仪(美国stoelting 公司),CM1850切片机(日本Lecia 公司),E600 显微镜(日本尼康公司),Morris 水迷宫实验系统(北京众实迪创有限公司)。
1.2 方法
1.2.1 动物分组 60 只大鼠随机分为3 组,每组20只:假手术组(假手术+安慰刺激)[9]、对照组(脑梗死模型+安慰刺激)、电刺激组(脑梗死模型+功能性电刺激)。安慰刺激及功能性电刺激均通过治疗仪将电极置于前肢肌群,但安慰刺激组不连接电流,功能性电刺激组通过一定频率及强度电流刺激肌肉群。
1.2.2 模型制备 各组大鼠适应性喂养一周后,通过大鼠大脑中动脉闭塞法构建大鼠脑梗死模型。对照组、电刺激组大鼠均腹腔注射10%水合氯醛4 mL/Kg,麻醉后颈部备皮消毒,于颈部正中切开,切口长度约3 cm,分离颈部腺体组织后,沿肌肉纹理肌肉及筋膜,分离左颈总动脉(CCA)表面血管组织,暴露CCA,沿CCA 向上分离,于甲状腺水平处找到颈外动脉(ECA)及颈内动脉(ICA),结扎CCA近端及ECA,微动脉夹短暂夹闭ICA 远端,离CCA分叉5 mm 处剪出切口,线栓插入后于切口处稍微结扎,松开动脉夹,线栓缓慢插入ICA,于切口处稍微打结防止滑脱,至有阻力停止,深度约20 mm,线栓至大脑中动脉起始部位,固定线栓后,缝合手术切口,90 min 后拔出线栓。术后大鼠注意保暖,肛温保持37 ℃,连续一周腹腔注射青霉素3 万单位/d。假手术组大鼠麻醉后仅分离血管,不插入线栓,其他操作相同。
手术清醒后,参照Longa 法[10]进行模型制备评分,1~3 分为造模成功,具体评分如下:0 分,无神经损伤症状;1 分,轻微神经损伤,左侧前爪伸展困难;2 分,中度神经功能损伤,中度局灶性病变,向左转圈;3 分,重度局灶性病变,神经功能损伤严重,向左倾倒;4 分,不能自主行走,精神意识严重缺失。
1.2.3 功能性电刺激干预 术后7 d,电刺激组采用治疗仪(Neuro Continence,英国Verity Medical 公司)对大鼠双侧前肢进行电刺激,每日两次,每次10 min,治疗周期21 d。大鼠俯卧固定后,电极分别置于前肢肌群近远端,刺激双侧前肢肌肉收缩,以产生伸腕伸指动作为准。频率100 Hz,脉宽250 μs,强度3~6 mA,电流通断比4 s∶6 s。假手术组、对照组接通相应的电极,不给电流刺激。
1.2.4 改良神经功能缺陷程度评分(mNSS)[11]分别于术后1、7、14、21、28 d 通过各组大鼠mNSS 评分,评估大鼠神经功能损伤情况。mNSS 评分主要包括运动实验、感觉实验、反射丧失和不正常运动、癫病及肌阵挛、肌张力障碍几项内容,总分18分,分数越高,神经功能损伤越严重,具体分级如下:13~18 分为严重损伤;7~12 分为中度损伤;1~6分为轻度损伤。
1.2.5 大鼠水迷宫实验 术后第28 d 开始水迷宫实验评估,前五天(D1、D2、D3、D4、D5)进行定位航行实验,第6 天进行空间探索实验。定位航行实验:每日固定时间点将大鼠分别从4 个象限放入水池,面部面向池体,记录大鼠爬上平台时间即为逃避潜伏期。若120 s 内未找到平台,则逃避潜伏期记为120 s。每日4 次,记平均值为当天测量结果。空间探索实验:第6 天撤去平台,于平台所在象限的对角象限面向池壁放入大鼠,记录2 min 内大鼠穿越平台次数,并分析大鼠在原平台象限所占时间及路程。
1.2.6 脑皮层梗死区病理学改变 行为学实验结束后,处死大鼠取脑组织,部分液氮冻存用于基因及蛋白含量检测,部分用于HE 染色。4%多聚甲醛固定72 h 后,PBS 冲洗干净,梯度酒精脱水,石蜡包埋,连续5 μm 切片。常规苏木精-伊红染色,蒸馏水冲洗,梯度酒精水化,二甲苯脱蜡,中性树胶封片后在显微镜下观察脑皮质梗死区的病理变化。
1.2.7 脑皮层中BDNF、SYN mRNA 表达量检测取大鼠脑组织,匀浆仪研磨后,加入Trizol 提取组织总RNA,电泳鉴定结构后,测量RNA 含量,通过逆转录试剂盒反转成稳定cDNA 结构。实时荧光定量PCR(RT-qPCR)反应体系:SYBR Premix Ex Taq 13 μL,上下游引物各1 μL,cDNA 1.5 μL,ddH2O 8.5 μL;反应条件:95℃预变性8 min;94℃变性45 s,60℃退火30 s,72℃延伸45 s,重复45 个循环。GAPDH 为管家基因,通过2-△△CT法计算BDNF、SYN mRNA 相对表达量,上下游引物序列,见表1。

表1 引物序列
1.2.8 脑皮层中BDNF、SYN 蛋白表达量 取约100 mg 脑组织,加入RIPA 裂解液,液氮研磨后,10 000 r/min 4℃离心15 min,弃去沉淀,取上清。用二喹啉甲酸(BCA)试剂盒测定蛋白含量。配制分离胶与浓缩胶后,取50 μL 蛋白样品等量加入上样缓冲液,98℃水浴3 min,用于蛋白电泳实验。电泳结束后湿转90 min,取PVDF 膜脱脂奶粉封闭2.5 h,加入稀释一抗(1∶8 000)4℃摇床孵育过夜,加入酶标二抗(1∶1 000 稀释),常温摇床孵育2 h,冲洗后加入根据ECL 显色试剂盒加入工作液,放入成像仪中曝光,将BDNF、SYN 与GAPDH 灰度值相比后计算蛋白相对表达量。
1.3 统计学分析 采用SPSS 20.0 统计学软件分析数据,计量资料均以()描述,重复计量资料比较采用重复测量方差分析,两两样本比较采用LSD-t检验;多样本计量资料比较采用单因素方差分析,两两样本比较采用SNK-q 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 各组mNSS 评分比较 与假手术组相比,对照组及电刺激组术后1、7、14、21、28 d mNSS 评分均升高(P<0.05),其中电刺激组术后14、21、28 d mNSS评分低于对照组(P<0.05),见表2。

表2 各组大鼠mNSS 评分比较
2.2 Morris 水迷宫实验评估学习记忆能力 与假手术组相比,对照组、电刺激组逃避潜伏期增加(P<0.05),其中电刺激组逃避潜伏期均低于对照组(P<0.05)。与假手术组相比,对照组、电刺激组原平台象限所占时间及路程降低,穿越平台次数减少,差异均有统计学意义(P<0.05),其中电刺激组原平台象限所占时间及路程、穿越平台次数均高于对照组,差异有统计学意义(P<0.05),见表3-4。

表3 各组大鼠定位航行实验逃避潜伏期比较(s,n=20)
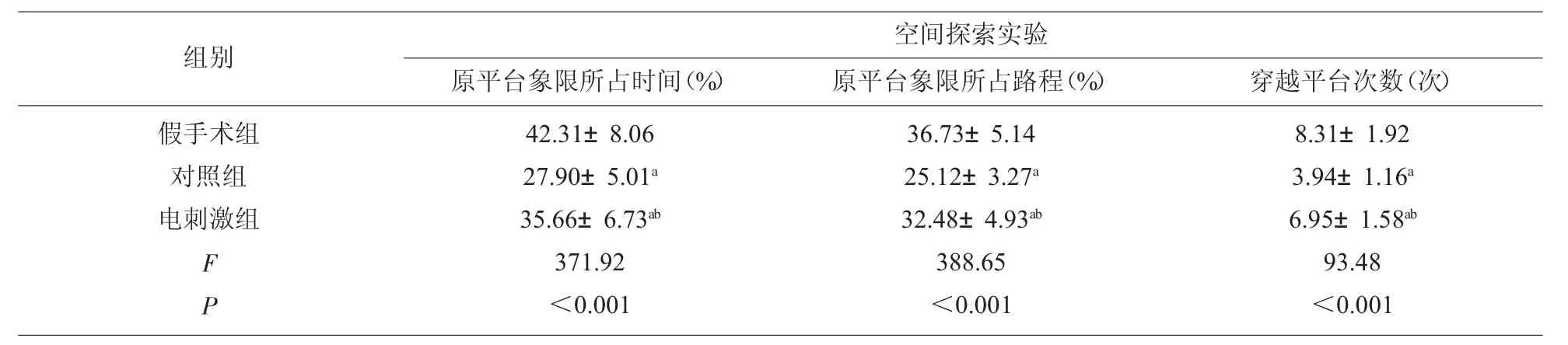
表4 各组大鼠空间探索实验结果比较(n=20)
2.3 脑皮层梗死区病理学改变(HE)假手术组脑组织神经细胞排列规则,结构清晰,形态正常,对照组神经细胞排列疏松紊乱,胞核皱缩溶解,形成深蓝密质块,细胞数量大面积减少,梗死区脑组织着色较浅,色差明显,电刺激组神经细胞部分排列紊乱,梗死面积缩小,部分胞核缩小,相比对照组脑皮质层损伤明显改善。见图1。
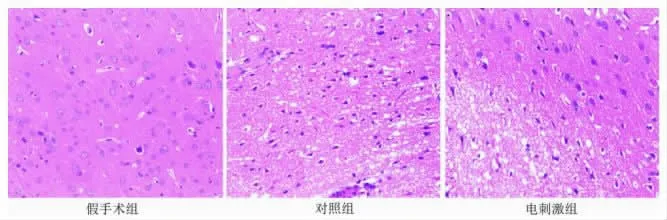
图1 各组大鼠脑皮质层病理学改变(HE×400)
2.4 各组大鼠脑皮层中BDNF、SYN mRNA 相对表达量 与假手术组相比,对照组、电刺激组BDNF、SYN mRNA 相对表达量降低(P<0.05),其中电刺激组BDNF、SYN mRNA 相对表达量高于对照组(P<0.05),见表5。
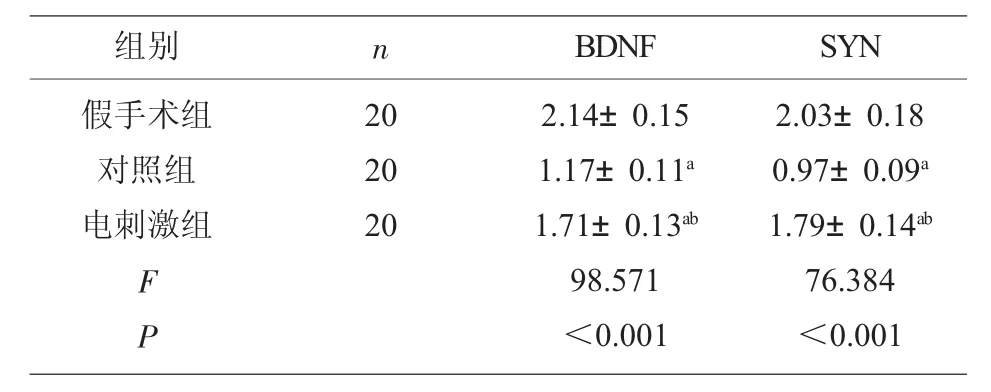
表5 各组大鼠BDNF、SYN mRNA 相对表达量比较
2.5 各组大鼠脑皮层中BDNF、SYN 蛋白相对表达量 与假手术组相比,对照组、电刺激组BDNF、SYN 蛋白相对表达量降低(P<0.05),其中电刺激组BDNF、SYN 蛋白相对表达量高于对照组(P<0.05),见表6、图2。
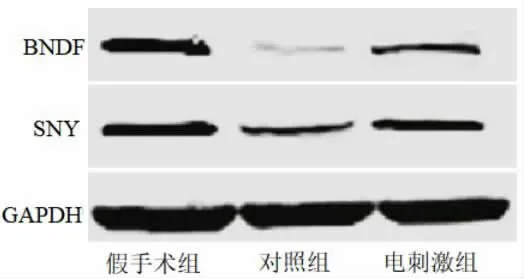
图2 各组Western blot 蛋白条带图

表6 各组大鼠BDNF、SYN 蛋白相对表达量比较
3 讨论
脑梗死临床主要表现为偏身感觉障碍、共济失调、感觉异常等脑功能缺损综合征,研究表明脑梗死大鼠空间辨别能力下降,记忆能力减退并且学习能力退化[12]。BDNF-SYN 轴通过调控轴突及树突的生长及结构,调节中枢神经系统的可塑性及生长发育,从而对大脑的空间认知及学习能力产生重要影响[13]。功能性电刺激常用于运动神经元瘫痪、呼吸功能障碍等疾病,可以诱导肌肉非自主运动,从而恢复肌群运动能力[14]。研究表明[15-16]功能性电刺激可以增强脑卒中神经干细胞分化增殖,提高成纤维生长因子表达,改善大脑损伤,恢复肌肉群运动及平衡能力。目前功能性电刺激在脑梗死大鼠中的作用机制仍不明确,本研究通过探讨BDNF-SYN 轴阐述功能性电刺激修复脑梗死损伤的机制,为进一步阐明功能性电刺激在脑梗死大鼠中的作用机理奠定基础。
本研究发现,对照组及电刺激组术后1、7、14、21、28 d mNSS 评分均比假手术组升高,其中电刺激组14、21、28 d mNSS 评价均低于对照组。这提示造模后大鼠神经功能缺损,感觉迟缓,运动功能失常,功能性电刺激可以缓解神经损伤,改善脑梗死大鼠运动及反射功能。研究表明[17]功能性电刺激可以通过低频电刺激实现肌肉非自主运动,改善卒中后上肢肢运动功能。水迷宫结果显示,与假手术组相比,对照组及电刺激组逃避潜伏期延长、原平台所占时间及路程缩短、穿越平台次数减少,其中电刺激组原平台象限所占时间及路程、穿越平台次数均高于对照组,逃避潜伏期短于对照组,提示大鼠造模后空间认知能力、学习记忆能力均下降,功能性电刺激可能通过增加BDNF、SYN 的表达,在一定程度上恢复脑部损伤,改善脑梗死大鼠行为能力。有报道[18]显示功能性电刺激可以通过调控BDNF-SYN 轴激活钙信号传导,促进突起分化,增强神经元连接及突触传递,从而提高脑部海马区学习记忆能力。病理结果显示对照组神经细胞数量减少,排列杂乱,提示中动脉闭塞引起脑部梗死。电刺激组梗死面积明显减少,损伤明显改善。功能性电刺激可以修复梗死区域,改善细胞结构,减轻病理损伤。有报道[19]显示功能性电刺激可以增加细胞骨架蛋白表达,提高神经元细胞修复功能,促进病理损伤恢复。
本研究中,对照组、电刺激组BDNF、SYN mRNA 及蛋白相对表达量均比假手术组低,其中电刺激组高于对照组,提示功能性电刺激可以上调BDNF 及SYN 表达,增加神经元突触连接,修复梗死损伤。研究表明[20-21],BDNF 可以防止神经元受损,改善神经元病理损伤,在神经元的生长发育、存活、分化中起重要作用,SYN 参与突触囊泡的形成与胞吐,在神经内分泌肿瘤中广泛表达。在血管性痴呆大鼠模型中,功能性电刺激可以通过调节大鼠BDNF 及SYN 表达,诱发快速兴奋性电位,提高神经元重塑功能,促进大脑结构恢复[22]。
综上所述,功能性电刺激可能通过调控BDNF-SYN 轴,逆转神经元损伤,改善受损脑部组织,为脑梗死的治疗提供理论基础和科学依据。

