携带载脂蛋白ε4基因脑出血患者短期预后、预后不良危险因素及其预测效能
黄磊,叶飞,任思颖,伍国锋,王丽琨
1 贵州医科大学临床医学院,贵阳 550004;2 贵州医科大学附属医院急诊神经科
脑出血是由脑实质内血管破裂所导致的一种神经系统疾病,占所有卒中的10%~20%,发病前30 d死亡率超过50%,治疗后期高达70%的患者会遗留不同程度的神经功能障碍[1-2]。脑出血后的脑损伤不仅是血肿机械性压迫引起的大脑功能受损,还包括炎症反应、血肿周围细胞毒性和血脑屏障破坏等继发性损伤,其中免疫炎症反应不仅局限于大脑病灶周围,还会产生全身效应[3]。载脂蛋白E(ApoE)是一种主要由星形胶质细胞产生的蛋白质,是中枢神经系统中的主要脂质转运分子,人体内表达ApoE蛋白的基因有ApoEε2、ApoEε3、ApoEε4 三种异构体[4]。有研究[5]发现,携带ApoEε4 基因的脑出血患者不良预后风险增加。RIPHAGEN 等[6]研究发现,携带ApoEε4 基因的阿尔兹海默症患者炎症反应和血脑屏障通透性破坏重,患者认知功能障碍严重。目前有关ApoEε4 基因与脑出血患者不良预后的关系仍无定论。我们分析了携带载脂蛋白ε4 基因脑出血患者的短期预后、预后不良危险因素及其预测效能。
1 资料与方法
1.1 临床资料 收集2020 年1 月—2022 年5 月在贵州医科大学附属医院住院治疗的脑出血患者175例,均经CT 检查确诊。其中携带ApoEε4(ε2/ε4,ε 3/ε4,ε4/ε4)基因者43 例(ApoEε4 基因组)、未携带ε4(ε3/ε3)基因者132 例(非ApoEε4 基因组)。根据患者出院后第90 天的改良Rankin 量表(mRS)评分[7]将患者分为预后不良组(mRS>3 分)84 例、预后良好组(mRS≤3 分)91 例。预后不良组中,男57 例、女27 例,年龄20~89(60.65 ± 13.43)岁,有高血压史70 例、糖尿病史6 例、高脂血症24 例、吸烟史37例、饮酒史26例,肺部感染59例,消化道出血24例,脑疝13例,出血破入脑室32例,血肿扩大7例,血肿体 积(24.99 ± 18.82)mL, WBC (10.95 ± 5.34)×109/L、NEU (7.81 ± 3.85)×109/L。预后良好组中,男65 例、女26 例,年龄19~89(57.07 ± 12.12)岁,患者有高血压史83 例、糖尿病史11 例、高脂血症30例、吸烟史50 例、饮酒史26例,肺部感染49例、消化道出血14例、脑疝10例、出血破入脑室32例、血肿扩大2 例,血肿体积(20.41 ± 16.48)mL,WBC (8.66 ±2.89)×109/L、NEU(5.93 ± 2.06)×109/L。预后不良组肺部感染、消化道出血病例数,WBC、NEU 水平高于预后良好组(P均<0.05)。两组其他资料比较,P均>0.05。本研究已获得贵州医科大学附属医院医学科学伦理委员会审批(2022论审第22号)。
1.2 ApoE 基因型检测 患者入院后立即留取外周静脉血样本,采用PCR 法检测 ApoE 基因型。具体步骤:①参照说明书通过红细胞裂解液提取样本中白细胞后,对白细胞样本进行吸附、离心等完成DNA(样本)提取;②所有样本数都配制3个反应管,反应液均按每孔9 μL 的量配成反应体系,分装入八联管后,将1 μL 的DNA 模板加入分装的反应体系中,并各取1 μL 质控分别加入到反应体系中,构成两个阳性质控(可选),1 μL ddH2O 与另一反应体系中,构成阴性质控。③将反应管 PCR 放在PCR 仪内,设置相应运行参数,进行扩增。扩增后确定合适的基线和荧光阈值。ApoE 基因的荧光通过VIC 和FAM 予以采集,标准基因荧光通过 ROX 进行采集。每个样本对应3 个孔,通过后一孔 FAM、VIC 通道的Ct 值(每个反应管内的荧光信号到达设定的阈值时所经历的循环数)判断出ApoE基因的基因型。
1.3 统计学方法 采用SPSS26.0统计软件。采用Kolmogorov-Smirnov 检验计量资料是否符合正态性分布,对符合正态分布的计量资料以±s表示,比较采用两独立样本t检验;对非正态分布的计量资料以M(P25,P75)表示,比较采用Mann-WhitneyU检验。计数资料以频次或百分比表示,比较采用χ2检验。利用多因素Logistic回归分析脑出血患者短期不良预后的影响因素,并通过ROC评估ApoEε4基因对脑出血预后的预测效能。P<0.05为差异有统计学意义。
2 结果
2.1 携带载脂蛋白ε4 基因脑出血患者的短期预后、预后不良危险因素 ApoEε4 基因组、非ApoEε4基因组入院时GCS 评分分别为9(4~13)、12(9~14)分,两组比较,Z=-2.27,P=0.023;入院时NIHSS评分分别为17(11~35)、12(6~19) 分,两组比较,Z=-2.736,P=0.006。再根据出院后90 天mRS 评分分为预后良好组和预后不良组,预后不良组携带ApoEε4基因者31(36.9%)例、预后良好组携带ApoEε4 基因者12(13.2%)例,两组比较,χ2=13.258,P<0.01。
以出院90 天不良预后作为因变量,以ApoEε4、肺部感染、消化道出血、WBC、NEU 为自变量,多因素Logistics 回归分析结果显示, ApoEε4 基因、NEU升高是脑出血患者不良预后的独立危险因素(P均<0.01),见表1。
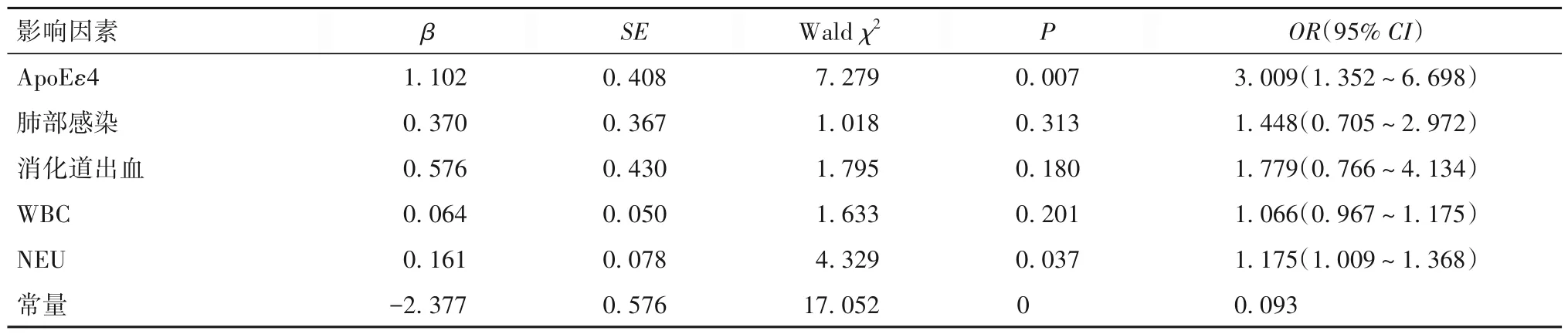
表1 脑出血患者不良预后影响因素的多因素Logistics回归分析结果
2.2 ApoEε4 基因、NEU 水平对脑出血患者短期不良预后的预测效能 ApoEε4 基因预测脑出血短期不良预后的ROC 下面积为0.619(95%CI:0.535~0.702,P=0.007),阳性预测值、阴性预测值、灵敏度、特异度分别为72.1%、59.8%、36.9%、86.8%。NEU 水平预测脑出血短期不良预后的ROC 下 面 积 为0.656(95%CI:0.575~0.737,P<0.001),当NEU 截断值为9.15×109/L 时,灵敏度为30%,特异度为96.7%。ApoEε4、NEU 联合检测对脑出血短期不良预后预测的ROC 下面积为0.724(0.649~0.799,P<0.001)灵敏度为53.6%,特异度为82.4%,见图1。
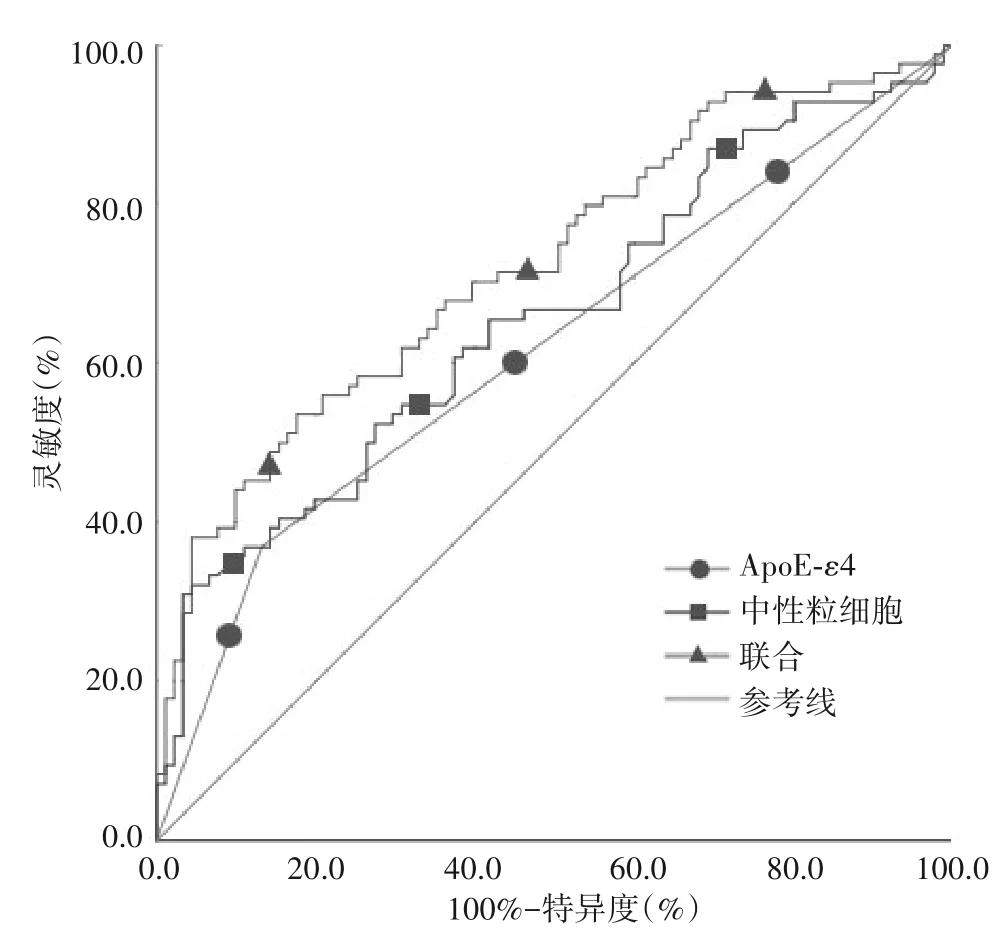
图1 ApoE-ε4和NEU联合检测对脑出血患者短期不良预后预测的ROC
3 讨论
ApoE 基因是阿尔兹海默症患者的遗传风险因素[7-9],但在脑出血中的研究甚少。2006年一项荟萃研究[10]报道,携带ApoEε4基因的脑出血患者临床预后不良。携带ApoEε4基因是路易体病变、帕金森痴呆症、心血管疾病、代谢综合征的危险因素[11-14]。最近也有研究[5]显示携带ApoEε4 基因的脑出血患者不良预后风险增加。本研究结果显示,与非ApoEε4携带组比较,ApoEε4 携带组入院时NIHSS 评分高、GCS评分低,预后不良组携带ApoEε4基因的病例数多于预后良好组,提示ApoEε4 基因可能与脑出血患者的短期不良预后有关。本研究进一步采用Logistics 回归分析对ApoEε4 基因与脑出血患者的短期不良预后的关系进行了探讨,结果显示携带ApoEε4 基因是脑出血患者出院后90 天不良预后的独立危险因素。其病理机制可能是中枢神经系统中,ApoEε4加重血脑屏障通透性分解导致血肿周围脑水肿的发展,进而引起更严重的神经元损伤[15-17];ApoEε4加重脑血管淀粉样变,而淀粉样蛋白相关的脑出血量更大[18]。
目前,仍无研究报道ApoEε4对脑出血不良预后是否有预测效能。本研究通过ROC 曲线评估了ApoEε4对脑出血患者不良预后的预测价值,结果显示ApoEε4 基因预测脑出血患者不良预后的ROC 下面积为0.619,灵敏度、特异度分别为36.9%、86.8%。此外,我们还发现,入院时NEU 升高对脑出血患者不良预后也具有预测价值,与文献[19]研究基本一致。NEU 预测脑出血不良预后的ROC 下面积为0.656,灵敏度、特异度分别为30%、96.7%。本研究结果提示ApoEε4 对脑出血不良预后有预测效能,但单一预测指标的灵敏度欠佳。需联合两种或两种以上指标可提高预测效能[20]。本研究进一步观察了联合ApoEε4 基因及NEU 预测脑出血不良预后的效能,结果显示联合两者预测脑出血短期不良预后的ROC 曲线下面积为0.724,灵敏度、特异度分别为53.6%、82.4%,相较于ApoEε4 基因及NEU 单独预测脑出血不良预后,二者联合的预测效能更高。
综上所述, 携带载脂蛋白ε4基因脑出血患者的短期预后差。ApoEε4基因、NEU水平升高是脑出血患者短期不良预后的危险因素。ApoEε4基因对脑出血短期不良预后有一定的预测效能。联合ApoEε4基因和入院时NEU 水平对脑出血患者的预后预测效能更佳。但本研究为单中心回顾性研究,样本量较小,缺乏更长远随访,有关ApoEε4 基因影响脑出血患者预后的确切机制需进一步探讨验证。

