泛癌组织中T-box转录因子19基因水平与患者预后和肿瘤免疫微环境的相关性
何梦婷,刘宏劲,任宏生
1 山东中医药大学第二临床医学院,济南 250001;2 山东第一医科大学附属省立医院东院重症医学科
癌症危害全球人类健康,是导致死亡的首要原因,也是影响生活质量的主要障碍[1]。免疫靶向治疗为癌症新的治疗方法,疗效好、不良作用少[2]。肿瘤免疫微环境(TIME)主要是肿瘤中的免疫成分,包括先天性免疫细胞、适应性免疫细胞、细胞外免疫因子和细胞的表面分子等,与肿瘤的发展、复发和转移密切相关[3],不仅能预测肿瘤患者的预后,也能预测肿瘤免疫治疗效果。免疫浸润细胞与肿瘤之间的相互作用可以影响肿瘤的进展。肿瘤突变负荷(TMB)和微卫星不稳定性(MSI)高的肿瘤对免疫治疗更加敏感,疗效也更佳[4-5]。因此寻找与TIME 相关的肿瘤生物标志物对于肿瘤的预后及治疗具有重要意义。TBX 基因家族包括T、Tbx1、Tbx2、Tbx6 和Tbr1 5 个亚家族,主要参与胚胎和器官发育。研究[6]表明,TBX 基因家族中基因的失调参与了癌症的发生、发展和转移。作为T-box 转录因子基因家族的成员之一,T-box 转录因子19(TBX19)主要在垂体和腹侧间脑表达[7],其突变可造成促肾上腺皮质激素缺乏、肾上腺功能不全[8]。研究[9]表明,TBX19 参与无功能垂体腺瘤(NFPA)的复发,靶向TBX19 治疗可能会阻止NFPA 的再生。NIU 等[10]认为在结直肠癌(COADREAD)和肝细胞癌(LIHC)中,TBX19 可作为致癌基因促进肿瘤的发展。泛癌分析即利用数据库数据实现跨肿瘤类型的综合分析,旨在确定特定基因在不同癌症类型之间表观和机制的相似性和差异性。近年,随着癌症基因组图谱(TCGA)等公共数据库的发展和一些在线数据库的建立,涌现了大量可用于肿瘤分析的数据以及整合数据的工具,为泛癌分析提供了支持[11]。虽有文献[10]报道TBX19 在癌症中发挥重要作用,但其在泛癌中的预后价值及其与肿瘤免疫微环境的关系仍有待探讨。本研究利用数据库数据对TBX19 与肿瘤预后及肿瘤免疫微环境之间的关系进行了泛癌分析,观察了TBX19 在不同肿瘤中的表达,分析了其与临床病理特征和预后的关系,以预测TBX19 是否可作为肿瘤预后的潜在生物标志物;并探讨了TBX19 与免疫浸润、免疫检查点、TMB 以及MSI 之间的关系,为TBX19 在肿瘤免疫方向的研究提供新的线索。
1 材料与方法
1.1 数据及其来源 UCSC 数据库(http://xenabrowser.net/)中经统一标准化的TCGA泛癌数据,包括60 499例癌组织样本和10 535例正常组织样本。
1.2 癌组织中TBX19 表达与患者临床病理特征、预后关系的泛癌分析 使用Sanger box 数据分析平台(http://www.sangerbox.com/),在“泛癌分析”模块,分别选择“基因表达差异”、“临床分期与基因表达”、“基因表达预后”,设置基因名称为“TBX19”,选择数据参数变换为“log2(x + 0.001)”,进而观察TBX19 在泛癌组织中的表达变化,分析TBX19 表达与肿瘤患者临床病理特征、预后之间的相关性。
1.3 癌组织中TBX19 相关基因富集分析 通过STRING 网站(http://string-db.org/)获得50 个已实验验证可用于分析的TBX19 结合蛋白。设置基因名称为“TBX19”,生物名称为“Homo sapiens”,主要参数 为:Minimum required interaction score[“Low confidence(0.150)”],Meaning of network edges[“evidence”],Max number of interactors to show[“no more than 50 inter-actors”]和Active interaction sources[experiments]。使 用 GEPIA2(http://gepia2.cancerpku.cn/)的“Similar Gene Detection”模块,基于TCGA 中所有癌组织和癌旁组织的数据,获得前100个与TBX19 相关的靶向基因。利用韦恩网站(http://bioinfogp.cnb.es/tools/venny/)对TBX19 结合蛋白和TBX19 相关的靶向基因进行交叉分析,以去除重复基因。使用 Sanger Box 在线网站的“GO、KEGG 富集分析模块”,联合TBX19 结合蛋白和TBX19 相关的靶向基因进行GO 和 KEGG 路径分析。显著富集参数设置为错误发现率(FDR)和校正P<0.05。
1.4 泛癌组织中TBX19 表达与肿瘤免疫微环境关系分析
1.4.1 癌组织中TBX19 表达与免疫细胞浸润的相关性分析 使用TIMER2.0 网站(http: //timer.cistrome.org)分析TBX19 表达与免疫细胞浸润的相关性,在“Immune”模块,设置基因为“TBX19”,在“Immune Infiltrates”处选择“调节性T 细胞(Treg)”、“肿瘤相关成纤维细胞(CAF)”,利用网站中的QUANTISEQ、CIBERSORT、MCPCOUNTER、XCELL 等方法进行评估。
1.4.2 癌组织中TBX19 表达与免疫检查点基因的相关性分析 利用临床生信之家(https//www.aclbi.com/static/index.html#/)数据库的 “泛癌模块”,选择“免疫检查点”,输入基因“TBX19”,分析TBX19表达与癌组织免疫检查点基因的相关性。
1.4.3 癌组织中TBX19 表达与免疫评分、TMB、MSI 的关系分析 使用Sanger box 数据分析平台(http://www.sangerbox.com/),在“泛癌分析”模块,分别选择“免疫浸润分析Estimate”、“基因组异质性与基因表达”,设置基因名称为“TBX19”,选择数据参数变换为“log2(x + 0.001)”,分析TBX19表达与癌组织免疫评分、TMB 以及MSI 之间的相关性。
1.5 统计学方法 采用R 软件(3.6.4 版本)进行统计分析。采用非配对t检验评估TBX19 在正常组织和癌组织中的表达;使用Log rank 检验评估TBX19 表达与肿瘤患者生存预后的关系;使用Pearson 相关性分析泛癌组织中TBX19 与免疫细胞浸润、免疫评分、TMB 以及MSI 之间的关系;TBX19表达与临床病理特征分析,两组样本之间的差异使用非配对t检验,多组样本间的差异使用方差分析,进一步两两比较采用LSD-t检验。采用 Spearman 相关性检验分析泛癌组织中TBX19 表达与免疫检查点基因的相关性。以P<0.05 为差异有统计学意义。
2 结果
2.1 癌组织中TBX19 表达与患者预后的关系 与正常组织相比,TBX19 在膀胱尿路上皮癌(BLCA)、胆管癌(CHOL)、结肠癌(COAD)、COADREAD、食管癌(ESCA)、头颈鳞状细胞癌(HNSC)、肾透明细胞癌(KIRC)、肾乳头状细胞癌(KIRP)、混合肾癌(KIPAN)、LIHC、肺腺癌(LUAD)、肺鳞癌(LUSC)、嗜铬细胞瘤和副神经节瘤(PCPG)、直肠腺癌(READ)、胃癌(STAD)、胃和食管癌(STES)等16 种癌组织中高表达,在乳腺浸润癌(BRCA)、肾嫌色细胞癌(KICH)、前列腺癌(PRAD)、子宫内膜癌(UCEC)等4 种癌组织中低表达,见图1。

图1 TCGA数据库中癌组织和癌旁组织TBX19的表达水平
TBX19 在BRCA、COAD、COADREAD、KICH、KIRC、KIPAN、甲状腺癌(THCA)的不同WHO 分级癌组织中差异性表达,见图2;在COAD、COADREAD、KIRC、KIPAN、READ、LUAD、PRAD、STAD的不同T 分期癌组织中差异性表达,见图3;在BRCA、COAD、COADREAD、HNSC、PRAD、STES、THCA 的不同淋巴转移癌组织中差异性表达,见图4;在肾上腺皮质癌(ACC)、COAD、COADREAD、KIRC、KIPAN、皮肤黑色素瘤(SKCM)的不同远处转移癌组织中差异性表达,见图5。

图2 TCGA数据库中TBX19在不同WHO分级(Ⅰ、Ⅱ、Ⅲ、Ⅳ)的泛癌组织中的表达水平
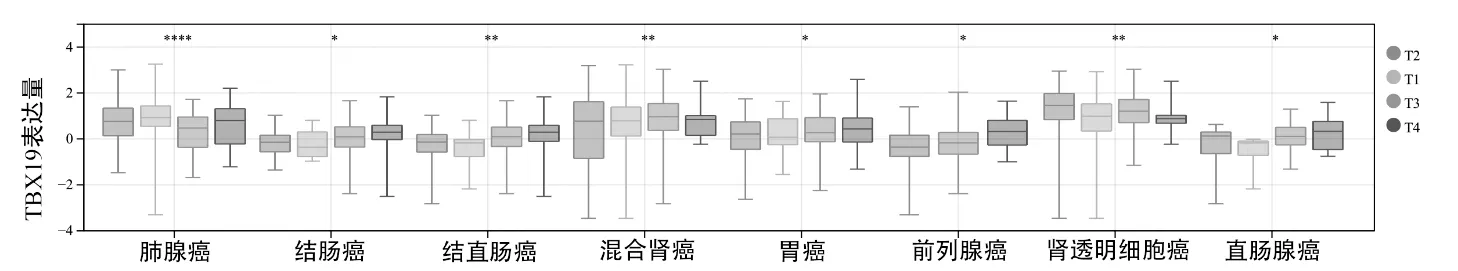
图3 TCGA数据库中TBX19在不同T分期(T1、T2、T3、T4)的泛癌组织中的表达水平

图4 TCGA数据库中TBX19在不同淋巴转移(N0、N1、N2、N3)的泛癌组织中的表达水平
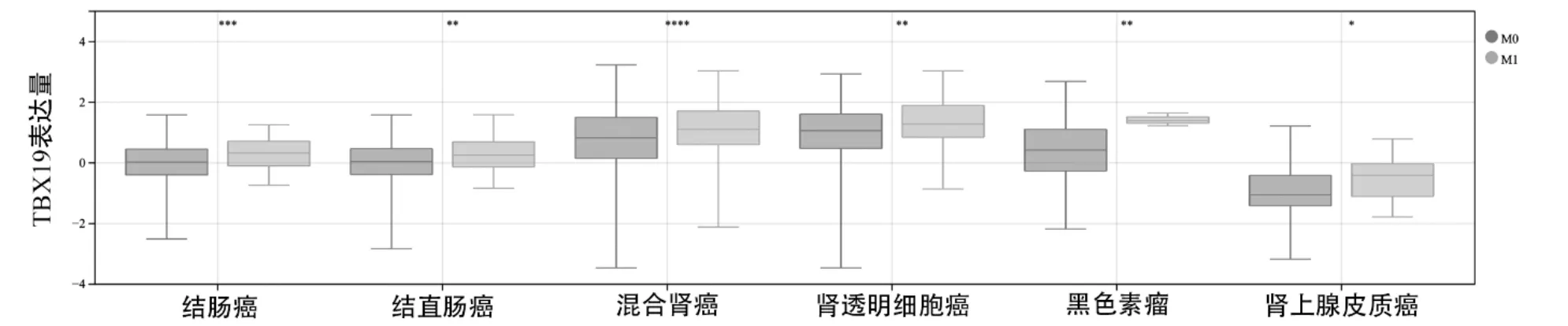
图5 TCGA数据库中TBX19在不同远处转移(M0、M1)的泛癌组织中的表达水平
总体生存期(OS)结果显示,在ACC[HR=1.78,95%CI(1.13,2.81),P=0.01]、COAD[HR=1.46,95%CI(1.00,2.13),P=0.04]、COADREAD[HR=1.51,95%CI(1.07,2.13),P=0.02]、胶 质 瘤(GBMLGG)[HR=2.13,95%CI(1.83,2.49),P<0.001]、KICH[HR=3.28,95%CI(1.29,8.31),P=0.01]、KIRC[HR=1.34,95%CI(1.12,1.61),P<0.01]、KIPAN[HR=1.42,95%CI(1.25,1.60),P<0.001]、脑低级别胶质瘤(LGG)[HR=1.92,95%CI(1.54,2.40),P< 0.001]、LIHC [HR=1.47,95%CI(1.22,1.77),P< 0.001]、间皮瘤(MESO)[HR=1.41,95%CI(1.05,1.89),P=0.02]、胸 腺 癌(THYM)[HR=4.39,95%CI(1.26,15.39),P=0.02]、葡萄膜黑色素瘤(UVM)[HR=1.72,95%CI(1.13,2.62),P=0.01]癌组织中TBX19 高表达的肿瘤患者预后差, SKCM 癌组织中TBX19 低表达的肿瘤患者预后差[HR=0.78,95%CI(0.68,0.91),P<0.01]。TBX19 与疾病特异性生存期(DSS)关系分析中,ACC[HR=1.68,95%CI(1.05,2.69),P=0.03]、BRCA[HR=1.23,95%CI(1.00,1.50),P=0.04]、COAD[HR=2.22,95%CI(1.30,3.81),P< 0.01]、COADREAD[HR=2.34,95%CI(1.41,3.88),P<0.01]、GBMLGG[HR=2.13,95%CI(1.81,2.52),P<0.001]、KIRC[HR=1.40,95%CI(1.11,1.77),P<0.01]、KICH[HR=4.13,95%CI(1.48,11.52),P<0.01]、KIPAN[HR=1.39,95%CI(1.20,1.62),P<0.001]、LGG[HR=1.91,95%CI(1.50,2.41),P<0.001]、LIHC[HR=1.46,95%CI(1.16,1.84),P<0.01]、MESO[HR=1.65,95%CI(1.10,2.48),P=0.02]、STAD[HR=1.30,95%CI(1.01,1.68),P=0.04]、UVM[HR=1.74,95%CI(1.12,2.70),P=0.01]癌组织中TBX19 高表达的肿瘤患者预后差,SKCM 癌组织中TBX19 低表达的肿瘤患者预后差[HR=0.77,95%CI(0.66,0.90),P<0.001]。 在TBX19 表达与无疾病间隔期(DFI)关系分析中,宫颈 鳞癌 和腺 癌(CESC) [HR=1.90,95%CI(1.12,3.23),P=0.02]、LIHC [HR=1.29,95%CI(1.08,1.55),P< 0.01]、子宫肉瘤(UCS)[HR=1.82,95%CI(1.00,3.32),P=0.04]癌组织中TBX19 高表达的肿瘤患者预后差。在TBX19 与无进展间隔期(PFI)关系分析中,BLCA [HR=1.20,95%CI(1.01,1.42),P=0.04]、COAD[HR=1.67,95%CI(1.17,2.38),P<0.01]、COADREAD[HR=1.75,95%CI(1.26,2.42),P<0.001]、GBMLGG[HR=1.91,95%CI(1.65,2.20),P< 0.001]、KIRC[HR=1.30,95%CI(1.08,1.58),P< 0.01]、KIPAN[HR=1.32,95%CI(1.18,1.49),P< 0.001]、LGG[HR=1.80,95%CI(1.48,2.19),P< 0.001]、LIHC[HR=1.29,95%CI(1.09,1.52),P< 0.01]、STES[HR=1.24,95%CI(1.06,1.45),P< 0.01]、STAD[HR=1.30,95%CI(1.05,1.61),P=0.01]癌组织中TBX19 高表达的肿瘤患者预后差,SKCM[HR=0.84,95%CI(0.74,0.95),P<0.01]、胰 腺 癌(PAAD) [HR=0.65,95%CI(0.50,0.83),P<0.01]癌组织中TBX19 低表达的肿瘤患者预后差。
2.2 TBX19 结合蛋白及其相关基因的富集分析结果 通过STRING 数据库共获得实验已验证的50种TBX19 结合蛋白。利用GEPIA2 数据库分析得出与TBX19 表达相关的前100 个基因。韦恩图显示TBX19 结合蛋白与TBX19 表达相关的前100 个基因相交分析无交叉基因。GO 富集分析结果显示,TBX19 结合蛋白和TBX19 表达相关基因与DNA 合成转录、RNA 代谢的途径有关,如作用于 DNA 核酸模板转录、DNA 结合转录因子活性的调控、RNA 生物合成过程的调控、转录的调控、RNA 聚合酶Ⅱ转录的调控、细胞大分子生物合成过程的调控等。KEGG 通路分析结果显示,TBX19 结合蛋白和TBX19表达相关基因与肝细胞癌、前列腺癌、甲状腺癌、子宫内膜癌、结直肠癌等肿瘤有关,另外还与原发性免疫缺陷、癌症中的转录错误调控有关。“Hippo信号通路”、“Wnt 信号通路”等可能参与了 TBX19对肿瘤发病机制的影响。
2.3 泛癌组织中TBX19 表达与肿瘤免疫微环境的关系
2.3.1 泛癌组织中TBX19 表达与免疫浸润水平的关系 基质评分结果显示,COAD、COADREAD、GBMLGG、KIRC、KICH、KIPAN、LGG、LUAD、PRAD、PCPG、READ、THYM、THCA、睾 丸 生 殖 细 胞 瘤(TGCT)、UVM 癌组织中TBX19 表达与基质评分呈正相 关(R分 别为0.26、0.27、0.50、0.24、0.48、0.41、0.47、0.14、0.41、0.15、0.28、0.22、0.13、0.41、0.23,P均<0.05),最显著相关的前3 个肿瘤为GBMLGG、KICH、LGG;STES、UCS 癌 组 织 中TBX19 表达与基质评分呈负相关(R分别为-0.16、-0.28,P均<0.05)。免疫评分结果显示,BRCA、COAD、COADREAD、弥漫性大B细胞淋巴瘤(DLBC)、GBMLGG、KIRC、KICH、KIPAN、LGG、LUAD、PRAD、UVM 癌组织中TBX19 表达与免疫评分呈正相关(R分别为0.19、0.14、0.14、0.60、0.52、0.34、0.46、0.44、0.55、0.18、0.38、0.40,P均<0.001),最显著相关的前3 个肿瘤为DLBC、LGG、GBMLGG;STES、STAD、THYM、UCEC 癌组织中TBX19 表达与免疫评分呈负相关(R分别为-0.23、-0.14、-0.23、-0.20,P均<0.05)。ESTIMATE 评分结果显示,BRCA、COAD、COADREAD、DLBC、GBMLGG、KIRC、KICH、KIPAN、LGG、LUAD、PRAD、READ、TGCT、UVM 癌组织中TBX19 基因表达与ESTIMATE 评分呈正相关(R分别为0.13、0.22、0.22、0.46、0.53、0.33、0.49、0.45、0.53、0.17、0.43、0.23、0.28、0.36,P均<0.05),最 显 著 相 关 的 前3 个 肿 瘤 为LGG、GBMLGG、KICH;STES、STAD、UCEC 癌组织中TBX19 基因表达与ESTIMATE 评分呈负相关(R分别为-0.21、-0.11、-0.16,P均<0.05)。COAD 组织中TBX19 表达与Treg 细胞浸润丰度呈正相关(R=0.156,P<0.01),BRCA-LUMA、CESC、COAD、HNSCHPV(阴性)、LGG、PRAD、READ、TGCT、THCA 癌组织中TBX19 表达与CAF 细胞浸润丰度呈正相关(R分别为0.29、0.24、0.36、0.25、0.27、0.40、0.34、0.32、0.30,P均<0.05)。
2.3.2 泛癌组织中TBX19 表达与免疫检查点基因、TMB 和MSI 的相关性 在大部分癌组织中,TBX19 的表达与8 种免疫检查点抑制基因呈正相关,在BRCA、DLBC、KIRC、LAML、LGG、LIHC、LUAD、PAAD、PRAD、SKCM、UVM 癌组织中,TBX19的表达与表面抗原分化簇274(CD274)呈正相关(R分别为0.23、0.36、0.11、0.24、0.39、0.21、0.27、0.18、0.35、0.15、0.48,P均<0.05);在BRCA、COAD、DLBC、ESCA、GBM、HNSC、KICH、KIRC、KIRP、LAML、LGG、LIHC、LUAD、LUSC、PAAD、PRAD、READ、SKCM、STAD、UVM 癌组织中,TBX19 的表达与细胞毒性T 淋巴细胞相关蛋白4(CTLA4) 呈正相关(R分别为0.27、0.13、0.32、0.20、0.21、0.17、0.54、0.43、0.19、0.17、0.34、0.40、0.31、0.11、0.17、0.40、0.25、0.26、0.20、0.55,P均<0.05);在ACC、BRCA、COAD、HNSC、KICH、LAML、LGG、LIHC、LUAD、PCPG、PRAD、READ、THCA、THYM、UVM 癌组织中,TBX19 的表达与甲型肝炎病毒细胞受体 2 (HAVCR2)呈正相关(R分别为0.31、0.08、0.10、0.15、0.33、0.32、0.62、0.39、0.18、0.16、0.37、0.18、0.10、0.27、0.64,P均<0.05);在ACC、BRCA、DLBC、GBM、HNSC、KICH、KIRC、KIRP、LGG、LIHC、LUAD、LUSC、卵巢浆液性囊腺癌(OV)、PRAD、READ、肉瘤(SARC)、UVM 癌组织中,TBX19的表达与淋巴细胞激活基因3(LAG3)呈正相关(R分别为0.22、0.22、0.37、0.22、0.12、0.49、0.32、0.25、0.34、0.26、0.17、0.11、0.16、0.43、0.19、0.16、0.44,P均<0.05);在BRCA、DLBC、GBM、HNSC、KICH、KIRC、KIRP、LGG、LIHC、LUAD、MESO、PRAD、THCA、UVM 癌组织中,TBX19 的表达与程序性细胞死亡1 基因(PDCD1)呈正相关(R分别为0.25、0.46、0.22、0.12、0.41、0.32、0.27、0.41、0.37、0.19、0.28、0.42、0.14、0.52,P均<0.05);在BRCA、COAD、DLBC、KICH、KIRC、LAML、LGG、LIHC、LUAD、PCPG、PRAD、READ、SKCM、UVM 癌组织中,TBX19表达与程序性细胞死亡蛋白1配体2(PDCD1LG2)呈正相关(R分别为0.31、0.11、0.38、0.57、0.18、0.18、0.60、0.14、0.14、0.19、0.45、0.18、0.14、0.44,P均<0.05);在CESC、COAD、ESCA、GBM、HNSC、KIRP、LAML、LGG、LUAD、LUSC、OV、PAAD、PCPG、PRAD、READ、THCA、THYM、UCS 癌组织中,TBX19 的表达与唾液酸结合免疫球蛋白样凝集素-15(SIGLEC15)呈正相关(R分别为0.14、0.13、0.17、0.21、0.26、0.19、0.22、0.20、0.18、0.14、0.15、0.22、0.16、0.40、0.17、0.28、0.26、0.33,P均<0.05);在BRCA、COAD、DLBC、GBM、HNSC、KICH、KIRC、KIRP、LGG、LIHC、LUAD、PRAD、READ、SKCM、STAD、THYM、UVM 癌组织中,TBX19 的表达与T 细胞免疫球蛋白ITIM 结构域(TIGIT)呈正相关(R分别为0.25、0.11、0.37、0.23、0.13、0.49、0.32、0.13、0.09、0.29、0.25、0.40、0.23、0.11、0.14、0.19、0.51,P均<0.05)。在UCEC 癌 组 织 中,TBX19 表 达 与CTLA4、PDCD1、TIGIT呈负相关(R分别为–0.13、–0.13、–0.09,P均<0.05);在THYM 癌 组 织 中,TBX19 表 达 与PDCD1 呈负相关(R为–0.18,P<0.05);在THCA、LUSC 癌 组 织 中TBX19 表 达 与CD274(R分 别 为-0.11、-0.10,P均<0.05)、PDCD1LG2 (R分 别 为-0.09、-0.15,P均<0.05)呈负相关;在MESO 癌组织中,TBX19 表达与CD274 呈负相关(R=-0.2,P<0.05);在KIRP 癌组织中,TBX19 表达与CD274、HAVCR2 呈负相关(R分别为-0.24、-0.27,P均<0.05);在STAD、BRCA 癌组织中,TBX19 表达与SIGLEC15 呈负相关(R分别为-0.13、-0.19,P均<0.05)。ACC、GBMLGG、KIRP、KIPAN、KIRC、OV、PCPG、THYM 癌 组 织中TBX19 与TMB 呈 正 相 关(R分别为0.34、0.12、0.12、0.16、0.13、0.12、0.23、0.31,P均<0.05);STES、UCEC 癌组织中TBX19 与TMB 呈负相关(R分别为-0.09、-0.19,P均<0.05)。BRCA、CESC、LUAD、LUSC、PCPG、THYM、THCA 癌组织中,TBX19 与MSI 正相关(R分别为0.13、0.13、0.14、0.14、0.17、0.27、0.12,P均<0.05);DLBC、GBMLGG、KIPAN、STES、UCEC 癌组织中,TBX19 与MSI 负相关(R分别为-0.46、-0.16、-0.29、-0.11、-0.21,P均<0.05)。
3 讨论
最近研究[9-11]报道揭示了TBX19 与常见病之间关系,特别是癌症。既往研究[12]表明,TBX19 在COADREAD 中高表达,与患者预后不良有一定联系,并且TBX19 表达上调与患者淋巴结转移密切相关。还有研究[13]发现,TBX19在转移性LIHC组织中的表达高于原发性LIHC组织和癌旁非肿瘤组织,并且与肿瘤分化差、TNM 分期高呈正相关,是肝细胞癌患者复发与生存的独立预测因子。本研究初步预测了TBX19 在多种癌组织中的表达,与肿瘤分级、分期以及患者预后之间的关系,发现TBX19 在大部分癌组织中高表达并且与患者预后不良有关,这与其他学者的研究结果基本一致。此外,TBX19 的表达与肿瘤的分级和分期密切相关,而且在COAD、COADREAD 中,TBX19 的表达水平随着肿瘤的WHO 分级以及TNM 分期的升高而逐渐升高,表明TBX19高表达可能加速肿瘤的进展。以上研究结果提示TBX19 可以作为一些肿瘤预后的生物标志物。但TBX19 在不同类型癌组织中的表达水平存在差异,可能反映其不同的生物学功能。
为确定TBX19 在泛癌中的潜在分子机制,我们对TBX19 相关基因进行了GO 和KEGG 通路富集分析。结果显示TBX19 主要与LIHC、PRAD、COADREAD 等肿瘤有关,Hppio 和Wnt 通路为主要富集通路。表明 TBX19 与肿瘤密切相关,可能通过多途径调控肿瘤的发生发展。
为了阐明TBX19 与免疫浸润的关系,我们利用R 软件包中的ESTIMATE 方法评估了TCGA 中TBX19 表达与免疫评分的关系,结果显示在COAD、COADREAD等12种肿瘤中,TBX19的表达与免疫细胞浸润水平呈正相关,而在STES、STAD、THYM、UCEC中,TBX19的表达与免疫细胞浸润水平呈负相关,表明在大多数肿瘤中,TBX19的表达水平与高免疫细胞浸润相关。在COAD 中,TBX19 表达与Treg所占百分比呈正相关,在COAD、PRAD 等肿瘤中,TBX19 表达与CAF 细胞所占百分比呈正相关,提示TBX19 高表达可能通过募集更多Treg 和CAF 细胞发挥促进肿瘤进展的作用。值得注意的是,在COAD 中,我们发现TBX19 表达水平与免疫评分以及Treg、CAF 细胞的免疫浸润水平均呈正相关,这可能是TBX19成为COAD预后危险因素的原因之一。
本研究还分析了TBX19 表达与免疫检查点相关基因、TMB、MSI 之间的相关性。免疫检查点是一些抑制机体免疫反应、控制效应细胞过度激活、避免免疫病理损伤的共抑制分子[14],通过阻断免疫检查点的途径可以实现较明显的抗肿瘤效果[15]。本研究结果显示,在PRAD、LUAD、LGG 中,TBX19 表达与PDCD1、CD274、CTLA4、HAVCR2、LAG3、PDCD1LG 2、SIGLEC15、TIGIT 等8 种免疫检查点抑制基因均呈正相关,在UCEC 中与CTLA4、PDCD1、TIGIT 呈负相关,表明TBX19 可能通过免疫检查点途径影响机体免疫对于肿瘤细胞的监视,靶向TBX19 治疗或许可以调节肿瘤免疫。TMB和MSI与免疫治疗应答相关[16],是免疫治疗反应的预测性生物标志物[17-18]。本研究分析了TBX19表达与TMB、MSI的相关性,发现TBX19 表达与8 种肿瘤的TMB 呈正相关,与7 种肿瘤的MSI 呈正相关,其中与TMB 和MSI 均为正相关的是THYM。提示TBX19可能对免疫治疗反应有一定的预测作用,可以通过影响 TMB 和MSI 进一步调节肿瘤免疫。
综上所述,通过对TBX19的首次泛癌分析,我们发现TBX19 在不同肿瘤中存在差异表达,与患者预后有关,而且与癌组织中多种免疫浸润细胞、免疫检查点基因、TMB、MSI存在较强的相关性,这有助于了解TBX19 在泛癌中的作用,也为肿瘤的免疫治疗提供了新的思路。但本研究主要是基于数据库的生物信息学分析,TBX19 在泛癌中具体的作用机制及生物学过程,仍需更多的基础以及临床实验予以验证。

