不同浓度补阳还五汤含药血清对缺氧缺糖/复氧复糖损伤的大鼠CTX-TNA2细胞系修复作用观察
叶佳蓓,程建业,高雪亮,王凯,李普阳,王召,赵亚鹏*
1 河北省中医院针灸科,石家庄 050011;2 河北中医学院 河北省心脑血管病中医药防治研究重点实验室;3 河北省中医院外四科
缺血性卒中在我国的发病率和患病率呈逐年上升趋势[1],其中脑缺血再灌注(CI/R)损伤是影响缺血性卒中预后的重要病理生理过程,其导致的神经损伤甚至有可能重于脑缺血造成的损伤[2]。对神经细胞进行缺氧缺糖/复氧复糖(OGD/R)处理是体外模拟CI/R 损伤较为合理的方式[3-5],以此来进行缺血性卒中离体层面的药物及机制研究。出自《医林改错》的补阳还五汤是治疗缺血性中风病的经典复方,主要包括黄芪、赤芍、当归、红花、桃仁、川芎、地龙,其可通过保护线粒体、调控神经元自噬与凋亡、促进神经修复及血管再生等机制发挥神经保护作用[6-8],我们也通过在体实验证实这一点[9]。本研究中,我们将通过大鼠星形胶质细胞系CTX-TNA2 建立OGD/R 模型模拟CI/R 损伤,探究离体情况下补阳还五汤对CI/R损伤星形胶质细胞的修复作用。
1 材料与方法
1.1 材料 细胞:CTX-TNA2 细胞即大鼠脑Ⅰ型星形胶质细胞,购自赛百慷(上海)生物技术股份有限公司(iCell Bioscience Inc, Shanghai)。试剂:DMEM高糖培养基、青霉素—链霉素(10,000 U/mL)、胰蛋白酶-EDTA(0.25%)、胎牛血清、无糖培养基、PBS缓冲液均购自GIBICO 公司,MTS 试剂盒购自Promega公司,LDH 试剂盒购自南京建成生物工程研究所。仪器: 3111 型二氧化碳培养箱、3131 型三气培养箱和Varioskan LUX 型多功能微孔板读数仪购自Thermo Fisher Scientific 公司,SW-CJ-ID 型超净工作台购自苏州净化公司,Primovert 型倒置相差显微镜购自Carl Zeiss 公司,5702 型低温离心机购自Eppendorf公司,0.22 μm滤膜购自Milipore公司。
1.2 补阳还五汤含药血清和空白血清的制备 取30 只体质量为230~240 g 的SD 雄性大鼠,由北京维通利华实验动物科技有限公司提供,许可证号为SCXK(京)2016–0011,且动物实验通过河北中医学院伦理委员会审核批准(DWLL2020075),其中20只大鼠予补阳还五汤冻干粉水溶液灌胃,补阳还五汤冻干粉3.02 g /(kg· d)溶于2 mL/只的0.9%氯化钠溶液中形成水溶液,另外10 只大鼠予2 mL/只的0.9%氯化钠溶液灌胃,大鼠均连续灌胃7 d,最后1次灌胃后禁食水2 h,在无菌环境中进行腹主动脉取血并收集到促凝管中,全血常温静置15 min、4 ℃,2 500 r/min离心30 min,吸取上清,收集到一起离心混匀,56 ℃水浴30 min 灭活补体,经0.22 μm 过滤除菌后存于-80 ℃冰箱。
1.3 CTX-TNA2 细胞分组、OGD/R 处理、补阳还五汤含药血清加入 CTX-TNA2 细胞以完全培养基(含有10% 胎牛血清和1% 青链霉素混合液的DMEM 高糖培养基)、置于37 ℃ 74% N2+ 5% CO2+21% O2的细胞培养箱中进行培养,每24~32小时当细胞汇合度达到70%~80%时进行1∶2或1∶3传代。将复苏后传代3~4 次且处于对数生长期的CTXTNA2 细胞分为观察组、血清组、模型组、正常组。其中正常组不做任何处理,常规培养;模型组弃去原培养基,用室温预热的PBS 润洗细胞,吸尽PBS,加入不含糖、含钙镁的无糖培养基,并迅速置于37 ℃,含94% N2+ 5% CO2+ 1% O2的三气培养箱中6 h 进行缺氧缺糖,然后把无糖培养基全部更换为完全培养基,重新置于37 ℃ 74% N2+ 5% CO2+ 21% O2环境中进行24 h 复氧复糖;观察组和血清组细胞用上述方法进行6 h缺氧缺糖处理,然后分别用含0.5%、1%、3%、5%和10%补阳还五汤含药血清(观察1、2、3、4、5组)或0.5%、1%、3%、5%和10%空白血清(血清1、2、3、4、5 组)的完全培养基进行24 h 复氧复糖处理。
1.4 细胞存活率的检测 采用MTS 法。将对数生长期的上述各组细胞接种于96 孔板中,每孔加入20 μL CellTiter 96水溶液试剂,置于5% CO2、37 ℃培养箱中孵育50 min。在多功能微孔板读数仪测定各孔490 nm 处的吸光度值。细胞存活率=(实验组吸光度值-空白组吸光度值)/(对照组吸光度值-空白组吸光度值)。
1.5 细胞乳酸脱氢酶漏出率的检测 采用LDH法。将对数生长期的上述各组细胞接种于96 孔板中,吸取各细胞孔的上清液加入到另一新的96孔板中加入LDH 试剂,按说明书进行孵育,在多功能微孔板读数仪中测450 nm 吸光度, 此为细胞上清中 LDH 释放量;然后向原培养板中细胞加入1%Triton X-100,室温反应20 min 后取细胞反应液及 LDH 工作液混匀,继续在多功能微孔板读数仪中测450 nm 吸光度,此为细胞破膜液 LDH 释放量。LDH 漏出率(%)=上清 LDH 释放量/(上清 LDH释放量 + 细胞破膜液 LDH释放量)×100%。
1.6 细胞形态和状态的观察 将对数生长期的上述各组细胞置于倒置相差显微镜下观察其胞体状态、突起形态及胞间连接情况,每组细胞采集3个视野的图像留存。
1.7 统计学方法 采用SPSS25.0 统计软件。计量资料以xˉ ± s 表示,满足正态性和方差齐性检验者,多样本比较采用单因素方差分析(oneway ANOVA),两两比较采用Tukey 法;不满足正态性和方差齐性检验者,采用多个独立样本的非参数秩和检验(Kruskal-WallisHTest)。以P<0.05 为差异有统计学意义。
2 结果
2.1 各组细胞存活率比较 观察1、2、3、4、5 组细胞 存 活 率 分 别 为92.90% ± 5.77%、94.00% ±12.43%、98.80% ± 6.55%、101.50% ± 0.61%、94.40% ± 19.75%,血清1、2、3、4、5组细胞存活率分别为88.85% ± 0.06%、92.64% ± 4.43%、90.15% ±2.44%、82.98% ± 16.48%、86.75% ± 12.41%,模型组细胞存活率为79.25% ± 2.15%,
正常组细胞存活率为141.20% ± 4.78%。与正常组相比,模型组细胞存活率减低(P<0.01)。观察3、4 组细胞存活率升高(P均<0.01)。与血清4组相比,观察4组细胞存活率更高(P<0.01)。
2.2 各组乳酸脱氢酶漏出率比较 观察1、2、3、4、5 组细胞乳酸脱氢酶漏出率分别为26.06% ±3.31%、26.58% ± 2.94%、26.74% ± 2.67%、20.99% ± 2.48%、31.56% ± 2.42%,血清1、2、3、4、5 组细胞乳酸脱氢酶漏出率分别为25.31% ±3.48%、26.31% ± 2.26%、27.06% ± 1.26%、27.56% ± 1.62%、29.31% ± 2.97%,模型组乳酸脱氢酶漏出率为29.62% ± 0.91%,正常组乳酸脱氢酶漏出率为0。与正常组相比,模型组细胞乳酸脱氢酶漏出率增高(P<0.01);与模型组相比,观察组细胞乳酸脱氢酶漏出率降低(P<0.01);与血清4 组比较,观察4组乳酸脱氢酶漏出率低(P<0.05)。
2.3 各组细胞形态比较 由上述结果可知5%补阳还五汤含药血清处理可对OGD/R 损伤后的细胞产生一定的修复作用,因此倒置相差显微镜重点观察5%的补阳还五汤含药血清及5%的空白血清对OGD/RCTX-TNA2细胞的影响。镜下观察发现正常组细胞贴壁情况良好,细胞呈多角形、形态良好、胞膜光滑、胞体清晰,细胞排列较密集,细胞之间连接紧密;模型组细胞较正常组损伤严重,细胞胞体肿胀且状态不佳、突起严重萎缩变形、胞质分泌的颗粒样物质增多,细胞间连接断裂严重甚至消失。经过5%的补阳还五汤含药血清和空白血清干预后,细胞胞体形态较模型组有所恢复,胞质分泌颗粒减少,胞间突起均较模型组有所增加。其中,与5%空白血清相比,5%补阳还五汤含药血清干预后细胞状态的好转情况更为明显,胞内结构更为清晰、颗粒明显减少、突起萎缩及胞间连接显著好转,见图1。
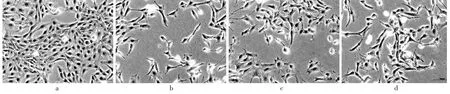
图1 CTX-TNA2细胞形态(×200)
3 讨论
目前,已有大量研究从在体实验角度发现补阳还五汤能够减轻CI/R 损伤[8,10-11],其中星形胶质细胞可通过降低其兴奋性氨基酸毒性、减轻炎症反应和促进神经修复等机制参与此过程。因此,本研究选择从离体层面重点探讨补阳还五汤对星形胶质细胞的作用,研究对象选取大鼠星形胶质细胞系即CTX-TNA2细胞。
中药及复方的离体实验研究主要有以下三种药物干预方式:中药提取物直接添加、含药血清添加和含药血浆添加。单味中药的有效单体成分多直接添加到细胞培养体系中,而中药复方若采取直接接触细胞的方式,则会因为本身含有的杂质及渗透压、酸碱度、鞣质成分、无机盐离子等非特异性理化因素影响到最终实验结果。本研究中使用的补阳还五汤通常是需要口服并经吸收、代谢而起效,且鉴于含药血清技术较为成熟、应用广泛,故采用补阳还五汤含药血清作为离体实验的干预方式。
血清药理学是日本学者田代真一在20 世纪80年代提出的一研究中药复方的体外实验方法,经过多年的发展,现已成为较为科学的、研究中药药效及作用机制和物质基础的方法。血清药理学是指将单味中药或中药复方通过给动物灌胃一定时间后收集动物体内血清即含药血清,直接加入到离体反应体系中进行药效评价及机制研究。影响含药血清药效以及最终实验结果的因素有很多,包括供体实验动物选择、含药血清的给药剂量和方案、采血时间、血清灭活与保存以及对照设计等方面。本研究采用与CTX-TNA2 细胞同种属的SD 大鼠作为供体实验动物来制备含药血清,以此来缩小动物血清和动物细胞之间的差异。在给药剂量方面,为保证动物连续灌胃给药的一致性,课题组前期将补阳还五汤水煎液统一制成冻干粉,经临床用药量、动物等效剂量系数(按体表面积)和冻干粉得粉率换算后确定3.02 g/(kg·d)为SD 大鼠给药剂量、2 mL 为大鼠灌胃体积。同时有研究[12]表明补阳还五汤的含药血清无明显的量效依存关系,应以临床等效剂量为基准。在给药方案和采血方案上,根据大量文献和本课题组前期研究,我们对大鼠进行连续7 d灌胃和最后一次灌胃后空腹2 h采血,以此达到含药血清中血药浓度的稳定。在血清灭活方面,为减少血清中多种酶、抗体、补体等生物活性物质对实验结果的影响,本研究选择同时灭活处理含药血清和空白血清,灭活并不影响细胞生长,这样更加突出含药血清中补阳还五汤的作用。在对照设计方面,本研究全程选择经相同灌胃和采血处理后得到的空白血清作为对照,使含药血清组的结果更具可比性。另外,对于离体反应体系中含药血清的添加方式,我们将含药血清视为一种外来添加物,选择含药血清和常规细胞培养血清并存的方法,即在复氧复糖10%胎牛血清基础上额外添加不同体积分数的含药血清,虽然增加了细胞复氧复糖时的总血清含量,但是这种方式稳定了细胞状态,保证了所有细胞反应体系的一致性,还能更好地模拟在体实验中的干预方式。
细胞存活率反映外源添加物质对细胞活力和健康程度的影响,乳酸脱氢酶漏出率反映外源添加物质对细胞产生的毒性作用,以此来发现补阳还五汤含药血清抗CTX-TNA2 细胞OGD/R 损伤的最佳参考浓度。结果发现,在完全培养基中加入5%补阳还五汤含药血清可显著提高OGD/R 损伤的CTXTNA2 细胞存活率并降低其乳酸脱氢酶漏出率,而且优于同浓度的空白血清。然后通过倒置相差显微镜观察正常组、模型组、观察组和血清组的细胞胞体及突起情况时,发现5%补阳还五汤含药血清处理的细胞在OGD/R 损伤后恢复较好。因此,5%可作补阳还五汤含药血清减轻CTX-TNA2 细胞OGD/R损伤的参考浓度。
综上所述,本研究通过离体实验探究了补阳还五汤对大鼠CTX-TNA2细胞的保护作用,发现5%补阳还五汤含药血清可修复CTX-TNA2 细胞OGD/R损伤。在此基础上我们将对补阳还五汤离体层面的神经保护机制进行深入研究,并在中药复方血清药理学应用上进行探索。

