转染IGF2BP3基因siRNA和真核表达质粒的神经母细胞瘤细胞侵袭凋亡变化观察
朱凯,王志茹,高婷婷,吕志宝
1 上海市儿童医院 上海交通大学医学院附属儿童医院普外科,上海 200062;2 中国科学技术大学附属第一医院(安徽省立医院)儿外科
神经母细胞瘤(NB)是一种起源于神经外胚层神经嵴交感神经细胞的胚胎性肿瘤,是儿童最常见的实体性颅外恶性肿瘤,也是婴儿期最常见的肿瘤[1]。大多数患者(90%)在5岁前确诊,诊断时的中位年龄为19个月[2]。目前临床上依据儿童肿瘤协作组(COG)分级系统将NB 患者分为低危、中危、高危3组[3],针对不同亚组患者建议采取不同强度的治疗模式。NB具有极强的异质性,不同亚组患者之间治愈的可能性差异很大。低中危组患者的生存率大于70%,高危组患者尽管采用多种治疗模式包括强剂量的化疗和免疫治疗,5 年生存率依然停留在25%~50%[4-5]。故探讨新的NB 治疗靶点,并对患者及早进行针对性干预,有助于改善NB患者的预后。
胰岛素样生长因子2 mRNA 结合蛋白家族(IGF2BPs)是一类包含两个N 端RNA 识别基序(RRM)和四个C端信使核糖核蛋白K同源性结构域的RNA 结合蛋白[6]。目前发现IGFBPs 蛋白在很多部位的肿瘤组织中存在高表达[7-9];胰岛素样生长因子2 mRNA 结合蛋白3(IGF2BP3)可通过结合编码区不稳定性决定因子(CRD)防止MYC mRNA 降解,从而促进肿瘤细胞的侵袭和转移[10]。目前仍无相关研究报道IGF2BP3 在NB 中的作用。2022 年1 月—2023 年3 月,我们观察了转染IGF2BP3 基因siRNA和真核表达质粒的神经母细胞瘤(NB)细胞侵袭凋亡变化,以探讨IGF2BP3基因对NB细胞侵袭和凋亡的影响,为IGF2BP3作为阻断NB进展的潜在靶点提供研究资料。
1 材料与方法
1.1 细胞、试剂和仪器 NB 细胞株SK-N-BE(2)、IMR-32、BE(2)-C、SH-SY-5Y 均购自中国医学科学院基础医学研究所细胞资源中心;胰酶、RPMI1640培养基、胎牛血清购自美国HyClone 公司;针对IGF2BP3 的小干扰RNA(siRNA)及对照(SiNC),IGF2BP3 真核表达质粒(IGF2BP3)及对照(Vector)均购自上海吉凯基因化学技术有限公司;Prime-Script™ RT Master 和MixRNAiso Plus 购自日本TAKARA 公司;HRP 标记山羊抗兔IgG、AnnexinV-FITC凋亡检测试剂盒、蛋白提取试剂盒购自上海碧云天生物技术公司;PVDF 膜和细胞裂解液(Cell Lysis Solution)购自美国Millipore公司;ECL发光液购自美国Thermo 公司;IGF2BP3、E-cadherin、N-cadherin、vimentin 和GAPDH 抗体购自英国Abcam 公司;Matrigel 基质胶购自美国BD 公司;Real Time PCR 仪购自美国Applied Biosystems 公司;荧光显微镜购自日本奥林巴斯公司;实验所用引物委托上海生工生物工程公司合成。
1.2 4 种NB 细胞株中IGF2BP3 mRNA 及蛋白的检测及实验细胞选择 SK-N-BE(2)、IMR-32、BE(2)-C、SH-SY-5Y细胞均使用含有10% FBS及1×105U/L青霉素 + 100 mg/L 链霉素的RPMI-1640 培养基,在37 ℃含5% CO2的恒温培养箱中培养。所有细胞系经STR 谱鉴定,支原体试验阴性。采用qRT-PCR 法检测IGF2BP3 mRNA。PCR 反应在ABI Step One Plus 系统上进行,反应条件:预变性阶段 95 ℃持续10 min;扩增阶段95 ℃持续10 s、60 ℃持续15 s、72 ℃持续15 s,共经历45 个周期循环;溶解曲线阶段95 ℃持续10 s、65 ℃持续60 s 、97 ℃持续1 s。以GAPDH 为内参,2-ΔΔCT法计算IGF2BP3 mRNA在各组细胞中的相对表达量。扩增使用的引物分别为:IGF2BP3: forward:5'-ATCGCCAATCAGGAATCCTTTG-3,reverse:5'-CACAACACGTTCGTCCTCCA-3';GAPDH: forward: 5'-ACCTGACCTGCCGTCTAGAA-3',reverse: 5'-TCCACCACCCTGTTGCTGTA-3'。结果显示,SK-N-BE(2)、IMR-32、BE(2)-C、SH-SY-5Y 细胞中IGF2BP3 mRNA 的相对表达量分别是8.35 ± 0.87、1.37 ± 0.06、2.73 ± 0.48、4.01 ± 0.36,4 株细胞的IGF2BP3 mRNA 相对表达量比较,P<0.01。SK-NBE(2)细胞IGF2BP3 mRNA 相对表达量最高,IMR-32细胞IGF2BP3 mRNA相对表达量最低。
采用Western blotting 法检测IGF2BP3 蛋白。根据目的蛋白和内参蛋白条带的显色结果,判断IGF2BP3 蛋白在NB 细胞中的表达水平。结果显示SK-N-BE(2)、IMR-32、 BE(2)-C、SH-SY-5Y 细 胞IGF2BP3 蛋白表达水平分别为1.24 ± 0.52、0.29 ±0.14、0.75 ± 0.26、0.68 ± 0.27,IGF2BP3 蛋白表达水平在SK-N-BE(2)细胞中最高,在IMR-32 细胞中最低。
采用Transwell实验观察4种NB 细胞侵袭情况。收集上述4 种细胞,用胰酶消化后用不含血清的培养基稀释细胞,按照10 000 个/孔接种至覆盖Matrigel 基质胶的24 孔的Transwell 小室膜上方,在下方加入含10% FBS的培养基,继续培养各组细胞48 h;接下来用结晶紫染液固定NB 细胞,待自然晾干后在200×倒置显微镜下观察染色细胞;随机选取至少3 个视野,拍照,计数,取均值。结果显示SK-N-BE(2)、IMR-32、BE(2)-C、SH-SY-5Y 细胞的穿膜细胞数分别是(200 ± 15)、(27 ± 3)、(48 ± 5)、(89 ± 8)个/HP,4 组NB 细胞穿膜细胞数差异有统计学意义(P<0.01),SK-N-BE(2)细胞穿膜细胞数最多、IMR-32细胞穿膜细胞数最少。
基于上述实验结果,选择后续实验细胞为SKN-BE(2)细胞、IMR-32细胞。
1.3 实验细胞分组及干扰和过表达IGF2BP3 质粒的转染 选择SK-N-BE(2)细胞转染针对IGF2BP3基因的小干扰RNA(siRNA)(SK-siIGF2BP3 组),并设立细胞对照组(SK-Control 组,只含有脂质体)和siRNA 对照组(SK-siNC 组,转染阴性对照序列);选择IMR-32 细胞转染IGF2BP3 真核表达质粒(IMRIGF2BP3组),并设立细胞对照组(IMR-Control组,只含有脂质体)和空载体对照组(IMR-Vector 组,转染空载体)。siRNA 和过表达IGF2BP3 的质粒转染参照脂质体Lipofectamine 2000 说明书进行。将1×106个NB 细胞接种至6 孔培养板,待细胞汇合度达到70%~80%时,将脂质体和siRNA 用不含血清和抗生素和RPMI1640 培养基稀释,室温条件下孵育5 min 后将上述两者混合,反复吹吸数次,室温静置20 min。将混合液加入6 孔培养板孔中,继续培养6 h,弃去培养基,加入新鲜的完全培养基后继续培养。
1.4 实验细胞中IGF2BP3 mRNA 及蛋白检测 采用qRT-PCR法检测各组IGF2BP3 mRNA。采用免疫荧光法检测各组IGF2BP3蛋白。
1.5 实验细胞侵袭能力观察 采用Transwell 法检测。
1.6 实验细胞凋亡率的测算 采用流式细胞术。收集上述各组细胞,细胞转染48 h 后用0.25%胰蛋白酶消化,1 000×g 离心5 min,弃上清,收集细胞,用预冷的PBS洗涤3次,1 000×g离心5 min,弃上清,在离心管中收集1~5×105个NB 细胞。加入100 μL 的1×Binding Buffer 重悬各组细胞后加入5 μL 的 Annexin V-FITC 和10 μL 的碘化丙啶(PI)染色液,轻轻混匀,在室温(20~25 ℃)条件下与各分组的NB 细胞避光孵育15 min;随后将1.5 mL 的离心管置于冰浴中,再加入400 μL预冷的PBS,所有NB细胞在1 h内上机检测,FlowJo 7.6.5 软件用于分析检测结果。每组NB 细胞进行3 复孔检测,横坐标为FITC,纵坐标为PI,绘制散点图,分析凋亡细胞的百分比。
1.7 各组IGF2BP3 及侵袭相关蛋白E-cadherin、Ncadherin、Vimentin 的 检 测 采用Western blotting法。最后根据目的蛋白和内参蛋白条带的显色结果,判断IGF2BP3、E-cadherin、N-cadherin 和Vimentin蛋白在NB细胞中的表达水平。
1.8 统计学方法 采用SPSS17.0 统计软件。计量资料以±s表示,比较采 one-way ANOVA 检验,进一步两两比较采用LSD-t检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 各组细胞IGF2BP3 mRNA 及蛋白相对表达量比较 SK-N-BE(2)细胞和IMR-32 细胞中IGF2BP3的 表 达 见 图1。在SK-N-BE(2)细 胞 中,SK-si-IGF2BP3 组、SK-siNC 组、SK-Control 组 的IGF2BP 3 mRNA 相对表达量分别是0.24 ± 0.06、0.98 ±0.09、1 ± 0.16,三组比较,F=0.364,P<0.05;SK-si-IGF2BP3 组IGF2BP3 mRNA 相对表达量低于SKControl 组(t=20.37,P=0.018)和SK-siNC 组(t=18.11,P=0.003)。SK-siIGF2BP3 组、SK-siNC 组、SK-Control 组的IGF2BP3 蛋白相对表达量分别为1.02 ± 0.31、1.14 ± 0.28和0.37 ± 0.17,三组比较,F=7.59,P<0.05;SK-siIGF2BP3 组IGF2BP3 蛋白相对表达量低于SK-Control 组(t=3.18,P=0.033)和SK-siNC 组(t=4.07,P=0.015)。以上说明在SK-NBE(2)细胞中通过转染siIGF2BP3,IGF2BP3 的敲减效果满意。
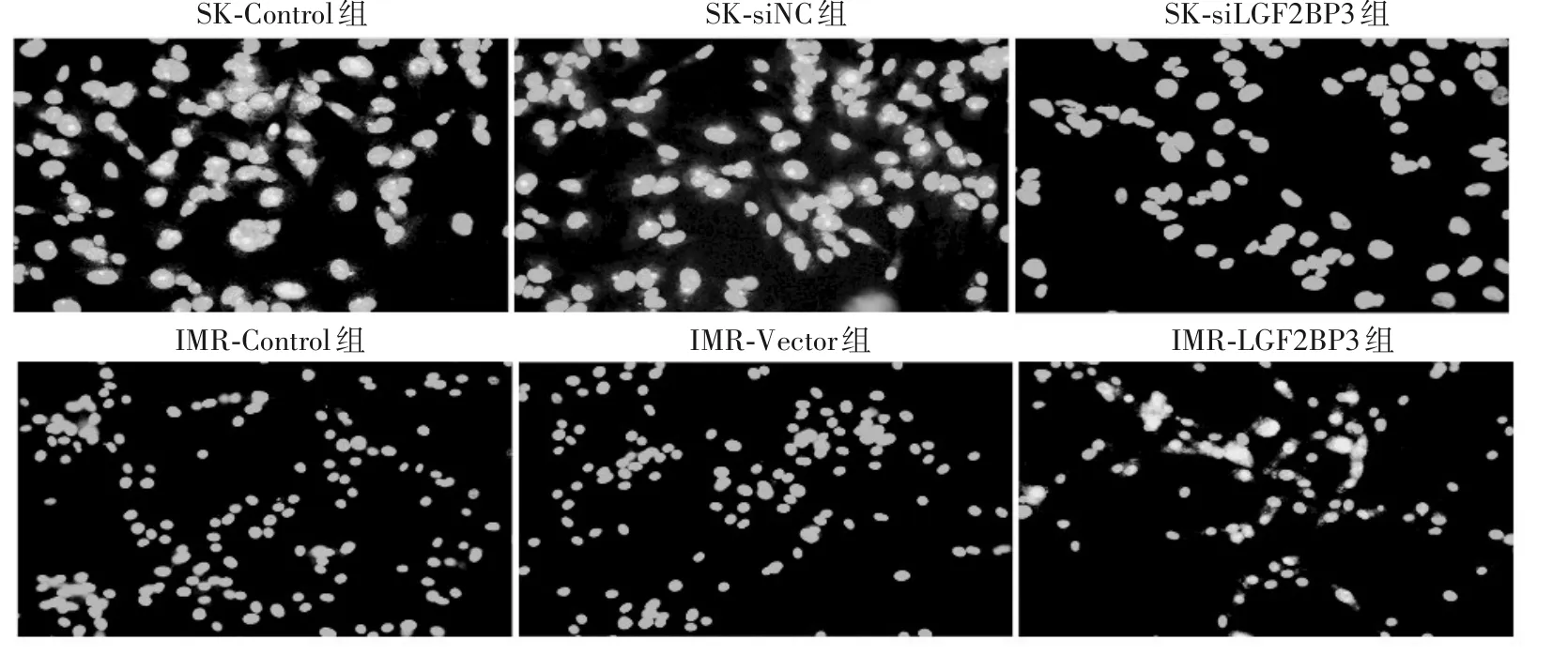
图1 SK-N-BE(2)细胞和IMR-32细胞中IGF2BP3的表达(200×,细胞免疫荧光法)
在IMR-32 细胞中,IMR-IGF2BP3 组、IMR-Vector 组、IMR-Control 组的IGF2BP3 mRNA 相对表达量分别为10.44 ± 1.26、1.09 ± 0.02、1.01 ± 0.16,三组比较,F=1.24,P<0.05;IMR-IGF2BP3 组mRNA 相对表达量高于IMR-Control 组(t=12.89,P=0.005)和IMR-Vector 组(t=12.90,P=0.006)。IMR-IGF2BP3组、IMR-Vector 组、IMR-Control 组的IGF2BP3 蛋白相 对表 达量 分 别 为0.24 ± 0.11、0.31 ± 0.13 和0.92 ± 0.36,三 组 比 较,F=7.94,P<0.05;IMRIGF2BP3组IGF2BP3蛋白相对表达量高于IMR-Vector 组、IMR-Control 组(t分别为3.13、2.76,P均<0.05)。以上说明在IMR-32细胞中转染IGF2BP3质粒后IGF2BP3的过表达效果满意。
2.2 各组穿越Transwell 小室膜细胞数比较 SK-NBE(2)细胞和IMR-32细胞中三组穿膜细胞见图2。在SK-N-BE(2)细胞中,SK-siIGF2BP3组、SK-siNC组、SKControl组的穿越Transwell 小室膜细胞数分别是(70 ±8)、(255 ± 16)、(247 ± 13)个/HP,SK-siIGF2BP3组细胞的穿越Transwell 小室膜细胞数低于SK-Control组(P=0.002)和SK-siNC组(P=0.005)。在IMR-32 细胞中,IMR-IGF2BP3 组、IMR-Vector 组、IMR-Control组穿越Transwell 小室膜细胞数分别是(71 ± 9)、(35 ±3)、(31 ± 4)个/HP,IMR-IGF2BP3组细胞的穿越Transwell 小室膜细胞数高于IMR-Control组(P=0.029)和IMR-Vector组(P=0.027)。
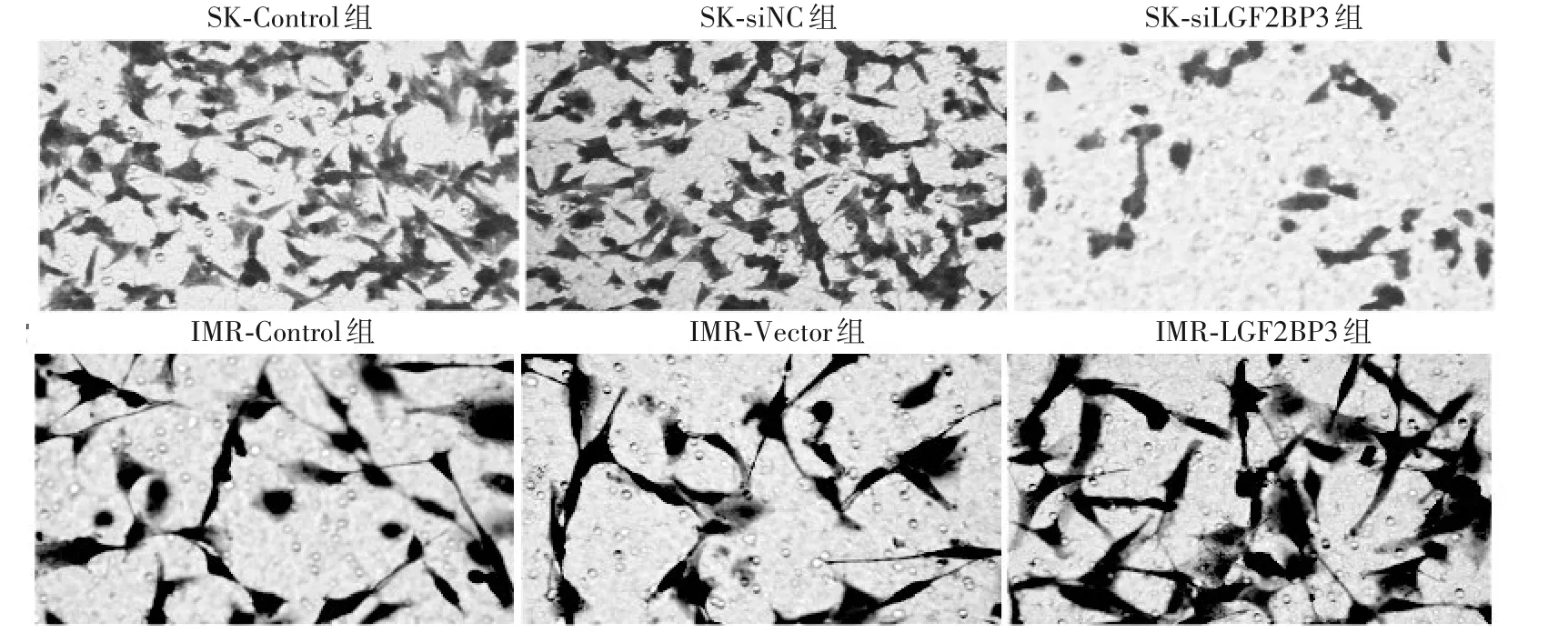
图2 SK-N-BE(2)细胞和IMR-32细胞中三组穿膜细胞(200×,Transwell法)
2.3 各组细胞凋亡率比较 SK-N-BE(2)细胞中,SK-siIGF2BP3 组、SK-siNC 组、SK-Control 组细胞凋亡 率分别 为21.87% ± 0.92%、8.65% ± 1.04%、5.79% ± 0.33%,SK-siIGF2BP3 组细胞凋亡率高于SK-Control 组(P=0.001)和SK-siNC 组(P=0.006)。在IMR-32 细胞中,IMR-IGF2BP3 组、IMR-Vector 组、IMR-Control 组细胞凋亡率分别为5.65% ± 0.12%、6.74% ± 0.30%、7.72% ± 0.55%,IMR-IGF2BP3 组细胞凋亡率低于IMR-Control 组(P=0.03)和IMRVector组(P=0.024)。
2.4 各组E-cadherin、N-cadherin和Vimentin相对表达量比较 SK-N-BE(2)和IMR-32 细胞中3 组侵袭相关蛋白表达电泳图见图3。SK-N-BE(2)细胞中,SK-siIGF2BP3 组N-cadherin、Vimentin、E-cadherin 蛋白相对表达量分别为0.16 ± 0.06、0.15 ± 0.07、0.76 ± 0.27;SK-siNC 组N-cadherin、Vimentin、Ecadherin 蛋 白 相 对 表 达 量 分 别 为0.71 ± 0.25、0.74 ± 0.26、0.11 ± 0.10;SK-Control 组N-cadherin、Vimentin、E-cadherin 蛋白相对表达量分别为0.68 ±0.15、0.83 ± 0.31、0.13 ± 0.08。 在IMR-32 细胞中,IMR-IGF2BP3 组N-cadherin、Vimentin、E-cadherin 蛋白相对表达量分别为0.86 ± 0.26、0.97 ±0.33、0.14 ± 0.05,IMR-Vector 组N-cadherin、Vimentin、E-cadherin 蛋白相对表达量分别为0.19 ± 0.08、0.17 ± 0.13、0.87 ± 0.31,IMR-Control 组N-cadherin、Vimentin、E-cadherin 蛋白相对表达量分别为0.21 ± 0.11、0.19 ± 0.12、0.89 ± 0.32。在SK-N-BE(2)细胞中,与SK-siNC组及SK-Control组比较,SK-si-IGF2BP3组中N-cadherin、Vimentin蛋白相对表达量下降,E-cadherin 蛋白相对表达量上升;在IMR-32 细胞 中,与IMR-Vector 组、IMR-Control 组 比 较,IMR-IGF2BP3组N-cadherin和Vimentin蛋白相对表达量升高,E-cadherin的蛋白相对表达量下降。
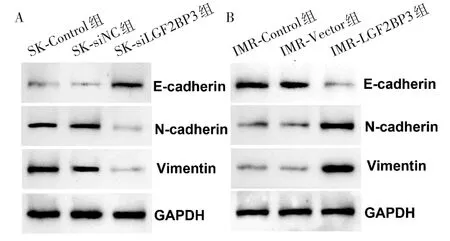
图3 SK-N-BE(2)和IMR-32细胞中3组侵袭相关蛋白表达电泳图
3 讨论
RNA m6A 修饰最终是由m6A 结合蛋白readers识别,并决定目标RNA 分子的表达趋势,影响着下游一系列的分子、信号通路及生物学功能[11]。IGF2BPs 作为RNA 结合蛋白(RBP)的一种,是由IGF2BP1-3 组成[12]。近年研究[13]显示IGF2BP3 可以通过稳定发生甲基化的癌基因mRNA,促进肿瘤的发生发展。NB的重要特征是它的异质性,其治疗需要根据危险度分组制定整体的治疗方案[14]。IGF2BP3在调控肿瘤细胞生物学表型方面起重要作用。为了阐明IGF2BP3在NB细胞中发挥的具体作用,我们着重研究了IGF2BP3 在体外实验中所表现出的对NB细胞侵袭和凋亡的影响;另外我们还对IGF2BP3 与侵袭相关的分子标记物的关系做了相关的探索。
首先我们分析了不同NB 细胞株中IGF2BP3 的表达水平,发现在4 株NB 细胞中,IGF2BP3 mRNA和蛋白在SK-N-BE(2)细胞中相对表达量最高,在IMR-32 细胞的相对表达量最低。接着我们通过细胞侵袭实验发现,IGF2BP3 表达水平高的SK-N-BE(2)细胞侵袭力最强,而IGF2BP3 表达水平低的IMR-32 细胞侵袭力较弱。以上的实验结果提示,IGF2BP3 的IGF2BP3 表达水平与NB 细胞的侵袭能力相关,这与IGF2BP3 在某些成人肿瘤中的报道结果有相似的趋势。 IGF2BP3 表达水平上调,提高了结肠癌的侵袭能力,是结肠癌进展和预后不良的独立预测因子[15];IGF2BP3 促进乳腺癌的肿瘤细胞转移,与患者不良预后有关[16]。接下来,在GF2BP3 表达水平高且体外侵袭能力强的SK-N-BE(2)细胞中通过设计的siRNA 下调了IGF2BP3 的表达;通过IGF2BP3 蛋白的细胞免疫荧光实验,我们非常直观地看到转染siIGF2BP3质粒后,IGF2BP3蛋白表达下降了;相反,在侵袭能力较弱的IMR-32 细胞中转染IGF2BP3的过表达质粒,通过细胞免疫荧光实验,我们看到IGF2BP3 蛋白表达提高了,说明干扰实验成功。接着,我们通过Transwell 实验和流式细胞术证实,敲减IGF2BP3表达后的SK-N-BE(2)细胞体外侵袭能力减弱,凋亡加速;过表达IGF2BP3 的IMR-32细胞侵袭能力提高,凋亡水平降低。既往亦有文献[17-18]报道,凋亡相关通路的关键分子受到IGF2BP3的调控,从而能够改变细胞凋亡的进程,影响肿瘤细胞的微环境。
上皮间质转化(EMT)是恶性肿瘤转移和侵袭的重要机制之一,使细胞获得移动性,能够向远处迁移扩散[19]。它的特点是N-cadherin 上调和E-cadherin下调,具体的过程受到复杂的信号通路网络和转录因子的调控[20],NB同样也具有迁移、侵袭、转移等恶性肿瘤的重要特点。最后,我们通过Western blotting 实验证实,敲减IGF2BP3 表达后的SK-N-BE(2)细胞,侵袭相关的分子标记物N-cadherin和Vimentin蛋白相对表达量降低,E-cadherin 蛋白相对表达量增加;相反,在IMR-32 细胞中通过增加IGF2BP3 的表达,侵袭相关的分子标记物N-cadherin和Vimentin蛋白的相对表达量升高,E-cadherin 蛋白的相对表达量降低;以上实验结果进一步证明IGF2BP3在NB细胞的侵袭过程中发挥着重要作用。
MYCN 作为MYC 癌基因家族的成员,控制多种细胞生物学过程,在NB 的分化、增殖、存活、自我更新、代谢、转移和血管生成等过程中发挥着重要的调控作用[21]。大约25%的NB 患者会出现来自2p24的MYCN 癌基因扩增,它是一种公认的肿瘤侵袭标记物[22-23]。先前的研究已经发现,在MYC编码区的3'端存在一个长度约250个核苷酸的顺式作用元件,称为编码区不稳定决定簇(CRD),它能够被IGF2BPs识别并结合,并提高MYC mRNA的稳定性,维持肿瘤的高侵袭力[24]。我们推测,IGF2BP3可能是通过类似的识别并结合机制,促进NB细胞的侵袭。
总之,我们的研究首次报道了IGF2BP3 可以促进NB 细胞侵袭、抑制细胞凋亡, IGF2BP3 在NB 中发挥着癌基因的作用。进一步研究IGF2BP3在维持NB细胞恶性生物学表型中的作用机制,可能为高危NB的诊断和治疗提供新的潜在靶点。

