血根碱在小鼠烟曲霉菌性角膜炎中的抗炎作用
鲁叶慧 栾军杰 刘星 吴瑗 林静

[摘要] 目的 探索血根堿(SAN)在小鼠烟曲霉菌感染角膜炎模型中的抗炎作用。方法 应用CCK-8实验检测不同浓度SAN(0、62.5、125.0、250.0、500.0、1 000.0 μg/L)对小鼠来源巨噬细胞(RAW264.7)增殖活力的影响;制备小鼠烟曲霉菌角膜炎模型,取感染第3天眼球,应用苏木精-伊红(HE)染色检测小鼠角膜组织炎症细胞浸润程度,ELISA法检测小鼠角膜组织肿瘤坏死因子α(TNF-α)及环氧化酶2(COX-2)的蛋白表达水平;采用RT-PCR和ELISA方法检测巨噬细胞中白细胞介素1β(IL-1β)、白细胞介素6(IL-6)、TNF-α及单核细胞趋化蛋白(MCP-1)的蛋白和mRNA的表达。结果 500.0 μg/L的SAN对RAW264.7细胞活性无影响(F=0.292,P>0.05);HE染色显示,500.0 μg/L SAN组小鼠角膜组织炎症细胞浸润相较于模型组明显减少;500.0 μg/L SAN可显著下调烟曲霉菌诱导的RAW264.7细胞中IL-1β、IL-6、TNF-α、MCP-1的mRNA和蛋白表达及小鼠模型中TNF-α、COX-2的蛋白表达水平,差异均有显著性(F=20.939~2 690.170,P<0.01)。结论 SAN通过抑制炎症细胞浸润和下调炎症递质的表达在烟曲霉菌感染中发挥抗炎作用。
[关键词] 血根碱;巨噬细胞;小鼠;炎症;烟曲霉菌
[中图分类号] R392;R379.6
[文献标志码] A
[文章编号] 2096-5532(2023)04-0507-06
doi:10.11712/jms.2096-5532.2023.59.113
[网络出版] https://link.cnki.net/urlid/37.1517.R.20230918.1620.001;2023-09-20 10:53:36
ANTI-INFLAMMATORY EFFECT OF SANGUINARINE AGAINST MOUSE ASPERGILLUS FUMIGATUS KERATITIS LU Yehui, LUAN Junjie, LIU Xing, WU Yuan, LIN Jing (Department of Ophthalmology, The Affiliated Hospital of Qingdao University, Qingdao 266003, China)\; [ABSTRACT] Objective To explore the anti-inflammatory effect of sanguinarine (SAN) in a mouse model of Aspergillus (A.) fumigatus keratitis. Methods The effects of SAN at different concentrations (0, 62.5, 125.0, 250.0, 500.0, 1 000.0 μg/L) on the proliferative activity of mouse-derived macrophages (RAW264.7) were determined by using Cell Counting Kit-8. A mouse model of A.fumigatus keratitis was prepared. The eyes were taken on the third day of infection. The degree of inflammatory cell infiltration in the mouse cornea was determined with hematoxylin-eosin (HE) staining. The protein expression of tumor necrosis factor-α (TNF-α) and cyclooxygenase-2 (COX-2) in the cornea was measured by enzyme-linked immunosorbent assay (ELISA). The mRNA and protein expression levels of interleukin 1β (IL-1β), interleukin 6 (IL-6), TNF-α, and monocyte chemotactic protein-1 (MCP-1) in macrophages were measured by RT-PCR and ELISA. Results SAN at 500.0 μg/L had no significant effect on the activity of RAW264.7 cells (F=0.292,P>0.05). HE staining revealed a significant decrease in inflammatory cell infiltration in the cornea in the SAN (500.0 μg/L) group compared with the model group; SAN at 500.0 μg/L significantly down-regulated the mRNA and protein expression of IL-1β, IL-6, TNF-α, and MCP-1 in A.fumigatus-induced RAW264.7 cells and the protein le-vels of TNF-α and COX-2 in the mouse model (F=20.939-2 690.170,P<0.01). Conclusion SAN exerted anti-inflammatory effects against A.fumigatus infection via inhibiting inflammatory cell infiltration and down-regulating the expression of inflammatory mediators.
[KEY WORDS] sanguinarine; macrophages; mice; inflammation; Aspergillus fumigatus
真菌性角膜炎是一种严重的角膜感染性疾病,在亚洲和非洲等发展中国家发病率高[1]。丝状真菌如烟曲霉菌和镰刀菌是诱发真菌性角膜炎的主要原因,一旦其分生孢子透过角膜上皮进入到基质,孢子会迅速萌发,诱发症状。目前,真菌性角膜炎的一线治疗是局部使用那他霉素、伏立康唑、两性霉素B等药物[2],但这些药物存在水溶性差、渗透性差及严重的不良反应,因此亟待开发可用于临床的低毒高效的治疗药物。血根碱(SAN)为一种季铵盐类苯并菲啶生物碱,是来源于血根草、大白屈菜和博落回的一类重要的天然异喹啉生物碱[3-4]。 SAN具有多种药理活性,包括抗肿瘤、抗菌、抗炎和改善心血管功能等[5-9]。最近的研究显示,在大鼠的神经源性疼痛模型中,SAN可以通过抑制白细胞介素1β(IL-1β)、白细胞介素6(IL-6)等炎症因子的表达来减轻疼痛[10-12]。SAN在急、慢性炎症中发挥抗炎作用。但是SAN能否在真菌性角膜炎中发挥抗炎作用尚未见报道。本研究旨在探讨SAN对烟曲霉菌感染的巨噬细胞及小鼠角膜炎症的调节作用,为治疗真菌性角膜炎提供一种新思路。
1 材料和方法
1.1 实验材料
小鼠来源的RAW264.7巨噬细胞系购于中国科学院细胞库(上海)。实验所用40只8周大小健康的C57BL/6雌鼠购于山东济南朋悦有限公司,体质量20~30 g,按照青岛大学附属医院动物委员会批准的方案饲养。SAN(100 mg,纯度98%)由麦克林试剂公司提供,用体积分数0.001的DMSO溶解后以2 g/L储备液-20 ℃储存;RNAex pro reagent裂解液(艾科瑞生物工程有限公司);酶联免疫吸附试验(ELISA)检测试剂盒(Biolegend公司);苏木精-伊红(HE)染色试剂盒(碧云天,中国);烟曲霉菌(CPCC 3.0772,中国普通微生物菌种保藏管理中心(北京))。
1.2 研究方法
1.2.1 烟曲霉菌丝制备 烟曲霉菌丝及灭活烟曲霉菌丝制备方法基于本实验室原有步骤,进行优化[13]。将烟曲霉标准菌株接种于酵母膏胨葡萄糖培养液(葡萄糖10 g、蛋白胨100 g、酵母5 g溶解于双蒸水中定容1 L),置35 ℃培养箱孵育4~7 d后于超净工作台研磨菌丝至20~30 μm大小,一半经3次离心后重悬,用DMEM稀释至1×1011CFU/L;另一半浸泡于体积分数0.75乙醇中,24 h后重复前述步骤,获得灭活烟曲霉菌用于后续实验。
1.2.2 CCK-8实验检测SAN对RAW264.7细胞活力的影响 RAW264.7细胞以4×108CFU/L接种于96孔板中,孵育12 h至细胞密度约70%更换含SAN(浓度分别为0、62.5、125.0、250.0、500.0、1 000.0 μg/L)培养液,继续孵育24 h后,以无菌PBS洗涤3次,更换含CCK-8的培养液继续孵育2 h后,使用酶标仪(PerkinElimer, 美国)测各孔450、600 nm波长处的吸光度值。每个样本设5个复孔,实验重复3次。
1.2.3 小鼠分组及处理 32只健康小鼠随机分为N组、500.0 μg/L SAN处理组(SAN组)、AF处理组及AF+500.0 μg/L SAN处理组(AS组),每组8只,每只小鼠的右眼为实验眼,左眼为空白对照眼。建模:AF组和AS组小鼠腹腔注射80 g/L水合氯醛约0.08 mL后,用手术无菌刀片刮除中央角膜上皮形成约2 mm×2 mm缺损区域,做井字划痕、涂抹煙曲霉菌、覆盖光滑的角膜接触镜并缝合眼睑,24 h后拆除缝线。N组和AF组小鼠以双蒸水点眼治疗,每次5 μL,每天4次;SAN组和AS组小鼠以500.0 μg/L SAN点眼治疗,每次5 μL,每天4次。治疗第3天,以颈椎脱臼法处死小鼠,获得小鼠角膜组织。6只健康小鼠随机分为AF处理组和AS处理组,建模后分别以双蒸水和500.0 μg/L SAN点眼治疗,每次5 μL,每天4次,治疗第3天以颈椎脱臼法处死小鼠,取小鼠眼球。
1.2.4 细胞刺激 RAW264.7细胞接种于12孔板,孵育至细胞密度约80%后换液。将细胞分为N组、SAN组、AF组、AS组,AF组及AS组每孔加入60 μL灭活烟曲霉菌丝,2 h后SAN组及AS组加入SAN溶液使SAN终浓度为500.0 μg/L,8 h后收集细胞样本用于细胞RT-PCR实验(每组6孔); 24 h后收集细胞上清液,离心后取上清液用于细胞ELISA检测(每组8孔)。
1.2.5 HE染色检测小鼠角膜中炎症细胞的浸润AS处理组(n=3)和AF处理组(n=3)的眼球分别在含OCT包埋剂的EP管(2 mL)中调整至合适位置后迅速液氮冻存,使用Leica冷冻切片机切取角膜中央最大截面处8 μm厚的角膜切片。应用HE染色试剂盒染色,按说明书方法进行操作,自然晾干后中性树胶封片。光学显微镜下观察小鼠角膜中炎症细胞浸润情况。
1.2.6 实时荧光定量PCR(RT-PCR)检测细胞因子的mRNA表达 细胞中加入RNAex pro reagent裂解液后,在冰上裂解0.5 h,用无菌的200 μL黄枪头刮取细胞收集至2 mL的 EP管中,根据RNAex pro reagent试剂说明书进行逆转录,建立2 μg逆转录反应体系。使用RT-PCR仪进行扩增反应,以β-actin为内参,检测巨噬细胞中IL-1β、IL-6、TNF-α及单核细胞趋化蛋白(MCP-1)的mRNA表达。引物及其序列来自GenBank,由艾科瑞生物有限公司设计及合成。见表1。
1.2.7 相关蛋白表达检测 应用ELISA试剂盒检测小鼠RAW264.7细胞中IL-1β、IL-6、TNF-α以及MCP-1及小鼠角膜组织中TNF-α和COX-2的蛋白表达,根据试剂盒说明书方法进行实验。使用酶标仪检测450 nm及570 nm波长处吸光度。
1.3 统计学方法
使用SPSS 26.0、Graph Pad Prism 9.0软件进行统计学处理。计量资料结果以±s表示,多组比较采用单因素方差分析及双因素析因方差分析,组间两两比较采用Tukey法。以P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度SAN溶液对巨噬细胞活力的影响
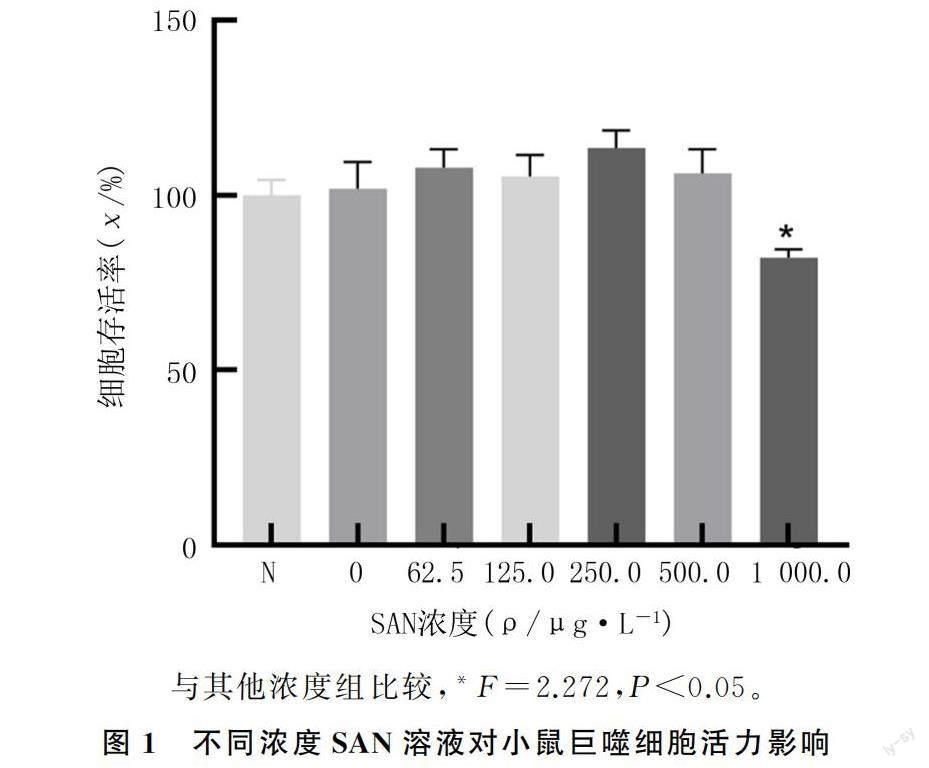
不同浓度的SAN(0、62.5、125.0、250.0、500.0、1 000.0 μg/L)与RAW264.7细胞共孵育24 h后,1 000.0 μg/L SAN溶液处理组巨噬细胞的存活率低于其他各组,差异有统计学意义(F=2.272,P<0.05)。500.0 μg/L浓度以内的SAN处理组的细胞存活率与正常对照组比较差异无统计学意义(P>0.05)。见图1。后续实验选择500.0 μg/L作为研究浓度。
2.2 烟曲霉菌对小鼠角膜组织中炎症细胞浸润的影响
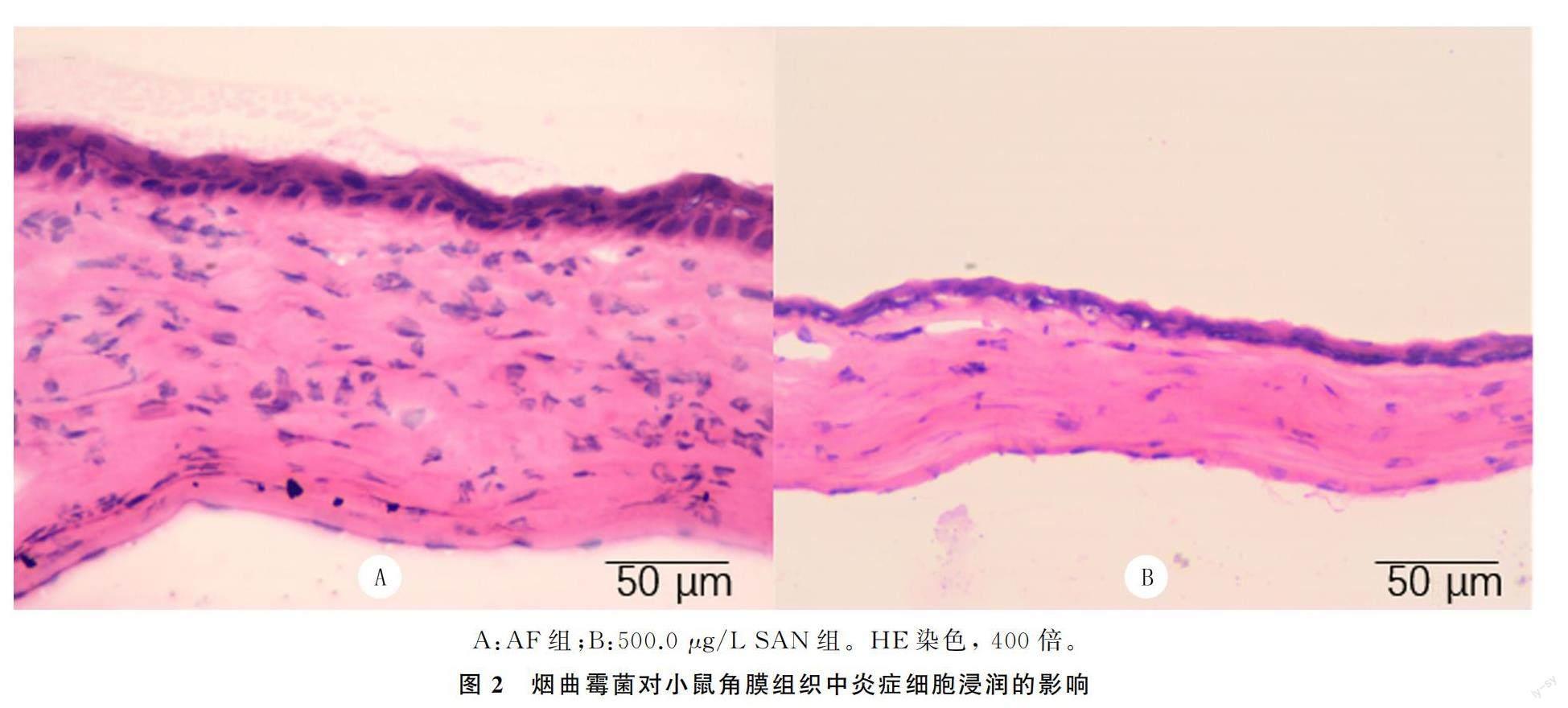
HE染色观察结果显示,感染烟曲霉菌3 d后,500.0 μg/L SAN组和AF组相比,小鼠角膜基质层水肿明显减轻,炎症细胞数量显著减少,组织病理结构更为有序(图2)。
2.3 各组细胞中IL-1β、IL-6、TNF-α以及MCP-1 mRNA 表达水平比较
析因设计的方差分析结果显示,灭活菌丝处理产生的单独效应(FAF=131.211~253.824,P<0.01)、SAN处理产生的单独效应(FSAN=28.794~119.300,P<0.01)、不同灭活菌丝处理组间(F=141.468~360.577,P<0.01)和不同SAN处理组间(F=10.373~18.560,P<0.01)差异均有统计学意义,灭活菌丝处理与SAN处理之间存在交互作用(FAF×SAN=10.566~18.536,P<0.01)。与N组和SAN组相比较,AF组细胞炎症递质IL-1β、IL-6、TNF-α和MCP-1的mRNA表达水平明显升高;与AF组相比,AS组炎症递质IL-1β、IL-6、TNF-α和MCP-1的mRNA表达水平明显下降,差异均有统计学意义(F=20.939~37.097,P<0.01)。见表2。
2.4 各组细胞中IL-1β、IL-6、TNF-α和MCP-1 蛋白表达水平比较
析因设计的方差分析结果显示,灭活菌丝处理产生的单独效应(FAF=1 765.400~6 636.850,P<0.01)、SAN处理产生的单独效应(FSAN=98.002~3 070.111,P<0.01)、不同灭活菌丝处理组间(F=1 490.936~9 367.445,P<0.01)和不同SAN处理组间(F=63.775~1 347.574,P<0.01)差异均具有统计学意义,灭活菌丝处理与SAN处理存在交互作用(FAF×SAN=61.187~1 342.599,P<0.01)。与N组和SAN组相比,AF组中炎症递质IL-1β、IL-6、TNF-α和MCP-1的蛋白表达水平明显上调;AS组与AF组相比,炎症递质IL-1β、IL-6、TNF-α和MCP-1的蛋白表达水平明显降低,差异有统计学意义(F=124.949~2 690.170,P<0.01)。见表3。
2.5 各组小鼠角膜中TNF-α和COX-2 蛋白表达水平比较
析因设计的方差分析显示,灭活菌丝处理產生的单独效应(FAF=1 207.798、1 569.370,P<0.01)、SAN处理产生的单独效应(FSAN=75.086、260.364,P<0.01)、不同灭活菌丝处理组间(F=942.588、1 554.091,P<0.01)和不同SAN处理组间(F=295.009、356.222,P<0.01)的差异均有显著性,灭活菌丝处理与SAN处理有交互作用(FAF×SAN=275.643、340.296,P<0.01)。与N组和SAN组相比较,AF组小鼠感染烟曲霉菌3 d后,炎症递质TNF-α和COX-2蛋白表达水平明显升高;AS组与AF组相比,小鼠感染烟曲霉菌3 d后,炎症递质TNF-α和COX-2的蛋白表达水平明显降低,差异有显著性(F=570.488、696.427,P<0.01)。见表4。
3 讨论
真菌性角膜炎是由致病真菌诱导的严重眼部感染性疾病,其致病因素中植物划伤引起的角膜损伤约占40%~60%[14],另外隐形眼镜的使用[15]、长期使用抗生素或类固醇[16]、既往眼部手术史[17]都是重要的致病因素。当烟曲霉菌首次攻击宿主时,其毒力决定簇诱发宿主发生强烈的固有免疫反应[10],固有免疫系统包括巨噬细胞、中性粒细胞和树突状细胞等,是抵御真菌感染的第一道防线;它能够快速启动并消除入侵的烟曲霉菌[11]。这种防御机制涉及特异性受体的识别、指示信号通路的激活和多种炎症递质的产生,从而加强炎症反应。但是大量的炎症递质可引发严重的炎症反应,会加重感染组织的损伤,使真菌感染的病程延长,产生一系列危险的并发症如角膜穿孔甚至患眼失明[12]。真菌性角膜炎的发病率逐渐增高,且临床缺乏有效治疗药物,迫切需要找到新的高效低毒治疗药物。
SAN是一种以苯并菲啶结构为特征的生物碱类天然小分子,具有高效抗炎[18-19]、抗菌[4,7,20]、抗腫瘤[21]等药理活性。已有研究表明,在大鼠LPS介导的H9c2心肌细胞炎症反应中,SAN可以通过抑制大鼠H9c2心肌细胞释放炎症递质IL-1β、IL-6和TNF-α发挥抗炎作用[22]。此外有研究显示,在LPS诱导的小鼠巨噬细胞内毒性休克模型中,SAN通过抑制小鼠巨噬细胞释放TNF-α及NO发挥抗炎作用[18]。然而,SAN在真菌性角膜炎中是否发挥抗炎作用尚未有报道。炎症从本质上说是机体的防御反应,在初期往往起到积极作用,例如炎性充血可增加局部组织血流量,使组织得到更多的氧气、营养物质等,增加组织代谢和抗击力[23]。但持续的炎症反应使得巨噬细胞产生过量的炎症递质,可能加重角膜损伤;还会导致角膜蛋白沉积,造成角膜水肿甚至角膜穿孔。本研究首先探究SAN在小鼠巨噬细胞中的安全浓度,结果表明500.0 μg/L SAN对小鼠巨噬细胞没有影响,可作为安全浓度用于后续实验。本文研究感染第3天的小鼠角膜组织HE染色结果显示,500.0 μg/L SAN组和AF组相比,小鼠角膜基质层水肿明显减轻,炎症细胞数量显著减少,组织病理结构更为有序。ZHENG等[24]研究显示,在LPS诱导的小鼠乳腺炎模型中,SAN通过显著减少LPS引起的中性粒细胞浸润、减轻腺泡结构的破坏,进而修复血-乳屏障发挥抗炎功能。本文研究结果与其一致。因此,SAN可能通过抑制炎症反应中的免疫细胞过度激活,对烟曲霉菌性角膜炎起到治疗作用。
在真菌性角膜炎中,炎症细胞过度激活会导致大量的炎症递质释放加重炎症反应[25]。已有研究证实,IL-1β是参与角膜抗真菌免疫应答的重要炎症因子,主要由激活的单核细胞产生,介导急性炎症应答[26]。在右旋糖酐硫酸钠诱导的小鼠溃疡性结肠炎模型中,SAN通过阻断NLRP3-(Caspase-1)/IL-1β通路,降低炎症因子IL-1β的表达,对小鼠结肠炎具有治疗作用[27]。本研究结果显示,SAN能够明显抑制小鼠RAW264.7细胞中烟曲霉菌刺激引起的IL-1β基因及蛋白表达升高。提示SAN可能通过抑制IL-1β的表达发挥抗炎作用。炎症因子TNF-α、IL-6及趋化因子MCP-1为反映角膜炎症的重要指标,TNF-α、IL-6和MCP-1的表达升高可以介导白细胞募集和巨噬细胞迁移及浸润[28]。LIN等[29]研究显示,在吲哚美辛诱导的大鼠肠道炎症模型中,SAN可以通过降低大鼠肠道组织中TNF-α和IL-6的水平发挥抑炎作用。有研究显示,在LPS刺激的人单核细胞白血病THP-1细胞系中,SAN可以通过下调炎症递质IL-1β、MCP-1和IL-6的基因表达发挥保护作用[30]。本文实验结果显示,SAN能显著减少烟曲霉菌刺激的小鼠巨噬细胞中IL-6、TNF-α和MCP-1的表达。另有研究显示,在真菌感染宿主后,宿主体内的单核巨噬细胞等会迅速诱导COX-2的表达增加,导致下游的抑炎因子表达被抑制,对角膜炎的预后造成不利影响[31]。本文对真菌性角膜炎小鼠模型研究显示,SAN能显著下调COX-2及TNF-α的表达。LI等[19]研究显示,在LPS诱导的小鼠急性肺损伤模型中,SAN通过抑制COX-2的表达抑制炎症细胞因子的释放,进而抑制炎症反应,降低急性肺损伤小鼠的致死率。本文研究结果与其相一致。因此,应用SAN治疗也可以通过减轻真菌性角膜炎中炎症递质的过度表达,从而改善真菌性角膜炎的预后。
综上所述,SAN可以通过减少炎症细胞的浸润和下调炎症递质的表达,减轻小鼠角膜烟曲霉菌感染后的炎症反应,有望成为治疗真菌性角膜炎的新型药物。但SAN在真菌性角膜炎中的具体抗炎机制还需要进一步研究。
[参考文献]
[1]RATITONG B, PEARLMAN E. Pathogenic Aspergillus and Fusarium as important causes of blinding corneal infections-the role of neutrophils in fungal killing, tissue damage and cytokine production[J]. Current Opinion in Microbiology, 2021,63:195-203.
[2]SAHAY P, SINGHAL D, NAGPAL R, et al. Pharmacologic therapy of mycotic keratitis[J]. Survey of Ophthalmology, 2019,64(3):380-400.
[3]GAZIANO R, MORONI G, BU C, et al. Antitumor effects of the benzophenanthridine alkaloid sanguinarine: evidence and perspectives[J]. World Journal of Gastrointestinal Oncology, 2016,8(1):30-39.
[4]ZHONG H, HU D D, HU G H, et al. Activity of sanguinarine against Candida albicans biofilms[J]. Antimicrobial Agents and Chemotherapy, 2017,61(5):e02259-e02216.
[5]LI B, LUO Y B, ZHOU Y X, et al. Role of sanguinarine in regulating immunosuppression in a Lewis lung cancer mouse model[J]. International Immunopharmacology, 2022,110:108964.
[6]MESSEHA S S, ZARMOUH N O, ANTONIE L, et al. Sanguinarine inhibition of TNF-α-induced CCL2, IKBKE/NF-κB/ERK1/2 signaling pathway, and cell migration in human triple-negative breast cancer cells[J]. International Journal of Molecular Sciences, 2022, 23(15):8329.
[7]ANJAGO W M, ZENG W L, CHEN Y X, et al. The molecular mechanism underlying pathogenicity inhibition by sanguinarine in Magnaporthe oryzae[J]. Pest Management Science, 2021,77(10):4669-4679.
[8]FU Y T, LIU W T, LIU M, et al. In vitro anti-biofilm efficacy of sanguinarine against carbapenem-resistant Serratia mar-cescens[J]. Biofouling, 2021,37(3):341-351.
[9]YU C, LI P, WANG Y X, et al. Sanguinarine attenuates neuropathic pain by inhibiting P38 MAPK activated neuroinflammation in rat model[J]. Drug Design, Development and The-rapy, 2020,14:4725-4733.
[10]LIU X, YOU J, PENG X D, et al. Mammalian Ste20-like kinase 4 inhibits the inflammatory response in Aspergillus fumigatus keratitis[J]. International Immunopharmacology, 2020,88:107021.
[11]TONG J B, DUAN Z M, ZENG R, et al. miR-146a negatively regulates Aspergillus fumigatus-induced TNF-α and IL-6 secretion in THP-1 macrophages[J]. Mycopathologia, 2021,186(3):341-354.
[12]LUAN J J, PENG X D, LIN J, et al. The therapeutic potential of chondroitin sulfate in Aspergillus fumigatus keratitis[J]. Molecular Immunology, 2022,147:50-61.
[13]MA S Q, WANG Q, XU Q, HE M T, LIN J. Protective effect of hinokitiol against aspergillus fumigatus keratitis and related mechanism[J]. Journal of Precision Medicine, 2022,37(6):490-498.
[14]MAHMOUDI S, MASOOMI A, AHMADIKIA K, et al. Fungal keratitis: an overview of clinical and laboratory aspects[J]. Mycoses, 2018,61(12):916-930.
[15]CHEUNG N N, CHENG Y Y Y, VAN DUINEN S G, et al. Contact lens-related fungal keratitis[J]. The Lancet Infectious Diseases, 2020, 20(9):1100.
[16]FAN Y Q, LI C, PENG X D, et al. Perillaldehyde ameliorates Aspergillus fumigatus keratitis by activating the Nrf2/HO-1 signaling pathway and inhibiting dectin-1-mediated inflammation[J]. Investigative Ophthalmology & Visual Science, 2020,61(6):51.
[17]BROWN L, LECK A K, GICHANGI M, et al. The global incidence and diagnosis of fungal keratitis[J]. The Lancet Infectious Diseases, 2021, 21(3):e49-e57.
[18]NIU X F, FAN T, LI W F, et al. The anti-inflammatory effects of sanguinarine and its modulation of inflammatory mediators from peritoneal macrophages[J]. European Journal of Pharmacology, 2012,689(1-3):262-269.
[19]LI W F, LI H N, MU Q L, et al. Protective effect of sanguinarine on LPS-induced endotoxic shock in mice and its effect on LPS-induced COX-2 expression and COX-2 associated PGE2 release from peritoneal macrophages[J]. International Immunopharmacology, 2014, 22(2):311-317.
[20]HUANG H B, YAO J Y, LIU K, et al. Sanguinarine has anthelmintic activity against the enteral and parenteral phases of trichinella infection in experimentally infected mice[J]. Acta Tropica, 2020, 201:105226.
[21]CUI Y J, LUO Y B, QIAN Q H, et al. Sanguinarine regulates tumor-associated macrophages to prevent lung cancer angiogenesis through the WNT/β-catenin pathway[J]. Frontiers in Oncology, 2022,12:732860.
[22]MENG Y Y, LIU Y, HU Z F, et al. Sanguinarine attenuates lipopolysaccharide-induced inflammation and apoptosis by inhibiting the TLR4/NF-κB pathway in H9c2 cardiomyocytes[J]. Current Medical Science, 2018,38(2):204-211.
[23]ZHU Y N, PENG X D, ZHANG Y X, et al. Baicalein protects against Aspergillus fumigatus keratitis by reducing fungal load and inhibiting TSLP-induced inflammatory response[J]. Investigative Ophthalmology & Visual Science, 2021,62(6):26.
[24]ZHENG Z J, ZHENG Y H, LIANG X B, et al. Sanguinarine enhances the integrity of the blood-milk barrier and inhibits oxidative stress in lipopolysaccharide-stimulated mastitis[J]. Cells, 2022,11(22):3658.
[25]YANG H, WANG Q, HAN L, et al. Nerolidol inhibits the LOX-1/IL-1β signaling to protect against the Aspergillus fumigatus keratitis inflammation damage to the cornea[J]. International Immunopharmacology, 2020,80:106118.
[26]THWE P M, FRITZ D I, SNYDER J P, et al. Syk-dependent glycolytic reprogramming in dendritic cells regulates IL-1β production to β-glucan ligands in a TLR-independent manner[J]. Journal of Leukocyte Biology, 2019,106(6):1325-1335.
[27]LI X D, WU X, WANG Q, et al. Sanguinarine ameliorates DSS induced ulcerative colitis by inhibiting NLRP3 inflammasome activation and modulating intestinal microbiota in C57BL/6 mice[J]. Phytomedicine: International Journal of Phytotherapy and Phytopharmacology, 2022,106:154394.
[28]TACKE F. Targeting hepatic macrophages to treat liver diseases[J]. Journal of Hepatology, 2017,66(6):1300-1312.
[29]LIN X L, SHI Y N, CAO Y L, et al. Sanguinarine protects against indomethacin-induced small intestine injury in rats by regulating the Nrf2/NF-κB pathways[J]. Frontiers in Pharmacology, 2022,13:960140.
[30]P?N??KOV?K, KOLL?R P, M?LLER Z?VALOV? V, et al. Investigation of sanguinarine and chelerythrine effects on LPS-induced inflammatory gene expression in THP-1 cell line[J]. Phytomedicine: International Journal of Phytotherapy and Phytopharmacology, 2012,19(10):890-895.
[31]LI N, CHE C Y, HU L T, et al. Effects of COX-2 inhibitor NS-398 on IL-10 expression in rat fungal keratitis[J]. International Journal of Ophthalmology, 2011,4(2):165-169.
(本文編辑 黄建乡)
青岛大学学报(医学版)2023年4期
