植物中异戊烯基取代的酚类化合物及其分布
王圆月,落艳娇,张译心,申国安,郭宝林
(中国医学科学院 北京协和医学院药用植物研究所,北京 100193)
植物中存在一些具有异戊烯基修饰的酚类化合物,其结构修饰来自于UbiA(ubiquinone biosynthesis gene A)家族异戊烯基转移酶(Prenyltransferase,PT),该酶负责将异戊二烯焦磷酸,包括二甲基烯丙基焦磷酸(dimethylallyl diphosphate,DMAPP,C5)、香叶基焦磷酸(geranyl diphosphate,GPP,C10)、法尼基焦磷酸(farnesyl diphosphate,FPP,C15)和香叶基香叶基焦磷酸(geranylgeranyl diphosphate,GGPP,C20)等供体转移到酚类母核受体上[1],在这一类次生代谢产物形成过程中发挥着重要作用。Young等[2]首次在大肠杆菌研究中推测其中的UbiA可以催化对羟基苯甲酸(p-hydroxybenzoic acids,PHB)与异戊烯基侧链生成3-辛异戊烯基-4-羟基苯甲酸。在植物中首次从豆科植物苦参(Sophoraflavescens)中克隆得到了异戊烯基转移酶基因SfN8DT-1[3]。迄今已经发现32个植物来源的芳香族异戊烯基转移酶,是当前植物次生代谢功能基因及合成生物学研究的热点之一[4]。
芳香族化合物的异戊烯基化,可以增加这些化合物的亲脂性,从而使化合物分子与生物膜的亲和力增强,改善药物代谢和药物动力学特性。大量的研究表明,类黄酮引入异戊烯基后,生物活性得到显著提高[5-6]。Zhang等[7]比较了染料木素(genistein)和8-异戊烯基染料木素的抗骨质疏松活性,结果表明染料木素不刺激成骨样细胞UMR106生长,而8-异戊烯基染料木素显著促进该细胞生长10%~23%。Miranda等[8]从啤酒花中提取的异戊烯基查耳酮和异戊烯基二氢黄酮可诱导小鼠肝癌Hepa1c1c7细胞醌还原酶(QR)活性,而没有异戊烯基取代的化合物未能有效诱导QR活性。Sasaki团队证明了异戊烯基黄酮类化合物可有效抑制毛癣菌属,最低抑菌浓度(MIC)为1.95 mg/mL,低于不含异戊烯基的黄酮类化合物(7.8 mg/mL)[9]。香豆素类化合物中异戊烯基的存在可使相关化合物的生物活性(如抗菌、降血压、抗癌和抗HIV等)显著提高[10-11]。又如橙皮油素(7-geranyloxycoumarin)在实验和临床研究中具有抗炎、抗癌和神经保护等作用,也具有治疗代谢综合征的作用,通过加速脂联素的分泌,摄取脂肪酸来提高胰岛素敏感性,从而达到抗糖尿病的效果[12-14]。异戊烯基取代的二苯乙烯在抗疟原虫和抗氧化等方面具有良好活性[15-16]。因此,对植物中有异戊烯基取代的酚类化合物进行总结,对于发现特殊功能的异戊烯基转移酶,提供新的异戊烯基转移酶功能鉴定时可准确选择供体和受体,实现这类活性成分的生物合成及其开发利用具有重大意义。
Dictionary of Natural Products(DNP)是20世纪30年代问世的唯一全面编辑的天然产物数据库,天然产物信息资源的引领者,包含30多万个天然产物,每年大约新增7 000个,可以通过分子式、分子量、质谱数据和旋光等多种渠道检索已知的天然产物。
本文基于DNP数据库,通过化合物结构和名称检索了2016年之前分离和鉴定的异戊烯基取代的酚类化合物,又查阅文献补充了少数常见但未被DNP数据库收载的化合物。按照酚类的基本结构类型分成了五大类:类黄酮、香豆素、二苯乙烯、醌类和简单酚类。这几类化合物也是植物中主要酚类次生产物,均在植物中分离得到过具有形成异戊烯基取代化合物的异戊烯基转移酶[4]。
在进行结构选取的时候,由于多数情况下,植物中的简单异戊烯基取代和后续修饰(如氧化、环合)的化合物是共存的,有时后修饰成分更为常见,如呋喃香豆素和吡喃香豆素是由异戊烯基取代简单香豆素母核后与7位羟基发生环合形成。本文一般只列出简单异戊烯基取代的情况。此外类黄酮、二苯乙烯类等多以苷类形式存在,一种苷元常有多种糖基取代的苷类,本文也只总结苷元类型,因此本文仅介绍具有结构代表性的538个化合物,包括378个类黄酮、80个香豆素、27个醌类、32个二苯乙烯和21个简单酚类(母核结构见图1),提供了代表性化合物的名称、取代基特点和植物中的分布,其余化合物按照取代基和取代位点分类,将数量统计在表格“化合物数量及文献”一列中。所有化合物根据化合物基本结构类型分类和排列,类黄酮中具有异戊烯基取代的化合物最多,又细分为异黄酮、紫檀烷、二氢黄酮、二氢黄酮醇、查耳酮、黄酮醇和黄酮。每一结构类型先排列单取代,根据异戊烯基取代基类型,分为C5、O-C5、C10、O-C10、C15、O-C15和C20,随后为多取代,如C5+C5、C5+C10和C5+C5+C5等。并总结了各类型代表性化合物的分布情况,列在了表格“分布”一列中。
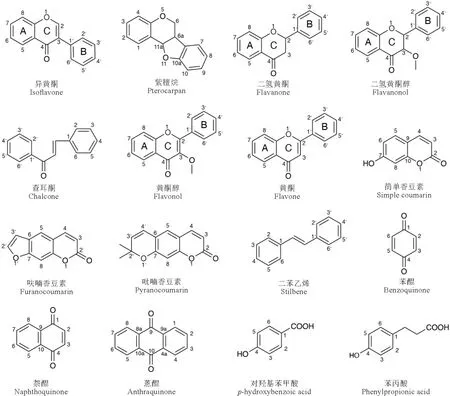
图1 植物中异戊烯基取代的酚类化合物母核结构
1 类黄酮的异戊烯基取代
异戊烯基取代的类黄酮化合物数量以异黄酮(isoflavones)和紫檀烷(pterocarpan)居多,其次是二氢黄酮(flavanones)和查耳酮(chalcones),此外还包括二氢黄酮醇(flavanonols)、黄酮(flavones)和黄酮醇(flavonols)等[17]。
目前发现的异戊烯基类黄酮主要是C-异戊烯基化,而O-异戊烯基化发现较少。异戊烯基主要取代位点为C-8,C-6,C-3′和C-5′位,其他位置还有C-7,C-2′位(紫檀烷类和查耳酮的C编号不同,但取代位点具有类似规律,如紫檀烷类取代位点为C-4,C-2,C-8,C-10和C-6a,查耳酮取代位点为C-3′,C-5′,C-3,C-5和α位,分别对应一般类黄酮的C-8,C-6,C-3′,C-5′和C-3位)。除紫檀烷类不存在O-异戊烯基化,其余类黄酮均存在,且多取代在C-7,C-4′的羟基上(查耳酮取代位点为C-4′,C-4位,分别对应一般类黄酮的C-7,C-4′位)。
1.1 异黄酮
异黄酮母核为3-苯基色原酮,即B环连接在C环的3位上,存在于豆科、苋科、桑科、蔷薇科、鸢尾科和菊科等,但具有异戊烯基取代的异黄酮只发现于豆科、桑科和菊科。豆科中异戊烯基异黄酮的取代类型最多,C-异戊烯基取代基数量可以多达3个,O-异戊烯基取代数量可达2个,O-取代位点主要在C-7和C-4′位羟基上,少量取代在C-3′和C-5位羟基(表1)。

表1 异戊烯基取代的异黄酮
目前,已从豆科植物中鉴定了多个以异黄酮为底物的异戊烯基转移酶,2011年从豆科苦参中鉴定出一个异黄酮异戊烯基转移酶SfG6DT,可催化染料木素和鹰嘴豆芽素A(biochanin A)的C-6位发生异戊烯基化反应,催化染料木素时可接受DMAPP、GPP和FPP供体[18]。从豆科百脉根(Lotuscorniculatus)中鉴定出LjG6DT,以DMAPP为供体,催化染料木素C-6位发生异戊烯基取代,生成怀特酮(wighteone)[19]。从豆科白羽扇豆(Lupinusalbus)中鉴定出LaPT1,催化染料木素与DMAPP反应生成异怀特酮(isowighteone),催化位点为C-3′位[20]。大豆(Glycinemax)中发现GmIDT1、GmIDT2和GmIDT3,均可催化大豆苷元(daidzein)和染料木素的异戊烯基化,并且三者均接受DMAPP供体,GmIDT1催化异戊烯基取代位置在B环,GmIDT2催化异戊烯基取代位置在A环,GmIDT3的异戊烯基取代位置尚不清楚[21-22]。
1.2 紫檀烷
紫檀烷(又称紫檀碱)是在异黄酮结构基础上,C环的4位与B环的6′位环合形成的一类化合物,在豆科植物中广泛存在。紫檀烷类异戊烯基取代位点数量有1~2个,为C5或C10取代,未见有O-异戊烯基取代(表2)。2018年从豆科植物补骨脂(Psoraleacorylifolia)中鉴定出PcM4DT,以DMAPP为异戊烯基供体,可以催化2种紫檀烷(-)-maackiain和3-羟基-9-甲氧基-紫檀碱(3-hydroxy-9-methoxy-pterocarpan)的C-4位(对应一般黄酮的C-8位),分别生成4-dimethylallylmaackiain和licoagrocarpin[34]。从大豆鉴定的GmG2DT(包括GmPT20和GmPT01 2个基因)催化DMAPP与glycinol的C-2位发生异戊烯基化反应,GmG4DT以DMAPP为供体催化glycinol和maackiain的C-4位异戊烯基化[21-22, 35]。

表2 异戊烯基取代的紫檀烷
1.3 二氢黄酮
二氢黄酮为C2-C3是单键的一类黄酮,是黄酮类化合物合成通路的上游化合物,在植物中的分布广泛,具有异戊烯基取代的二氢黄酮分布于豆科、桑科、大麻科、菊科、大戟科、悬铃木科、芸香科、玄参科、姜科、忍冬科、龙脑香科、莎草科和苞杯花科中,除了1个C10取代的化合物存在于姜科,其他均为C5取代(表3)。异戊烯基取代的数量可达4个,含4个取代基的化合物仅分布在豆科。O-异戊烯基取代数量可达2个,O-异戊烯基主要取代在C-7位和C-4′位的羟基上。

表3 异戊烯基取代的二氢黄酮
2008年,从豆科植物苦参中最先鉴定类黄酮异戊烯基转移酶SfN8DT-1和SfN8DT-2,催化DMAPP转移到柚皮素(naringenin)的C-8位,生成8-异戊烯基柚皮素,还可催化甘草素(liquiritigenin)和橙皮素(hesperetin)[3];2011年,鉴定出SfN8DT-3,与SfN8DT-1和SfN8DT-2具有相似的催化活性,可催化柚皮素和甘草素[18]。Chen等[41]从苦参悬浮细胞培养液中鉴定出SfFPT,以DMAPP为供体时,可催化九种二氢黄酮底物圣草酚(eriodictyol)、柚皮素、乔松素(pinocembrin)、甘草素、橙皮素、异樱花素(isosakuranetin)、草大戟素(steppogenin)、tsugafolin和樱花素(sakuranetin)的C-8位。还可催化黄酮白杨素(chrysin)和二氢黄酮醇花旗松素(taxifolin)的C-8位,二氢查耳酮根皮素(phloretin)的C-3′位(对应一般类黄酮的C-8位)。当供体为GPP时,仅催化乔松素、异樱花素和柚皮素发生异戊烯基化反应。
1.4 二氢黄酮醇
二氢黄酮醇是指二氢黄酮C-3位有氧取代。具有异戊烯基取代的二氢黄酮醇分布在豆科、桑科、菊科、大戟科、芸香科、伞形科、玄参科和山龙眼科中。C-异戊烯基取代的数量可达3个,而O-异戊烯基取代的数量较少,O-异戊烯基取代在C-7和C-4′位的羟基上,分布在豆科和菊科中(表4)。目前仅有从苦参中得到SfFPT以DMAPP为供体催化花旗松素的C-8位[41]。

表4 异戊烯基取代的二氢黄酮醇
1.5 查耳酮
查耳酮的结构特点是2个苯环由含羰基的C3链接而成,即C3部分不成环。查耳酮是在查耳酮合成酶(CHS)作用下合成的黄酮类化合物第1个结构,随后在查耳酮异构化酶(CHI)的作用下转化为二氢黄酮,因此在植物中的含量相对较低,且常与二氢黄酮共存,异戊烯基取代模式也常与二氢黄酮取代类似。带有异戊烯基的查耳酮化合物分布在豆科、桑科和大麻科,少量分布在菊科和伞形科(表5)。C-异戊烯基取代数量可达3个,有3个异戊烯基取代的化合物分布在豆科植物中。O-异戊烯基化通常为1个C5或C10取代,发生在C-4′位和C-4位羟基上(对应于一般黄酮编号的C-7和C-4′位)。

表5 异戊烯基取代的查耳酮
目前,已鉴定的以查耳酮为底物的异戊烯基转移酶相对较多。2011年,从苦参中鉴定出1个查耳酮特异性异戊烯基转移酶SfiLDT,可催化异甘草素(isoliquiritigenin)与DMAPP发生异戊烯基化反应,但催化位点不明确[18]。
2014年,在桑科植物桑(Morusalba)中鉴定的MaIDT和柘树(Cudraniatricuspidata)中鉴定的CtIDT均可催化包括异甘草素、2′,4′-二羟基查耳酮(2′,4′-dihydroxychalcone)、2,4,2′,4′-四羟基查耳酮(2,4,2′,4′-tetrahydroxychalcone)和紫铆因(butein)的C-3′位(对应一般黄酮的C-6位)共4种查耳酮与DMAPP发生异戊烯基化反应,还可催化染料木素和2′-羟基染料木素(2′-hydroxygenistein)2种异黄酮的C-6位发生异戊烯基取代,此外MaIDT和CtIDT还可以接受GPP催化异甘草素。MaIDT还可催化黄酮芹菜素(apigenin)的C-6位发生异戊烯基取代[69]。2018年,从豆科甘草(Glycyrrhizauralensis)中鉴定的GuILDT以DMAPP为供体,可催化如柚皮素查耳酮(naringenin chalcone)、异甘草素、2′,4′-二羟基查耳酮和2,4,2′,4′-四羟基查耳酮的C-3′位共4种查耳酮发生异戊烯基取代[70]。从大麻科的啤酒花(Humuluslupulus)中发现的HlPT-1,可以接受DMAPP供体催化柚皮素查耳酮的C-3′位,生成黄腐酚的前体化合物(desmethylxanthohumol)[71]。
1.6 黄酮醇
黄酮醇指在黄酮C环的C-3位连羟基或其他含氧基团。黄酮醇是除花青素和原花青素之外,在植物中分布最广的类黄酮,但是带有异戊烯基取代的化合物不多,见于豆科、小檗科、桑科、大戟科和悬铃木科等,其中桑科和豆科均含有3个C-异戊烯基取代基的化合物。黄酮醇中O-异戊烯基取代基数量为1个,发生在7或4′位。仅有1个在C-4′位取代的O-异戊烯基化合物分布在兰科中(表6)。

表6 异戊烯基取代的黄酮醇
LaPT2是从白羽扇豆中鉴定,可以对山奈酚(kaempferol)、槲皮素(quercetin)、杨梅素(myricetin)和山奈素(kaempferide)等多个黄酮醇苷元发生异戊烯基化修饰,修饰位点为C-8位,供体为DMAPP,此外还可以催化二氢黄酮柚皮素的异戊烯基化,但催化位点未知[79]。2021年,从箭叶淫羊藿(Epimediumsagittatum)中鉴定了EsPT2主要催化山奈酚,还可催化柚皮素和山奈素,催化位点为C-8位,供体为DMAPP[80]。
1.7 黄 酮
黄酮是指以2-苯基色原酮为母核,且C-3位无含氧基团取代的化合物。黄酮广泛分布于被子植物,在被子植物菊类(asterids)分支中分布较多。异戊烯基取代的黄酮多分布在桑科、豆科、小檗科、藤黄科、大麻科和芸香科中,仅有1个C-4′位O-异戊烯基取代的化合物发现于兰科。C-异戊烯基取代数量可达3个,3个异戊烯基取代的化合物均分布在桑科植物中,C-异戊烯基取代位点有C-8、C-6、C-3′、C-5′和C-3位。O-异戊烯基取代数量多为有1个,发生在C-7、C-4′或C-2′位羟基上(表7)。

表7 异戊烯基取代的黄酮
2014年,从甘草中鉴定出的GuA6DT以黄酮为底物,可催化芹菜素、白杨素、香叶木素(diosmetin)、木犀草素(luteolin)、降桂木生黄亭(norartocarpetin)和金圣草素(chrysoeriol)的C-6位异戊烯基化,供体均为DMAPP,此外芹菜素还可以接受GPP供体[92]。2019年,从大麻科的大麻(Cannabissativa)中鉴定出CsPT3,可以催化2种黄酮底物芹菜素和金圣草素的C-6位发生异戊烯基化反应,可接受DMAPP和FPP作为异戊烯基供体[93]。
2 香豆素类的异戊烯基取代
香豆素类化合物是指具有苯骈α-吡喃酮母核的一类成分,多存在于伞形科、芸香科和豆科等。根据母核上取代基和连接方式的不同,可分为简单香豆素、呋喃香豆素和吡喃香豆素,其中呋喃和吡喃香豆素即在简单香豆素母核上异戊烯基取代后又发生修饰变化所形成的结构,所以简单香豆素中具有异戊烯基取代极为普遍。
根据取代位置不同又分为线型香豆素和角型香豆素。具有异戊烯基取代的简单香豆素分布在伞形科、芸香科、藤黄科、菊科、大戟科、豆科、桑科和兰科;具有异戊烯基取代的呋喃香豆素存在于伞形科和芸香科;具有异戊烯基取代的吡喃香豆素存在于芸香科和豆科中(表8)。
简单香豆素中C-异戊烯基取代基团数量可达3个,呋喃和吡喃香豆素中C-异戊烯基取代基团数量为1~2个。O-异戊烯基化的类型较多,包括C5、C10和C15,分布在菊科、伞形科、桑科和芸香科中,取代位点包括C-5、C-6、C-7和C-8位羟基。
从伞形科欧芹(Petroselinumcrispum)中鉴定出第1个伞形酮异戊烯基转移酶(UDT)命为PcPT,该酶对伞形酮(umbelliferone)的C-6位比C-8位有更强的偏好性,接受DMAPP供体,主要生成线型呋喃香豆素的中间体脱甲基软木花椒素(demethylsuberosin,DMS),同时生成少量角型呋喃香豆素中间体王草酚(osthenol)[105]。从欧防风(Pastinacasativa)中鉴定出PsPT1和PsPT2,均可接受DMAPP供体,催化伞形酮的C-6和C-8位反应生成相应产物DMS和王草酚[106]。从桑科的无花果(Ficuscarica)中发现了1个香豆素异戊烯基转移酶FcPT1,以DMAPP为异戊烯基供体,催化伞形酮的C-6位异戊烯基化,还可以催化5-methoxy-7-hydroxycoumarin,但催化位点不清楚[107]。从芸香科的柠檬(Citruslimon)中鉴定出1个香豆素异戊烯基转移酶ClPT1,该酶只接受GPP供体,主要催化伞形酮的C-8位生成8-geranylumbelliferone,还可催化esculetin、5,7-hydroxycoumarin和5-methoxy-7-hydroxycoumarin的C-8位异戊烯基化[108]。2016年,从大豆中鉴定的GmC4DT可以催化coumestrol与DMAPP反应生成4-dimethylallylcoumestrol[21]。
3 二苯乙烯的异戊烯基取代
二苯乙烯类(stilbene)是具有二苯乙烯母核或其聚合物的总称,在植物的正常组织中含量较低,一般认为是植物的应激产物。具有异戊烯基取代的二苯乙烯类化合物分布在豆科、桑科和大戟科。通常有1~2个C-异戊烯基取代,仅有1个从豆科中分离的化合物4′-氧-异戊烯基紫檀芪(4′-O-prenylpterostilbene)发生O-异戊烯基化(表9)。

表9 异戊烯基取代的二苯乙烯类
2016年,从豆科植物落花生(Arachishypogaea)中发现了二苯乙烯类特异性异戊烯基转移酶AhR4DT-1,可催化DMAPP转移到白藜芦醇(resveratrol)、白皮杉醇(piceatannol)、赤松素(pinosylvin)的C-4位,此外还可催化氧化白藜芦醇(oxyresveratrol),但催化位点还不清楚[116]。2018年,从落花生发现了AhR3′DT-1,以DMAPP为供体催化白藜芦醇的C-3′位,还可催化白皮杉醇和氧化白藜芦醇,但催化位点还不清楚[117]。在2018年从桑中鉴定出MaOGT,催化GPP转移到氧化白藜芦醇的C-4位上,也可催化白藜芦醇,催化氧化白藜芦醇时主要以GPP为供体,但也可接受DMAPP、IPP、FPP和GGPP供体[118]。
4 醌类的异戊烯基取代
醌类(quinone)是指分子内具有不饱和环二酮结构的一类天然有机化合物,主要分为苯醌、萘醌、菲醌和蒽醌。具有异戊烯基取代的醌类分布在藤黄科、菊科、胡椒科、杜鹃花科、大叶草科、紫葳科、茜草科、马鞭草科、胡麻科、芸香科、紫草科、山龙眼科、豆科和鼠李科。通常有1~2个C-异戊烯基取代,以C5和C10取代为主,O-异戊烯基化发生在蒽醌类化合物中(表10)。

表10 异戊烯基取代的醌类
5 简单酚类的异戊烯基取代
5.1 对羟基苯甲酸类
异戊烯基取代的对羟基苯甲酸类化合物多分布在胡椒科和大麻科,还分布在菊科、报春花科、芸香科和兰科中。对羟基苯甲酸类化合物有1~2个C-异戊烯基取代,取代基类型包括C5、C10、C15和C20,未见有O-异戊烯基取代(表11)。

表11 异戊烯基取代的对羟基苯甲酸类
在紫草科紫草(Lithospermumerythrorhizon)中发现了LePGT1和LePGT2参与了次生代谢产物紫草素的合成,它们以对羟基苯甲酸为底物形成最终产物紫草素(Shikonin),并对异戊烯基供体具有严格的供体特异性,只能接受GPP[130]。
5.2 苯丙酸类
苯丙酸类是在植物中广泛存在的酚酸类成分,带有异戊烯基的苯丙酸类化合物较少,存在于豆科和菊科中,一般C-4位连有羟基,通常有1~2个C5取代,取代位点为C-3和C-5位(表12)。

表12 异戊烯基取代的苯丙酸类
6 总结和展望
异戊烯基取代的酚类化合物大多具有抗炎、抗菌、抗肿瘤和抗氧化等较为显著的药理活性。异戊烯基被认为是显著地增加药理活性和生物利用度的功能基团,近年来该类成分已成为活性成分发现和研究的热点[135]。从已有的报道看该类化合物只发现于豆科、桑科、大麻科、小檗科、菊科、悬铃木科、芸香科和伞形科等共计28个科中,分布最多的科是豆科,包括异戊烯基取代的异黄酮、紫檀烷、二氢黄酮、二氢黄酮醇、查耳酮、黄酮、黄酮醇、简单香豆素和吡喃香豆素,此外还有二苯乙烯、蒽醌类和苯丙酸类。其次是桑科,包括异黄酮、二氢黄酮、二氢黄酮醇、查耳酮、黄酮、黄酮醇、简单香豆素和二苯乙烯多种化合物类型。分布在大麻科和菊科的异戊烯基酚类化合物也相对较多。仅有少量的异戊烯基酚类化合物分布在单子叶植物中,黄酮醇、简单香豆素和对羟基苯甲酸见于兰科,二氢黄酮存在于姜科。
异戊烯基连接位点的邻位有羟基时,异戊烯基更容易取代,但也存在一些异戊烯基邻位无羟基的化合物,如3个C5取代基团连接在异黄酮的2′,5′,8位的化合物4′,5,7-三羟基-2′,5′,8-三异戊烯基异黄酮,其2′邻位无羟基。还有简单香豆素的2个C5取代基团连接在3,8位化合物ramosinin,其3位异戊烯基邻位无羟基。
具有异戊烯基取代的酚类化合物,C-异戊烯基取代以C5和C10为主,少量有C15和C20取代,异戊烯基类黄酮取代位点以C-8、C-6、C-3′和C-5′为主,还在C-3、C-7、C-2′、C-4′和C-6′位取代,香豆素取代位点有C-8、C-6、C-3、C-5和C-4位。O-异戊烯基取代相对较少,在异戊烯基类黄酮中主要取代在C-7和C-4′位羟基上,还取代在C-5、C-3′和C-2′位羟基上,分布在豆科、菊科、芸香科、桑科、兰科、大麻科、和悬铃木科。O-异戊烯基在香豆素取代在C-5、C-6、C-7和C-8位羟基上,分布在芸香科、菊科和伞形科;二苯乙烯类O-异戊烯基取代在C-4′羟基上,分布在豆科。
迄今已经鉴定活性的酚类成分异戊烯基转移酶共32个,主要来自于豆科、桑科和大麻科,还有芸香科、伞形科、紫草科和小檗科。底物类型为类黄酮、香豆素、二苯乙烯类和对羟基苯甲酸类,取代基类型以C5为主,取代在酚羟基邻位。从植物中鉴定的异戊烯基转移酶数量与植物中多样化化合物相比,仍十分有限,值得开展广泛而系统的研究。本文通过总结植物中已有的异戊烯基取代的化合物类型、取代特点及在植物类群中的分布,为挖掘更多异戊烯基转移酶并解析化合物的生物合成途径提供帮助,进而可以定向合成有价值的异戊烯基酚类化合物,还可以通过基因定向调控指导分子育种工作。

