趋化素样因子超家族6和程序性死亡受体-配体1在脑胶质瘤中的表达及其与预后的关系
郑永,刘杰
作者单位:解放军总医院三中心神经创伤外科,北京100039
脑胶质瘤是最为常见的恶性肿瘤,其发生发展是由多环节多因素共同作用的最终结果。同时,笔者考虑其分子特点非常复杂,故对其从信号传导通路和基因水平等领域进行多层次的深入研究。结合相关文献显示,从分子水平阐明恶性肿瘤转移复发的病理机制对完善癌症病人诊治方案,改善预后状况具有重要的价值[1]。趋化素样因子超家族6(chemokine-like factor-like MARVEL transmembrane domain-containing family member 6,CMTM6)是由3号染色体的基因簇编码而成的,其属于特殊结构域蛋白(MARVEL),经证实其在分泌蛋白和穿膜蛋白的转运期间发挥重要的作用,且在肿瘤、胚胎发育和表观遗传等方面发挥重要的作用[2]。在肺腺癌和口腔鳞癌等恶性肿瘤的研究中发现,CMTM6通过介导程序性死亡受体-配体1(programmed death-ligand 1,PD-L1)的表达来对恶性肿瘤病人发挥重要的免疫调节作用[3]。PD-L1是多种免疫细胞表达的表面膜蛋白,直接参与恶性肿瘤的分子调控。目前,已经有关于PD-L1在胃癌、口腔鳞癌和肺腺癌等多种恶性肿瘤中表达的研究,并就此研制的新型免疫抑制剂也广泛应用于临床,但对于PD-L1在脑胶质瘤中的研究较为罕见[4]。为了明确CMTM6、PD-L1与脑胶质瘤病人预后状况的关系,评定其在脑胶质瘤诊治中的价值,本研究采用免疫组化Envision二步法检测脑胶质瘤组织标本及正常脑组织标本中CMTM6、PD-L1的表达水平,分析两者与预后状况的关系,以期为脑胶质瘤病人的诊治及预后评价提供指导价值。
1 资料与方法
1.1 一般资料 选择2016年1月至2017年1月解放军总医院三中心神经外科住院部收治的脑胶质瘤病人95例作为观察组。男51例,女44例,年龄<40岁41例,年龄≥40岁54例,病灶长径<3 cm 43例,≥3 cm 52例,病理学分级:低病理级别53例作为低病理级别组(Ⅰ级11例,Ⅱ级42例),高病理级别42例作为高病理级别组(Ⅲ级29例,Ⅳ级13例)。疾病类型:间变性星形细胞瘤27例,少突-星形细胞瘤26例,弥漫性星形细胞瘤14例,少突胶质细胞瘤17例,毛细胞型星形细胞瘤9例,室管膜下巨细胞型星形细胞瘤2例。临床症状:眩晕55例,癫痫57例,卡氏功能状态评分(Karnofsky performance scores,KPS)≥70分64例,<70 分31例。同时,选择颅脑外伤去骨瓣减压术病人89例作为对照组,要求两组在手术中采集脑组织标本。全部病人手术前均被告知手术内容及其注意事项,并签署知情同意书。本研究符合《世界医学协会赫尔辛基宣言》相关要求。
1.2 纳入与排除标准
1.2.1 纳入标准 观察组经影像学和病理组织学检查明确脑胶质瘤的诊断,对照组仅符合颅脑外伤的诊断,初次发病,首次实施手术治疗。
1.2.2 排除标准 手术前接受化疗、放疗等,入组前合并脑卒中、脑疝、其他神经系统疾病、精神心理异常,术后随访资料不完整,随访期间死亡[5]。
1.3 检测方法 采用免疫组化Envision二步法检测脑胶质瘤组织和正常脑组织的CMTM6、PD-L1蛋白表达。
1.3.1 试剂与仪器 兔多克隆CMTM6抗体(美国Abcam公司),兔单克隆PD-L1抗体(Cell Signaling公司),磷酸缓冲盐溶液(phosphate buffer saline,PBS)、二氨基联苯胺(diaminobenzidine,DAB)显色液、辣根过氧化物酶(horse radish peroxidase,HRP)标记的羊抗兔IgG 二抗、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)抗原修复液等均购自武汉赛维尔生物有限公司。
1.3.2 操作方法 采集的脑组织标本即刻采用10%甲醛固定,常规石蜡包埋、连续组织切片,滴入兔多克隆CMTM6抗体(1∶100稀释)或兔单克隆PDL1抗体(1∶200稀释),经4 ℃过夜,PBS冲洗后滴入HRP标记的羊抗兔IgG 二抗,室温条件下孵育15 min,将石蜡组织芯片90 ℃烤片3 h,将组织芯片进行脱蜡水化处理后于PBS浸洗5 min×3次,电饭锅隔水加热至100 ℃,使用EDTA进行抗原修复30 min,芯片缓缓降温后于3%双氧水浸泡30 min以封闭内源性过氧化物酶,经DAB显色液显色冲洗、苏木精复染、冷水缸返蓝、1%盐酸-乙醇分化、脱水风干后采用中性树胶封片等处理后选择染色均匀及清晰的组织芯片进行显微镜观察。选取每张免疫反应较强的区域,400倍高倍镜视野下不重复观察5个视野,计算CMTM6阳性细胞数量。免疫组织化学计分标准[6]:①阳性细胞百分率≤25%则计1分,>25%~50%则计2分,>50%~75%则计3分,>75%则计4分。②染色程度:无染色则计0分,淡黄色则计1分,黄色或棕褐色则计2分,褐色则计3分,以两者评分之和作为最终评分,以0分作为阴性,1~3分则作为弱阳性,4~7分则作为强阳性。由两位高级病理科医师在双盲条件下按照阳性细胞百分比和染色程度进行阅片评分,各切片观察5个视野(×400),取平均值,对于阅片结果不一致的切片则要求另一名病理科医师进行阅片,最终阅片结果由3名医师共同鉴定。根据CMTM6表达阳性与否将胶质瘤病人分为CMTM6阳性表达组和CMTM6阴性表达组,PD-L1表达阳性与否将胶质瘤病人分为PD-L1阳性表达组和PD-L1阴性表达组。
1.4 观察指标 比较观察组和对照组CMTM6、PDL1蛋白表达的差异,进一步比较不同病理学分级CMTM6、PD-L1蛋白表达的差异,明确CMTM6、PDL1蛋白表达在胶质瘤发生发展中的作用。采用电话、门诊结合微信随访获取术后5年生存相关数据,比较CMTM6阳性表达组和CMTM6阴性表达组累积总生存率和无病生存率,比较PD-L1阳性表达组和PD-L1阴性表达组累积总生存率和无病生存率,分析CMTM6、PD-L1表达水平是否与预后状况有关。
1.5 统计学方法 采用SPSS 18.0统计软件包和MedCalc软件包进行数据录入及统计学处理。应用Kolmogorov-Smirnov检验计量资料是否符合正态分布,对于符合正态分布的计量资料以表示,两组比较采用成组设计资料的t检验,计数资料以例(%)表示,两组比较采用配对χ2检验,生存分析采用Kaplan-Meier法和log-rank检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组CMTM6、PD-L1蛋白表达的比较 免疫组化染色结果显示,95例脑胶质瘤组织(观察组)和89例正常脑组织(对照组)CMTM6蛋白主要在细胞膜和细胞质内表达,可见棕褐色颗粒状物质。PDL1蛋白主要分布于细胞膜内,呈棕褐色颗粒状物质,少量可见于细胞质内。观察组CMTM6阳性表达率为85.11%(78/95),明显高于对照组的26.97%(24/89),PD-L1阳性表达率为54.74%(52/95),明显高于对照组的13.48%(12/89),两组比较差异有统计学意义(χ2=56.55,34.47,P<0.05),见表1。

表1 脑胶质瘤95例和脑外伤89例CMTM6、PD-L1蛋白表达的比较/例(%)
高病理级别胶质瘤组织CMTM6阳性表达率为95.24%(40/42),明显高于低病理级别的71.70%(38/53),PD-L1阳性表达率为73.81%(31/42),明显高于低病理级别的39.62%(21/53),两组比较差异有统计学意义(χ2=8.84,11.05,P<0.05),见表2。
2.2 生存分析 95例脑胶质瘤病人中,78例CMTM6阳性病人作为CMTM6阳性表达组,17例CMTM6阴性病人作为CMTM6阴性表达组。Kaplan-Meier生存分析结果显示,CMTM6阳性表达组的累积总生存率较CMTM6阴性表达组的降低幅度更明显,两组1、2、3年累积生存率比较,差异无统计学意义(P>0.05),而4、5年累积生存率比较,差异有统计学意义(P<0.05),见表3。

表3 脑胶质瘤CMTM6阳性表达组与CMTM6阴性表达组累积总生存率的比较/例(%)
CMTM6阳性表达组的无病生存率较CMTM6阴性表达组的降低幅度更明显,CMTM6阳性表达组的1、2、3、4、5年无病生存率比较,差异无统计学意义(P>0.05),见表4。
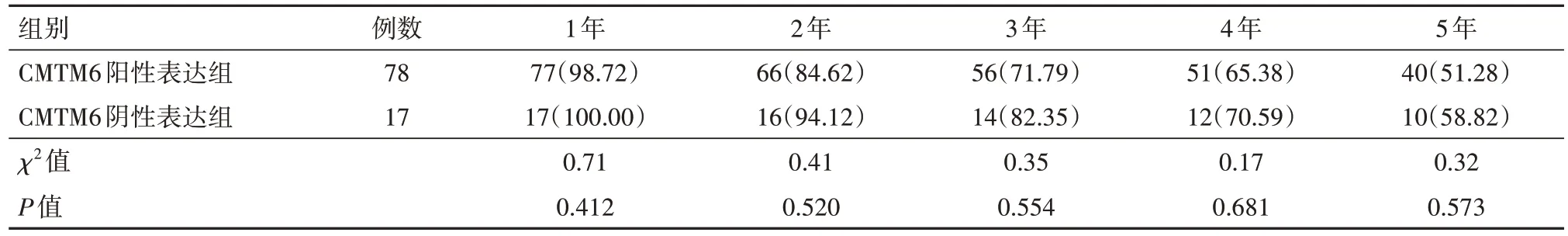
表4 脑胶质瘤CMTM6阳性表达组与CMTM6阴性表达组无病生存率的比较/例(%)
2.3 PD-L1表达与脑胶质瘤病人预后状况的关系 在95例脑胶质瘤病人中,52例PD-L1阳性病人作为PD-L1阳性表达组,43例PD-L1阴性病人作为PD-L1阴性表达组。Kaplan-Meier生存分析结果显示,PD-L1阳性表达组的累积总生存率较PD-L1阴性表达组的降低幅度更明显,两组1年累积生存率比较差异无统计学意义(P>0.05),而2、3、4、5年累积生存率比较差异有统计学意义(P<0.05),见表5。
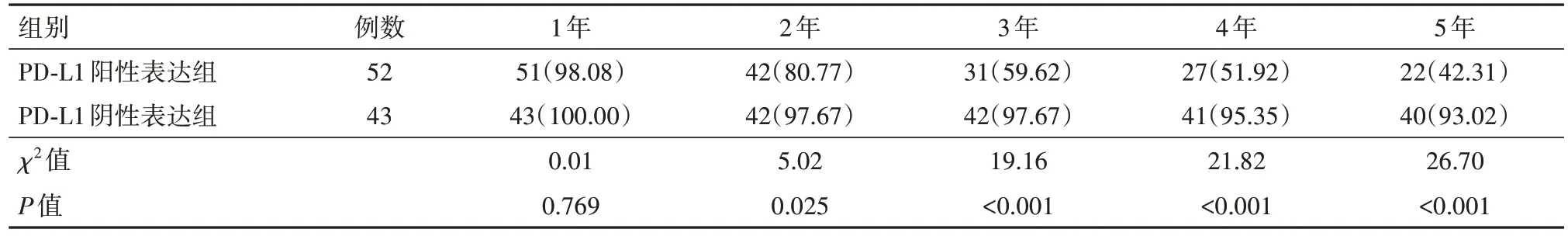
表5 脑胶质瘤程序性死亡受体-配体1(PD-L1)阳性表达组与PD-L1阴性表达组5年累积总生存率的比较/例(%)
PD-L1阳性表达组的无病生存率较PD-L1阴性表达组的降低幅度更明显,PD-L1阳性表达组的1年无病生存率比较差异无统计学意义(P>0.05),而2、3、4、5年无病生存率比较差异有统计学意义(P<0.05),见表6。
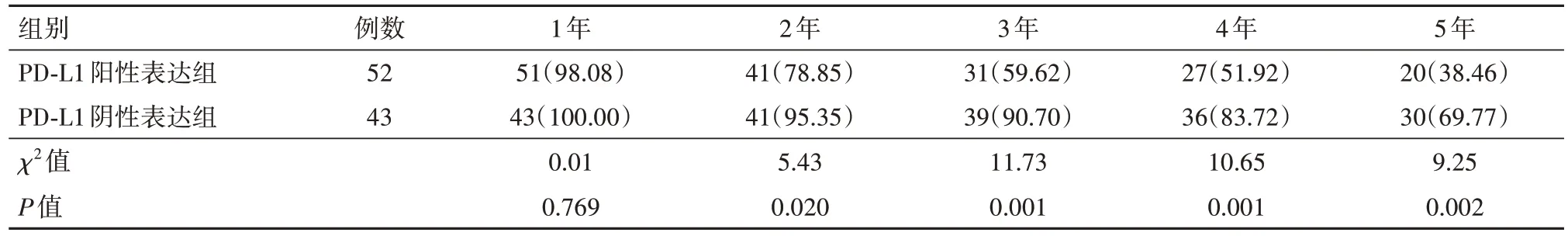
表6 脑胶质瘤程序性死亡受体-配体1(PD-L1)阳性表达组与PD-L1阴性表达组无病生存率的比较/例(%)
3 讨论
脑胶质瘤常呈浸润性生长,增殖侵袭能力较强,且由于化疗耐受而限制化疗的临床应用,尽管手术和放射治疗技术的不断完善,但仍无法降低复发风险。因此,探寻脑胶质瘤的新型治疗靶点具有重要的意义。随着对CMTM家族各成员研究的不断深入,CMTM6和脑胶质瘤、肺癌、肾癌、胃癌和肝癌等多种恶性肿瘤发生发展具有紧密的关系。杨小骏等[7]对42例乳腺癌及癌旁组织进行CMTM6表达水平检查发现,癌症组织CMTM6阳性表达率明显高于癌旁组织,且CMTM6高表达病人生存期明显缩短,提示CMTM6高表达是恶性肿瘤病人预后不良的独立风险因子。PD-L1是各种实体瘤病人的主要生物标志物,其表现为异常激活或过度表达状态,尤其是胃癌、尿路上皮癌、肾细胞癌、肺癌和黑色素瘤等。张武文、汪付兵[8]研究显示,PD-L1信号通路与恶性肿瘤的发生发展及预后状况具有明显的关系。廖婧等[9]研究则显示,CMTM6可有效维持PD-L1的稳定性,预防PD-L1在肺癌和黑色素瘤的溶酶体水解,为阻断PD-1/PD-L1信号通路的免疫逃逸提供了理论依据。Cox回归模型分析显示,CMTM6高表达是癌症病人预后不良的主要影响因素,其有望成为恶性肿瘤病人的新型治疗靶点,并在减少肿瘤转移复发、抑制肿瘤生长繁殖和延长生存时间等方面提供新的思路。相关研究[10]显示,CMTM6表达与头晕具有明显的相关性。同时,作为常见的神经系统恶性肿瘤,癫痫是脑胶质瘤的主要症状,而李明贺等[11]研究则证实,CMTM6、PD-L1与癫痫发作具有明显的关系,上述研究提示了可从CMTM6和PD-L1入手,采用免疫组化法测定CMTM6和PD-L1阳性表达率,明确两者表达是否与病理特征及预后状况有关,假设该项结论成立,则将为脑胶质瘤病人治疗方案的制定与调整提供新的思路。笔者考虑CMTM6和PD-L1在免疫逃逸中发挥的协同效应,故本研究就CMTM6和PD-L1在脑胶质瘤病人中的表达及其与预后状况进行研究,以明确两者表达水平在改善预后状况中的作用。
本研究结果显示,脑胶质瘤组织CMTM6、PDL1阳性表达率明显高于正常脑组织,而高病理级别胶质瘤组织的阳性表达率则明显高于低病理级别,提示CMTM6、PD-L1在脑胶质瘤组织中呈高表达,且与病理学分级具有明显的关系。梁博等[12]研究则证实,CMTM6与癫痫发作程度具有明显的关系,该项研究提示,癫痫主要累及低病理级别胶质瘤病人,但结合本研究结果低病理级别胶质瘤组织的CMTM6阳性表达率则相对降低,上述结论是否存在矛盾则需扩大样本量以验证两者的可靠性。进一步就累积生存率和无病生存率的Kaplan-Meier生存分析显示,CMTM6阳性表达的脑胶质瘤病人4、5年累积总生存率较阴性表达的病人明显降低,PD-L1阳性表达病人的2、3、4、5年累积总生存率和无病生存率也较PD-L1阴性表达组明显降低,提示脑胶质瘤组织CMTM6、PD-L1与脑胶质瘤病人预后状况具有紧密的关系,主要表现为两者的高表达往往提示预后状况不良[13-15]。究其原因为:CMTM6、PD-L1通过影响抗肿瘤免疫反应而导致术后生存率降低[16-17]。但结合本研究结果提示,CMTM6阳性和阴性表达的脑胶质瘤病人累积生存率比较差异无统计学意义,其可能与研究样本量较小具有一定的关系[18-19]。CMTM6和PD-L1均定位于循环核内体和质膜内,前者通过介导PD-L1的表达以促进两者之间的结合,最终拮抗T细胞介导的抗肿瘤反应[20-25]。本研究采用定位准确、敏感性和特异性较高的免疫组化染色技术,以期提高检测结果的可靠性。因此,笔者确信CMTM6、PD-L1与脑胶质瘤病人预后状况具有明显的关系。
综上所述,CMTM6、PD-L1与脑胶质瘤病人病理学分级具有紧密的关系,且两者阳性表达往往提示预后状况不良,往后将以CMTM6为靶点拮抗PDL1信号通路可成为脑胶质瘤病人的治疗突破点。目前针对CMTM6、PD-L1在脑胶质瘤组织中表达的相关研究较为罕见,往后需大量的人体组织学样本进行测定,以进一步阐明两者在脑胶质瘤发生发展期间的分子作用机制。但尽管如此,CMTM6、PD-L1有望为脑胶质瘤病人免疫药物治疗靶点及预后评价提供重要的指导意义。

