氧杂蒽类荧光探针识别性能研究进展
杨美盼 , 王 珊 , 何树梅 , 郭 迅 , 谢婉冰
(西藏民族大学 医学院 高原相关疾病分子遗传机制与干预研究省级重点实验室 环境与疾病相关基因研究高校重点实验室 , 陕西 咸阳 712082)
20世纪60年代末期,冠醚化合物和阴离子的配位作用预示着人类正式步入超分子化学的大门。荧光探针、超分子结合剂、化学传感器的设计都可能引起传感和医学诊断的革命。荧光探针的荧光发色团在与受体特异性反应或结合时,随着结构的变化,诱导荧光发射出现了明显改变,以光信号表达识别过程。
氧杂蒽结构是一类重要的荧光发色团,主要包含罗丹明、荧光素、罗丹荧三类。基本的识别机制源于环的开关,实现荧光信号的有无。如对于罗丹明衍生物结构中存在闭合的五元内酰胺环,探针本身无荧光。当受到目标体的诱导五元环被打开,呈现出显著的荧光信号。此类探针由于其优异的光学性能,已成为构建荧光探针的平台,被很多研究者熟知。从最初的离子识别到生物小分子识别、医学诊疗等方面,都取得了很大的进展。
1 氧杂蒽类荧光探针
1.1 金属离子识别
金属离子在许多生物体内参与各种生理代谢过程,离子的过量、缺失都可能会引起各种功能障碍或者相关疾病[1]。
XIANG等[2]将两个罗丹明母体结构通过二亚乙基三胺连接,合成得到一种新型的荧光探针1(见图1),对Fe3+有较高的选择性。加入Fe3+后,五元内酰胺环打开,溶液颜色发生变化,同时在500~600 nm内观察到荧光信号显著增强。该探针还可用于Fe3+的裸眼检测。
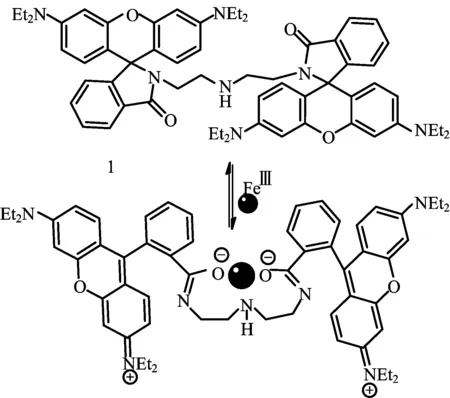
图1 探针1识别Fe3+机制
YANG等[3]设计将2-氨基咪唑结构引入罗丹明母体中,构建了罗丹明六元螺环探针2,见图2。相比于传统的五元螺环结构,该探针设计为六元环,为设计更多新型罗丹明探针提供了新的思路。研究发现,探针对超低浓度金属离子的检测性能优于传统五元内酰胺环结构。通过Cu2+诱导催化水解引起C—C和C—N键的裂解,实现对Cu2+的超敏检测。探针检测的LOD 为35 pmol/L,灵敏度为80 nmol/L。生物成像研究表明,探针具有良好的细胞膜通透性,可以监测活细胞中Cu2+。这种独特的C—C键和C—N键的裂解方式,为超敏荧光探针的设计开辟了新的途径。

图2 探针2识别Cu2+机制
LIU等[4]开发了一种灵敏度和选择性都优良的NIR turn-on型探针3,用于Cu2+的体内外传感和成像。如图3所示,Cu2+诱导螺酰胺环打开,进一步水解,释放探针在近红外区段的荧光。Cu2+在水溶液的检测极限3.2×10-9,低于美国环保局制定的饮用水Cu2+最高水平(1.30×10-6)。该探针的应用不仅为Cu2+相关疾病的临床监测及治疗提供了重要途径,而且在诊断方面有广阔的应用前景。

图3 探针3识别Cu2+机制
1.2 活性氧识别
YANG等[6]设计了一种高选择性、高灵敏度的荧光化学传感器,用于检测水溶液中的HOCl。探针4的识别是基于羟肟酸结构发生次氯酸氧化水解反应,C—N键断开,将螺环非荧光形式转化为开环荧光形式。室温下,HOCl诱导反应迅速进行,得到探针开环形式,且不可逆。探针在水溶液中的检测限为25 nmol/L。A549细胞和斑马鱼内的荧光成像表明,探针可以用于检测活细胞和生物体中的HOCl。
ZHANG等[7]将罗丹明结合四苯基乙烯,报道了一种基于AIE效应的比率荧光探针5,可用于检测外源性和内源性次氯酸水平,鉴别癌细胞和正常细胞。该探针是基于AIE和DTBET效应的比率荧光特性,具有良好的灵敏度和识别特异性。此外,探针具有优良的光谱和生物性能,如低毒性、比色和荧光双通道反应、识别稳定和持久,可为疾病相关的HClO检测提供途径。
GONG等[8]合成了一种基于氧杂蒽-半花菁结构的新型NIR线粒体靶向荧光探针6。探针的Stokes位移为130 nm,大于传统的罗丹明染料和很多已报道的氧杂蒽类次氯酸探针。基于ICT效应,探针在654 nm处表现出明显的荧光发射,快速响应(30 s),可用于特异性检测次氯酸,具有较高的选择性和灵敏度。同时,探针能够渗透细胞膜并在线粒体中积累,用于监测活细胞线粒体中次氯酸浓度的变化。CHEN等[9]基于依达拉奉对羟基自由基的清除机制,设计合成了·OH的turn-on响应型荧光探针7。基于TICT效应,探针在水溶液中几乎无荧光。如图4所示,在·OH作用下,依达拉奉酮亚基转化为稳定的氧化产物,导致579 nm处荧光显著增强。探针可用于不同条件下活细胞和斑马鱼内源性·OH的成像,具有较高的选择性和敏感性,不受其他ROS的干扰。同时,探针可根据·OH的水平来区分正常细胞和癌细胞,是监测活体内·OH的有力工具。
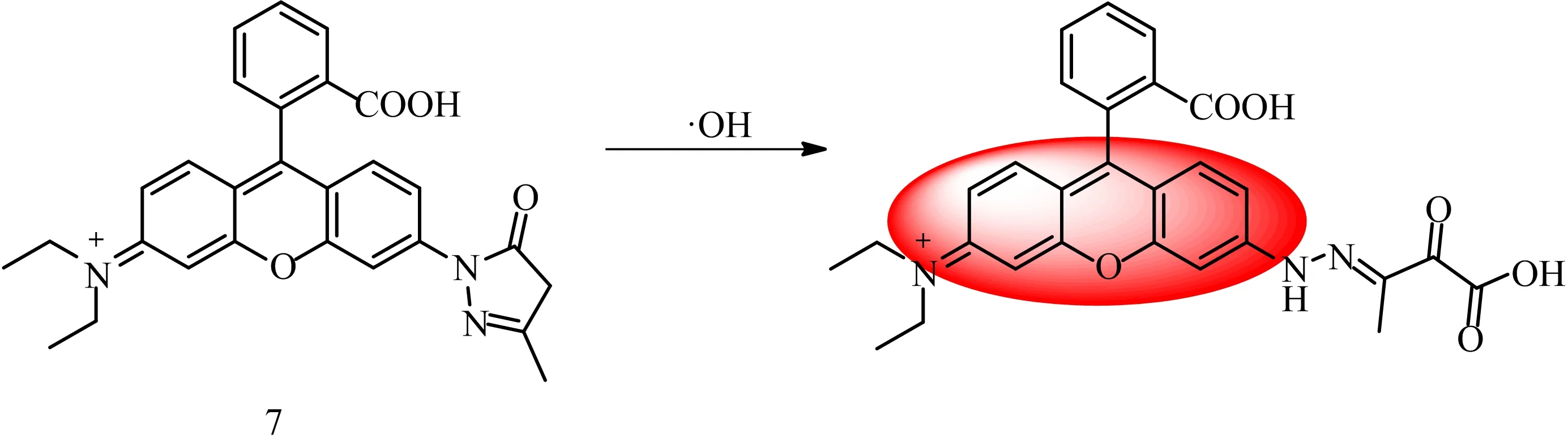
图4 探针7对·OH的可能识别机制
于思为等[10]报道了一例氧杂蒽类ClO—荧光探针8。该探针以连续的碳碳双键连接氧杂蒽结构和苯并噻唑基团,巧妙地设计了既有推拉电子结构,又有长共轭体系和潜在的次氯酸反应位点。探针在人肺腺癌(A549)细胞内可以检测次氯酸根,并产生明显的红色荧光,在生理学和病理学研究方面具有潜在的应用价值。YAO等[11]报道了一种基于FRET机制下,脱硫环化的次氯酸双光子比率荧光探针9。探针利用苯基间隔层连接罗丹明-氨基硫脲和吡啶-萘酰亚胺,可用于HClO裸眼检测。探针在HClO的作用下,出现开关信号响应,600 nm处观察到明显的荧光发射峰,同时颜色由绿色变成粉红色。通过证实,识别过程是基于HClO诱导罗丹明内酰胺环打开,罗丹明-氨基硫脲转化为罗丹明-1,3,4-口恶二唑。该探针具有较高灵敏度(检测限<9.6×10-8mol/L),较宽的pH值响应范围(4~11),响应时间快,抗干扰能力强,选择性好。WANG等[12]首次报道了一种具有大的斯托克斯位移(158 nm)的NIR荧光探针10,用于检测溃疡性结肠炎小鼠模型中的过氧化氢。
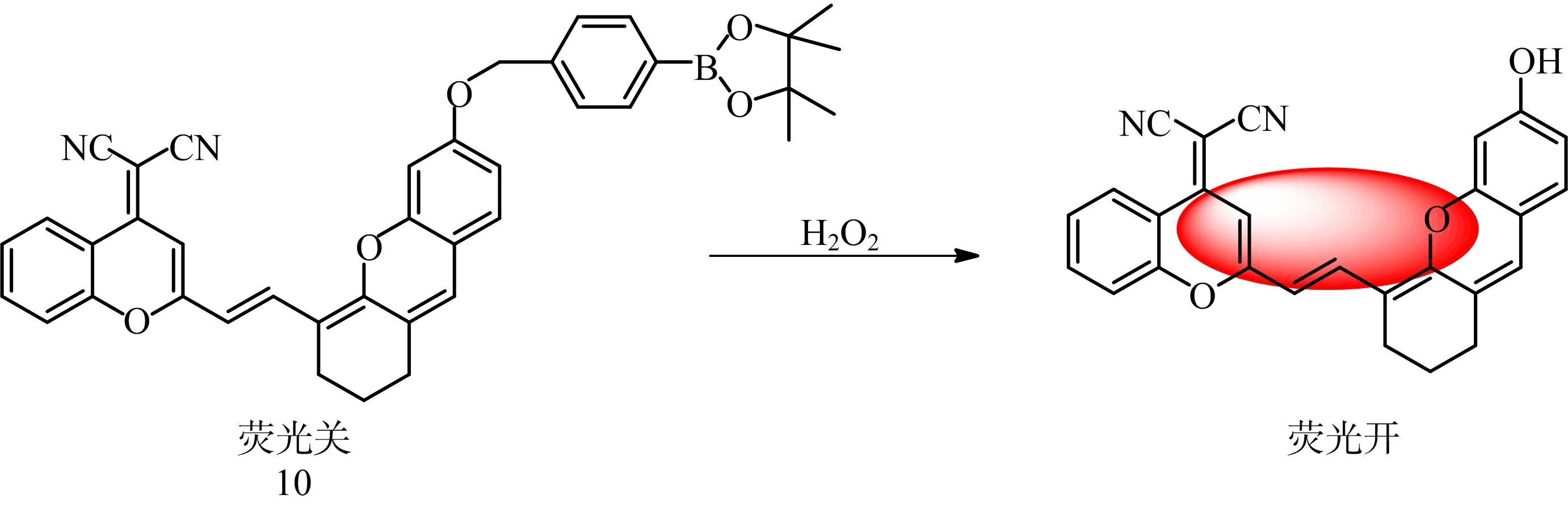
图5 探针10对H2O2识别的可能机制
如图5所示,由于ICT效应被硼酸酯基团阻断,探针本身无荧光,加入过氧化氢后,除去硼酸酯结构,羟基暴露,出现ICT诱导的强荧光。探针遇H2O2后出现明显的荧光增强,检测中展示出良好的选择性。线性范围为0.1~100 μmol/L,检测限为0.033 μmol/L。探针被用于HepG2细胞和HCT116细胞中的过氧化氢荧光成像。此外,探针已成功应用于实时监测UC小鼠体内过氧化氢的变化,将为UC的临床研究提供有效分析途径。
有研究表明,过氧亚硝酸盐(ONOO—)与中毒性肝炎的发生有关。TIAN等[13]报道了一系列具有长发射波长和大Stokes位移的新型NIR荧光探针11,能监测外源性和内源性ONOO—。探针具有较好的灵敏度,检测限为3.3 nmol/L。此外,可通过荧光成像、3D定量分析、流式细胞术检测CCl4诱导的细胞中毒性肝炎的ONOO—,评价三种保肝药物(N-乙酰半胱氨酸、水飞蓟素、联苯双酯)的治疗效果,为中毒性肝炎的临床应用(如诊断、治疗)提供了有用的工具。
XIE等[14]团队利用α-酮酰胺和过氧化氢的特异性反应,结合ICT机制,开发了一种新型过氧化氢专用NIR探针12。探针具有高特异性、高灵敏度、快速反应等优势,并且在线粒体定位方面具有良好的特性,能跟踪活细胞和动物产生的内源性过氧化氢,在缺血灌注损伤模型中实现了过量过氧化氢的可视化检测,提出了过氧化氢与缺血灌注损伤有密切关系的直接证据。该设计思路可应用于各类过氧化氢传感器的研究中,在过氧化氢高效监测中具有巨大的应用潜力,以期用于更多的生物分析和医学应用中。
WU等[15]等报道了一类双通道荧光探针13,由两部分响应单元组成。如图6所示,通过不同的激发波长,探针可分别检测过氧亚硝酸盐(ONOO—)和三磷酸腺苷(ATP)。ONOO—选择性氧化硼酸酯,得到荧光4-羟基-1,8-萘酰亚胺,λex= 450 nm,λem=562 nm。单独加入ATP,罗丹明开环,λex=520 nm,λem=587 nm。研究发现,通过使用两种不同的通道,可同时监测APAP诱导的肝毒性损伤中ONOO—的增加和ATP的消耗。由于ONOO—的增加和ATP的消耗被认为是导致肝坏死的原因,这一监测为APAP诱导毒性的信号通路提供了一定支持。

图6 Turn-on型探针13的识别机制
1.3 小分子生物硫醇识别
生物体中小分子硫醇包含半胱氨酸(Cys)、谷胱甘肽(GSH)、同型半胱氨酸(Hcy)。在生命过程中起着不可或缺的作用,如蛋白质的合成、调节氧化还原内稳态、解毒和代谢以及免疫力增强等。小分子硫醇的检测对于疾病的诊治特别关键,该类荧光探针的研究也引起了广泛的关注。
以罗丹明衍生物作为荧光发色团母体,合成了一类反应型近红外荧光探针14。探针本身无荧光,通过醛基部分与谷胱甘肽( GSH)的巯基发生加成反应,触发螺环的开关来实现荧光信号的改变,荧光产物具有760 nm 的近红外发射波长。此外,该探针实现活细胞中GSH的成像研究。
XIE等[16]报道了一种具有螺环内酰胺结构的高荧光量子产率NIR荧光探针15,用于识别谷胱甘肽(GSH)。加入GSH后,探针荧光增强75倍,同时表现出较高的荧光量子产率(Φ= 0.43)。此外,该探针具有较好的选择性,不易受到其他生物硫醇(Cys、Hcy)或氨基酸的干扰。NIR探针在活细胞和组织等生物样本中表现出对GSH的选择性检测。基于1H NMR、13C NMR 和MS的测定结果,提出了探针的识别机制。NIR荧光探针有望通过改变识别位点,广泛应用于生物分析物的检测。
YU等[17]设计并合成了一种新型的喹啉基-罗丹明染料16,通过扩大π共轭体系来实现近红外荧光发射,检测线粒体中半胱氨酸和同型半胱氨酸。利用罗丹明平台的酰胺环开关状态构建了比率荧光探针。在近红外和可见光发射之间,探针对Cys/Hcy表现出显著的双通道荧光响应,具有较高的选择性和敏感性,对Cys和Hcy的检出限分别为0.12 μmol/L和0.25 μmol/L。此外,细胞实验成像表明,探针具有良好的线粒体靶向能力,较低的细胞毒性和比率响应,可用于细胞中Cys/Hcy定量分析。
1.4 生物酶识别
生物酶在许多生理功能和疾病中发挥重要作用,如催化细胞表面、细胞质底物特定肽键的裂解。酶活性的改变被认为与肿瘤转移和炎症有关。因此,灵敏和准确地检测活体中的酶活性对生物学和医学的研究至关重要。
LIU等[18]开发了一种新型线粒体靶向近红外荧光探针17,检测活细胞中γ-谷氨酰转肽酶活性。如图7所示,由于酰胺键的形成破坏了氨基的供电子能力,破坏了推拉结构,荧光探针本身无荧光发射。将谷氨酸偶联到氧杂蒽结构上,GGT介导的酰胺键的裂解,释放出具有GGT活性依赖的初始荧光团,ICT效应导致荧光显著增强,可用于GGT检测和成像研究。该探针可被GGT特异性激活,LOD为0.40 UL-1。该探针在生理条件下具有良好的选择性和稳定性。此外,探针还被成功地用于线粒体内GGT活性成像,具有快速响应和良好的识别特异性。由于其近红外激发和发射,分析性能良好,在检测活细胞、小动物模型中的线粒体GGT活性,阐明与GGT相关疾病的生理和病理作用等方面具有巨大的潜力。

图7 探针17对GGT的响应机制
SAKABE等[19]报道了一系列羟甲基罗丹明衍生物18。研究中发现了一个有趣的分子内螺环化现象。羟甲基罗丹明绿本身是打开的非螺环结构,具有强荧光。而生理pH值范围内,探针羟甲基罗丹明绿的乙酰化衍生物在水溶液中以闭合的螺环结构存在,无色、无荧光。羟甲基罗丹明绿可以作为构造支架,在生理pH值下的一步酶促反应产生显著的动态荧光变化。基于该设计策略,开发出通过用目标酶的底物取代探针的乙酰基,来获得蛋白酶和糖苷酶的高灵敏度荧光探针。靶酶对荧光探针中底物部分进行特异性切割,产生明显的荧光信号。研究组设计并合成了能特异性识别三种酶的探针,包括亮氨酸氨基肽酶(Leu-HMRG)、成纤维细胞活化蛋白(Ac-GlyPro-HMRG)和β-半乳糖苷酶(βGal-HMRG)。由于螺环结构的存在,探针几乎无荧光,但可被靶酶有效地转化为高荧光的羟甲基罗丹明绿,还可用于活细胞。探针保留了罗丹明优异的光学特性,如亮度和光稳定性,并具有明显的识别优势,包括高灵敏度、快速响应和抗光漂白性,有望用于生物学和病理研究中。
WANG等[20]首次报道了一种水溶性NIR荧光探针19,可在糖尿病诊断和治疗过程中监测碱性磷酸酶(ALP)活性。该探针基于喹啉-氧杂蒽结构,由于分子内ICT效应被磷酸基团阻断,探针本身无荧光,与ALP反应后,磷酸基团水解,羟基被释放,ICT过程恢复,在770 nm处出现较强的荧光信号。与经典的半花菁染料相比,探针具有较长的吸收和发射波长,而且原料易得、合成步骤简单。探针表现出较好的灵敏度和选择性,还用于观察不同细胞中ALP的活性。研究证实,糖尿病小鼠体内的ALP水平高于正常小鼠。在使用降糖药物(二甲双胍)治疗后,糖尿病小鼠体内ALP的产生显著减少。因此,该探针可能成为研究ALP在糖尿病诊断和治疗中具有临床意义的有力工具。
WU等[21]合成了一种新型高灵敏度和高选择性的荧光探针20,可检测细胞内源性酪氨酸酶活性。设计将3-羟基苯基识别部位引入间苯二酚结构中,探针可灵敏检测微量酪氨酸酶,检测限为0.04 U mL-1。共聚焦荧光成像检测B16、HepG2和MCF-7等不同细胞中酪氨酸酶的相对水平,结果显示,B16细胞的酪氨酸酶表达量最高。探针的优良性能使其能在复杂的生物系统中有选择的、灵敏地检测酪氨酸酶。此外,m-羟基苯基的高特异性可以应用于合成其他荧光团的酪氨酸酶荧光探针,也为设计酪氨酸酶抑制剂提供了新的策略。
HE等[22]报道了一例氧杂蒽类近红外荧光探针21,对药物诱导的肝损伤模型和肝癌中亮氨酸氨基肽酶(LAP)活性的成像研究,灵敏度较高。研究发现,对乙酰氨基酚诱导LAP在两种肝模型小鼠肝区均表达上调,揭示了LAP在肝功能中的重要性及其在肝病诊断和治疗中的潜在价值。由于其NIR特性,探针有望为研究LAP相关疾病提供有效途径。
2 结语
氧杂蒽类荧光探针因其优异的光谱性能和生物相容性,受到研究者的广泛关注。近几年,荧光探针的发展一直在向生物应用、医学诊疗深入,以期未来能在疾病的诊断与治疗方面有更大的进展和突破。

