2015-2020年FAdV-4安徽流行株全基因组测序分析及不同感染途径的致病性研究
赵 磊,张留君,刘欣超,陈芳芳,刘 畅,张训海
(1.安徽科技学院,家禽疫病防控监测安徽省重点实验室,安徽凤阳 233100;2.安徽农业大学 动物科技学院,合肥 230036)
禽心包积液-肝炎综合征(Hydropericardium-hepatitis syndrome,HHS)是一种由Ⅰ群血清4型禽腺病毒(Fowl adenovirusserotype4,FAdV-4)致病毒株引发的以心包积液、肝脏和肾脏炎症为特征的禽类传染病[1]。该病首次报道于1987年巴基斯坦安卡拉地区肉鸡群,也称鸡“安卡拉病”,随后扩散至美国、墨西哥、印度、俄罗斯、日本、韩国等国家,给世界养禽业造成了重大经济损失[2-3]。中国最早从2013年发生的HHS病例中分离到FAdV-4新型高致病性江苏JSJ13株和广西GX2013株[4-5],2015年起,在山东、江苏、安徽、河南、湖北等多省份开始暴发性流行HHS疫情,病禽死亡率达20%~80%,主要发生于3~5周龄肉鸡,后期报道了5~11周龄的鸡、鸭、鹅、鸽、鸵鸟等禽类均可感染发病[6-8]。该病毒既可水平传播,亦可垂直传播,严重威胁中国养禽业可持续健康发展。
禽腺病毒为无囊膜的双股DNA病毒,分为Ⅰ、Ⅱ、Ⅲ 3个群,Ⅰ群FAdV可分为5个种(A~E)及12个血清型(1~7、8a、8b、9~11)。FAdV-4属于C种成员,其基因组全长为43~45 kb[1-2]。2015年以来,学者先后报道中国FAdV-4流行株的分离与全基因组序列,国内FAdV-4流行株与国外经典毒株存在基因组多处差异以及1 966 bp基因缺失的显著特征[4-6]。安徽省最早报道亳州的FAdV-4CH/AHBZ/2015株全基因组序列,随后又报道了AHHN、AH712、AH726、AH-F18、AH-F19等毒株序列,其全长均为43.7 kb,但分离自120日龄蛋鸡群的AH-F19株在非结构蛋白100 ku上已出现11个氨基酸突变,该蛋白具有协助病毒组装和提高增殖效率作用[6,9-11]。FAdV-4编码主要外部衣壳蛋白为六邻体(Hexon)、五邻体(Penton)和两种纤突蛋白(Fiber-1和Fiber-2),其中Hexon蛋白具有种型特异性抗原决定簇,也是中和抗体的靶标,Fiber-2蛋白通过识别细胞受体辅助病毒侵入细胞,二者均是毒力关键蛋白[12-14]。根据毒力差异,FAdV-4可分为致病性的HHS毒株(MX-SHP95、AG234、JSJ13、HB1510株等)和不致病的HHS弱毒株(ON1、KR5、B1-7株等),FAdV-4致病株的不同途径感染也可造成禽群的死亡率差异[15]。本研究以2015-2020年安徽地区引发HHS疫情的6株FAdV-4毒株为研究对象,通过病毒全基因组测序分析,以及人工感染与自然感染对10日龄SPF鸡的致病性分析,旨在分析FAdV-4安徽株的遗传特征和不同感染途径的致病性差异,为该病的科学防控提供基础资料。
1 材料与方法
1.1 毒株及主要材料
CH/AHMC/2015株(蒙城县海兰褐蛋鸡场,55日龄)、CH/AHHQ/2016株(霍邱县黑凤鸡场,52日龄)、CH/AHWH/2018株(五河县青脚麻黄鸡场,92日龄)、CH/AHMG/2018株(明光市青脚麻鸡场,62日龄)、CH/AHMG/2019株(明光市黄羽鸡场,50日龄)和CH/AHMC/2020株(蒙城县麻鸡场,35日龄)均由家禽疫病防控监测安徽省重点实验室分离、纯化并保存;SPF鸡种蛋购自北京梅里亚维通实验动物技术有限公司;10日龄SPF鸡由安徽科技学院SPF实验动物中心孵化并饲养于禽用隔离器内;E.Z.N.A.TMViral DNA Kit购自OMEGA公司;TaqDNA聚合酶、dNTP、10×TaqBuffer、DNA Marker均购自TaKaRa公司。
1.2 病毒增殖与核酸提取
将6株FAdV-4种毒分别经尿囊腔途径接种9日龄SPF鸡胚各5枚,0.1 mL/枚。孵化、观察并收集24 h后死亡鸡胚肝脏,肝组织匀浆后 16 000×g离心5 min,取上清液按E.Z.N.A.TMViral DNA Kit说明书提取病毒核酸,并测定核酸浓度。
1.3 病毒全基因组测序与组装
将所提取的6株FAdV-4安徽流行株病毒核酸送至上海探普生物科技有限公司进行核酸片段化和文库构建,并利用illumina二代测序技术进行病毒基因组测序,应用SPAdes和MEGAHIT软件对测序数据进行分析和组装。由于FAdV-4具有保守的末端序列,因而设计并合成4对引物(表1)进行末端序列PCR扩增。PCR产物经电泳鉴定后送生工生物工程(上海)股份有限公司测序,采用SeqMan程序拼接获得6株病毒全基因组序列。
1.4 序列比对与遗传进化分析
对6株病毒全基因组序列采用MegAlign程序与已公布的HB1510、JSJ13、ON1、MX-SHP95等代表毒株序列进行核苷酸和结构蛋白氨基酸序列比对分析。采用MEGA 6.0.6分析软件Neighbor- joining法对6株病毒及C群FAdV毒株进行hexon和fiber-2基因构建进化树。
1.5 ELD50的测定
对FAdV-4 CH/AHMC/2015株种毒用灭菌PBS作10倍系列稀释成6个梯度(10-1~10-6),经卵黄囊途径接种8日龄SPF鸡胚,每个梯度接种6枚,0.1 mL/枚。孵化并观察记录鸡胚死亡数量和病变情况,按Reed-Muench方法计算其ELD50。
1.6 FAdV-4不同感染途径对SPF雏鸡的致病性试验
在安徽科技学院SPF实验动物中心(实验动物使用许可证:SYXK(皖)2013-007)孵化出雏并饲养至10日龄的90只SPF鸡,随机分成4个攻毒组(皮下注射组20只、口服组20只、点眼组10只、滴鼻组10只),攻毒组每只鸡接种103.0ELD50/0.1mL的CH/AHMC/2015毒株,同时,在各攻毒组中另置5只健康鸡与之同群混养;对照组10只,每只颈背部皮下注射0.1 mL PBS。将试验鸡按组饲养于屏障系统中的5台禽用负压隔离器内,每日观察鸡只精神状态和死亡数量,持续观察28 d,计算发病率和死亡率,对病死鸡剖检观察并记录病变。
2 结果与分析
2.1 6株FAdV-4毒株的核酸浓度测定
CH/AHMC/2015、CH/AHHQ/2016、CH/AHWH/2018、CH/AHMG/2018、CH/AHMG/2019和CH/AHMC/2020株经增殖后提取病毒核酸DNA,质量浓度分别为196.5、255.3、 271.4、266.4、241.1和183.4 ng/μL。
2.2 6株FAdV-4毒株全基因组序列与特征
经illumina测序组装获得CH/AHMC/2015、CH/AHHQ/2016、CH/AHWH/2018、CH/AHMG/2018、CH/AHMG/2019、CH/AHMC/2020株FAdV-4病毒基因组序列为 43 445、43447、43 463、42 089、43 612、43 608 nt,另对6株病毒基因组保守的两端部分序列进行PCR扩增与测序,最终组装6株病毒全基因组序列,分别为43 721、43 721、43 723、43 721、43 723、43 719 nt,上传至GenBank,登录号分别为MG148335、MG148334、MN606302、MN606303、MZ020785和MZ066624。
6株病毒基因组G+C含量均为54.87%,末端倒置重复序列(ITR)均为56 bp,编码43个开放阅读框,其核苷酸同源性达99.97%,与国内主要流行株同源性为99.56%~100%,其中CH/AHHQ/2016株与HB1510株100%同源。6株病毒与国外经典毒株ON1、KR5、B1-7、MX-SHP95株基因组同源性为98.45%~98.78%,与同处C种的FAdV-10型C2-B-FAdV-10株同源性为98.5%。对比代表株HB1510株,6株病毒在13个核苷酸位点存在变异(表2),其中5个核苷酸突变导致编码氨基酸的变化,即ORF24(L127V)、100K(S115F)、Fiber-1(A46T)、Fiber-2(F44Y)以及ORF16(T119A)突变。对比早期分离的江苏JSJ13株ORF29基因发现,国内毒株在ORF29基因上存在多种差异,6株病毒及国内主要流行株均缺失33 nt,山东SDSX1株(KY636400)缺失100 nt,黑龙江HLJ/151118株(KX061750)、河南HN/151025株(KU245540)和HN/151029株(KX090424)均缺失144 nt。
多序列比对分析显示,国外ON1、KR5、B1-7、MX-SHP95、AG234株在19518位GA重复均为4~5个,而国内毒株主要为8~11个;除广西GX2019-014株外,国内毒株在非编码区1 822位点插入10个碱基(TAACTGATTG),在33 ku蛋白aa76位缺失CCCCCT(编码2个脯氨酸),在ORF43的aa198位插入ATA(编码异亮氨酸),另有1 966 bp(ORF19/ORF48/ORF27)基因缺失,提示中国FAdV-4主要流行株具有独特的基因遗传标志。
对27株FAdV-4毒力关键蛋白Hexon和Fiber-2分析显示(表3),在是否引发HHS方面,Hexon蛋白aa188、Fiber-2蛋白aa219和aa380 3 个位点的氨基酸具有一定特征性,19株致HHS毒株的3个位点氨基酸主要为R、D、T,仅个别差异毒株,如中国广西GX2019-014株(R、G、A)和GX-1株(R、A、T),韩国Kr-Andong和Kr-Changnyeong株(I、D、A),俄罗斯Krasnodar株(R、D、D),提示致病性FAdV-4毒株在此3 个位点存在变异株。非致HHS毒株主要为I/V、G、A,仅墨西哥弱毒疫苗INT4-ATTENUATED-AG234株为R、R、T。

表3 本研究毒株与参考毒株Hexon和Fiber-2蛋白的3 个氨基酸位点特征Table 3 Characteristics of three amino acid sites of Hexon and Fiber-2 inisolated and reference strains
2.3 hexon和fiber- 2基因遗传演化分析
FAdV-C种hexon基因324~951位进化树显示(图1-A),C种FAdV可区分为FAdV-4和FAdV-10两个血清型,6个毒株均属于FAdV-4型,与国内HB1510、JSJ13株及巴基斯坦PARC-1/98株(LC504494)处于同一分支,其与2007年印度KC株(EU177545)hexon全基因同源性高达99.8%;6个毒株与韩国、俄罗斯、墨西哥分离株以及不致HHS弱毒株遗传距离较远。fiber-2基因51~1 390位进化树显示(图1-B),6个毒株与巴基斯坦K31、科威特K99-97、印度IV37株遗传关系相近。上述结果表明,国内FAdV-4流行株与巴基斯坦、印度分离的毒株遗传关系最近。
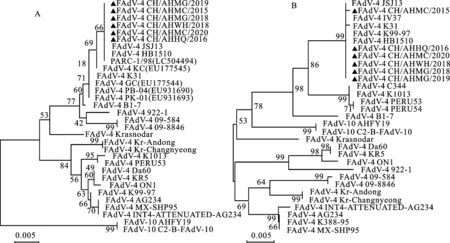
A.hexon;B.fiber- 2
2.4 CH/AHMC/2015株ELD50的测定结果
FAdV-4 CH/AHMC/2015株种毒以10倍稀释经卵黄囊接种8日龄SPF鸡胚后,鸡胚死亡时间集中在接种后第6~10天,按Reed-Muench方法计算其ELD50为105.3ELD50/0.1mL。
2.5 雏鸡致病性试验结果
试验期间,对照组鸡均无异常。皮下注射组2 dpi开始发病,3 dpi达到发病高峰并出现死亡,4 dpi出现死亡高峰,总发病率和死亡率分别达100%和90%;口服组5 dpi开始发病,6 dpi死亡3只,7 dpi死亡1只,总发病率和死亡率分别为55%和20%;点眼组5 dpi开始发病,7 dpi死亡3只,8 dpi死亡1只,总发病率和死亡率分别50%和40%;滴鼻组5 dpi开始发病,6 dpi死亡3只,7 dpi死亡1只,9 dpi死亡1只,总发病率和死亡率分别为60%和50%(表4、图2)。皮下注射组同群混养鸡总发病率和死亡率分别为40%和20%(8 dpi死亡1只),其余3组同群混养鸡发病率均在20%,但均未出现死亡,可见自然接触感染鸡的发病率、死亡率均显著低于相应人工感染组(表4)。各组发病鸡均表现为精神沉郁,废食呆立或卧地,羽毛粗乱,拉黄绿色稀粪。病死鸡剖检可见心包积有淡黄色澄亮液体(图3-A),心房内有血凝块;肾脏尿酸盐沉积呈花斑色(图3-B);胰腺有白色坏死点,个别鸡胰腺有液化坏死灶(图3-C)。
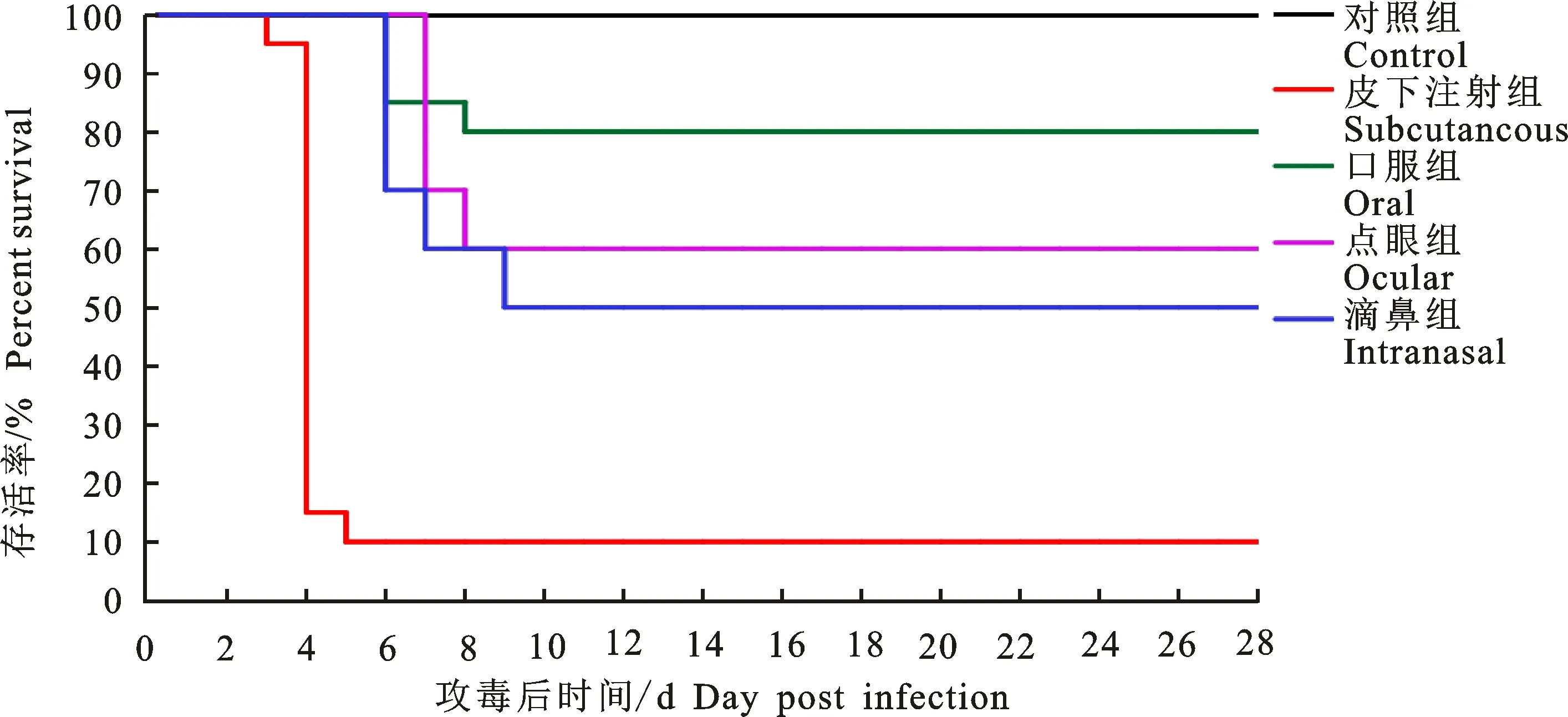
图2 FAdV-4 CH/AHMC/2015株不同途径攻毒SPF鸡的死亡情况Fig.2 Death of SPF chickens infected by different ways of FAdV-4 CH/AHMC/2015 strain
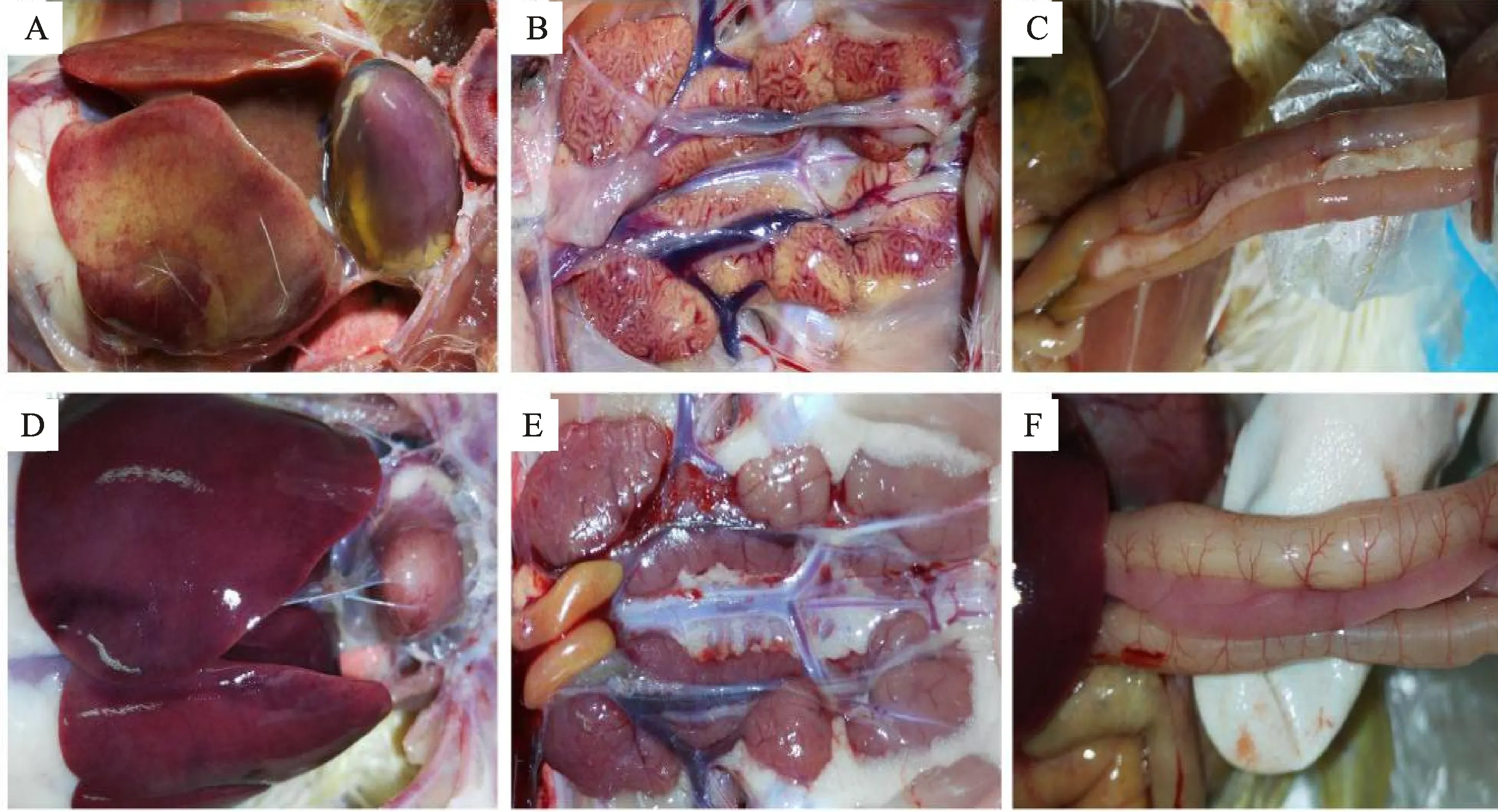
A、B、C.攻毒组病变;A.皮下注射组鸡心包积液;B.滴鼻组鸡肾脏尿酸盐沉积;C.皮下注射组鸡胰腺液化坏死灶;D、E、F.对照组

表4 FAdV-4 CH/AHMC/2015株攻毒10日龄SPF鸡发病率和死亡率Table 4 Morbidity and mortality of 10-day-old SPF chickens infected with FAdV-4 CH/AHMC/2015 strain
3 讨 论
本研究测定的2015-2020年安徽地区6株FAdV-4流行株及已报道的CH/AHBZ/2015、AHHN、AH712、AH726、AH-F18和AH-F19株基因组全长均在43 719~43 725 nt,其核苷酸同源性达99%以上,仅AH-F19株在非结构蛋白100 ku上存在一定差异,其余11株与国内流行代表株HB1510株仅有个别氨基酸变化,表明2015-2020年安徽地区FAdV-4流行株具有国内主要流行致病株特征。国内主要流行株与早期分离的JSJ13株相比均存在ORF29基因缺失33 nt,但已有SDSX1、HLJ/151118、HN/151025和HN/151029毒株在该基因上缺失更多核苷酸。另有研究报道,贵州分离的GZ-BJ株基因组全长为43 352 nt,比国内主要流行株短371 nt,少6个ORF(22K、putative 9.1 ku、u-exon、ORF42、ORF28、ORF17)[16];秦皇岛致病株QHD2021株全基因组长为44 225 nt,比国内主要流行株长约500 nt,与HB1501株核苷酸同源性仅 94.3%[17];广西分离株GX2019-014不同于国内主要流行株的遗传特征,而与国外ON1、B1-7、MX-SHP95等经典株更为相似[18]。出现基因缺失或插入的FAdV-4变异株是病毒与宿主协同进化的表现,但其基因组差异可能造成的生物学特性改变需要更深入的综合评估。
研究表明,中国流行的FAdV-4为新型高致病性毒株,其1 966 bp片段缺失、替换弱毒fiber-1及penton基因均不影响其毒力,而hexon和fiber-2基因是毒力关键基因,Hexon和Fiber-2蛋白上均有中和性表位[13,19-20]。本研究发现Hexon蛋白aa188、Fiber-2蛋白aa219和aa380 3个位点的氨基酸存在一定特征性,致病毒株主要为R、D、T。Zhang等[21]验证了Hexon蛋白aa188位R→I突变株完全丧失了对SPF鸡的致病性,然而,存在差异的有韩国报道的4个致病株Hexon蛋白aa188位却均为I[22],弱毒INT4-ATTENUATED-AG234株却为多数致病株特征的R[23]。致病株Fiber-2蛋白aa219D和aa380T也存在差异性毒株,如中国GX2019-014、GX-1,韩国Kr-Andong、Kr-Changnyeong、Kr-Yeoju、Kr-Gunwi和俄罗斯Krasnodar株[18,22,24]。进而提示,FAdV-4的毒力关键蛋白和氨基酸位点存在毒株差异性,应对主要优势毒株进行疫苗免疫防制,同时对此3个位点变异株进行流行病学监测与研究。雏鸡致病性试验结果显示,以直接突破动物机体物理屏障的皮下注射法致死雏鸡最快且死亡率最高,而经消化道黏膜、眼结膜、呼吸道黏膜等天然免疫防御屏障人工感染的雏鸡发病和死亡时间较皮下注射组均推迟约3 d,死亡率为20%~50%;以模拟自然接触传播的各组同群混养鸡发病率和死亡率最低,仅皮下注射组的混养鸡死亡率为20%,可能由皮下注射组环境中短期内FAdV-4活病毒载量高于其他3组,进而该组混养鸡接触感染病毒剂量相对较高。赵玉杰等[15]对21日龄SPF鸡采用皮下注射、口服、滴鼻感染FAdV-4的死亡率分别为80%、20%、50%,与本研究结果相似。Li等[25]建立FAdV-4气溶胶传播模型证实该病毒可经空气传播,但经空气传播感染病毒的剂量不足以引起鸡群发病和死亡,这符合本研究同群混养鸡自然接触感染剂量相对较低,其水平传播相对有限。值得注意的是,本研究中3种黏膜途径感染FAdV-4,其发病率相近,但点眼、滴鼻两组均比口服组鸡病死率高出一倍,这与人的腺病毒最初分离部位及“腺样-咽-结膜病原”命名相类似,因此建议在FAdV-4疫苗研究方面应更加注重禽的眼鼻黏膜免疫。
2015年中国养禽场广泛性流行HHS疫情且表现出较高的致病性,结合本研究FAdV-4流行株全序列信息及人工感染与自然感染的致病性差异,笔者认为,除了流行毒株的本身致病性和传播特性外,禽用活疫苗中的FAdV-4污染不容忽视。有研究表明,在新城疫活疫苗中检出了外源性致病性FAdV-4的污染,并推测这可能是导致中国鸡群大面积感染和高致病性流行HHS的原因之一[26-27]。因此,在HHS的综合防制中,活疫苗类生物制品的外源性FAdV-4污染监测不可忽缺。

