四种致泻性大肠杆菌多重PCR检测方法的建立及在大熊猫上的应用
王路才,苏小艳,张焕容,刘颂蕊,燕 霞,杨 梅,李明喜*
(1.成都大熊猫繁育研究基地,四川省濒危野生动物保护生物学重点实验室,四川 成都 610081;2.西南民族大学畜牧兽医学院,四川 成都 610041)
大肠杆菌(E.coli)属革兰氏阴性短杆菌,为条件致病菌,在自然条件下普遍存在,仅有致病性大肠杆菌具有致病性,可引起人和动物发生以腹泻症状为主的疾病。根据不同的生物学特性,将致病性大肠杆菌分为5 类:肠道致病性大肠杆菌(EPEC)、肠道侵袭性大肠杆菌(EIEC)、产肠毒素大肠杆菌(ETEC)、肠道集聚性大肠杆菌(EAEC)和肠道出血性大肠杆菌(EHEC)[1]。
自1983年起,陆续有大熊猫感染致泻性大肠杆菌的报道,严重者甚至导致死亡[2-3]。多重PCR检测在转基因鉴定、食品检测、病原体检测、肿瘤诊断等领域已成功运用[4-8],具有快速、灵敏、准确等优点。本研究拟针对escV、stx1、stx2 和bfpB 毒力基因建立检测EPEC 和EHEC 的多重PCR 体系,针对lt、sth、astA、aggR 和pic毒力基因建立检测ETEC 和EAEC 的多重PCR 体系,为大熊猫肠道腹泻性疾病提供及时、可靠的诊断结果,指导临床用药。
1 材料与方法
1.1 菌株 ETEC(CICC10667)、EAEC(CICC24186)、EHEC(CICC24187)、EPEC(CICC24189)均为标准菌株,购自CICC 中国食品发酵工业研究院有限公司和中国工业微生物菌种保藏管理中心;大肠杆菌质控菌株ATCC25922、肺炎克雷伯菌、多杀性巴氏杆菌、金黄色葡萄球菌、奇异变形杆菌、绿脓杆菌、粪肠球菌、鲍曼不动杆菌、盲肠肠球菌、巴氏链球菌、摩氏摩根菌,均由四川省濒危野生动物保护生物学重点实验室保存。
1.2 主要试剂和仪器 细菌基因组DNA 提取试剂盒,2×Taq PCR MasterMix,核酸染料;PCR 仪,核酸电泳仪,凝胶成像系统。
1.3 引物的设计与合成 按食品安全国家标准(大肠杆菌GB 4789.6-2016)中EPEC 和EHEC 的escV、stx1、stx2、bfpB 基因序列设计引物,根据ETEC 和EAEC 的lt、sth、astA、aggR、pic基因序列设计引物,引物序列送至生工生物(上海)股份有限公司合成。
1.4 细菌DNA的提取 将保存的EPEC、EHEC、ETEC、EAEC 标准菌株分别接种于LB 营养肉汤培养基中,37 ℃振荡培养过夜后,取菌悬液1 mL,按照DNA 提取试剂盒说明书提取DNA。根据公式计算相应拷贝数。
1.5 单一PCR扩增及反应条件优化 单一PCR反应体系为25 μL,对单一PCR的引物添加量和退火温度进行优化,引物浓度设为10 μmol/L,引物添加量优化范围为0.1~2.0 μL,退火温度优化范围为54~64 ℃。优化结束后,选取最优反应条件进行单一PCR 扩增,PCR 产物在1%琼脂糖凝胶上进行电泳检测,并将其余产物送生工生物工程(上海)股份有限公司测序鉴定。
1.6 多重PCR 扩增及反应条件优化 在单一PCR的基础上,对多重PCR方法进行引物和退火温度优化。EPEC 和EHEC 多重PCR 反应中,引物添加量优化为0.1~2.0 μL,退火温度优化为57~65 ℃。ETEC 和EAEC 多重PCR 反应中,引物添加量优化为0.1~2.0 μL,退火温度优化为55~63 ℃。
1.7 多重PCR 特异性试验 分别以EPEC 标准菌株、EHEC 标准菌株、ETEC 标准菌株、EAEC 标准菌株、金黄色葡萄球菌标准菌株、大熊猫源肺炎克雷伯菌、大熊猫源多杀性巴氏杆菌、大熊猫源奇异变形杆菌、大熊猫源绿脓杆菌、大熊猫源粪肠球菌、大熊猫源鲍曼不动杆菌、大熊猫源盲肠肠球菌、大熊猫源巴氏链球菌、大熊猫源摩氏摩根菌的DNA为模板进行多重PCR扩增,评估所建立的多重PCR方法的特异性。
1.8 多重PCR 敏感性试验 提取EPEC 标准菌株、EHEC 标准菌株、ETEC 标准菌株、EAEC 标准菌株的DNA后,将DNA浓度调整为200 ng/mL,再用灭菌ddH2O 进行10 倍系列稀释成6 个梯度浓度,将每组各个稀释度等比例混合,按照1.6建立的多重PCR方法扩增,检测多重PCR方法的敏感性。将4 种致泻性大肠杆菌菌液进行10 倍系列稀释成6 个梯度浓度,将每组各个稀释度等比例混合,检测多重PCR方法对菌液的敏感性。
1.9 多重PCR重复性试验 利用优化后的多重PCR 方法以相同的条件进行重复性试验,重复8次,每次间隔一周。以此验证本次建立的多重PCR方法的重复性和稳定性。
1.10 多重PCR 对人工模拟粪便污染样品的检测 EPEC标准菌株、EHEC标准菌株、ETEC标准菌株、EAEC 标准菌株过夜培养后调整浓度为2.0×101CFU/mL,取1 mL 混合菌液加入0.1 g 健康大熊猫粪便中进行粪便污染样本模拟,并设为试验组,设置生理盐水(替换菌液)为阴性对照组。提取粪便样本DNA,用所建立的多重PCR方法和单一PCR 方法对10 份人工模拟粪便污染样品进行检测,比较两种方法的检测结果,并计算两者的符合率。
1.11 多重PCR对临床腹泻粪便样本的检测 采集大熊猫的腹泻粪便样本,增菌培养后提取DNA,进行大肠杆菌通用毒力基因phoA 检测,再将检测为阳性的DNA 模板作为多重PCR 的模板进行致病型鉴定检测。采用本试验建立的多重PCR方法和标准单一PCR方法对110份临床大熊猫粪便样品进行检测,比较两种方法的检测结果,并计算两者的符合率。
2 结果
2.1 单一PCR 方法的建立 经过引物浓度、退火温度等条件摸索,ETEC、EAEC、EHEC 和EPEC四种菌单一PCR 的最佳扩增体系和反应条件见表1。
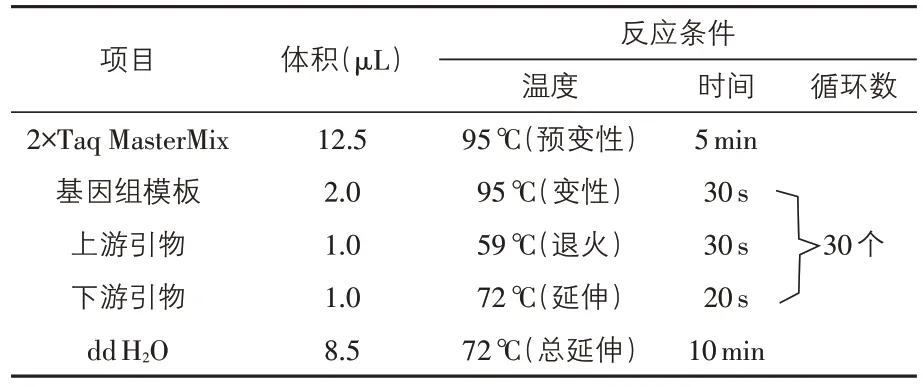
表1 单一PCR最佳反应体系及条件
2.2 多重PCR扩增及反应条件优化结果 经过引物浓度、退火温度等条件摸索,结果得出EPEC和EHEC 多重PCR 反应的最佳体系为:2×Taq PCR MasterMix 12.5 μL,DNA模板量均为2.0 μL,escV、stx1、stx2 引物(10 μmol/L)量各0.2 μL,bfpB为0.4 μL,灭菌ddH2O 为8.5 μL;最佳退火温度为61 ℃45 s(表2 和图1A)。ETEC 和EAEC 多重PCR 反应的最佳体系为:2×Taq PCR MasterMix12.5 μL,escV、stx1、stx2 引物(10 μmol/L)量各0.2 μL,bfpB为0.4 μL,DNA模板量均为2.0 μL,灭菌ddH2O 为8.5 μL;最佳退火温度为59 ℃ 30 s(表3和图1B)。
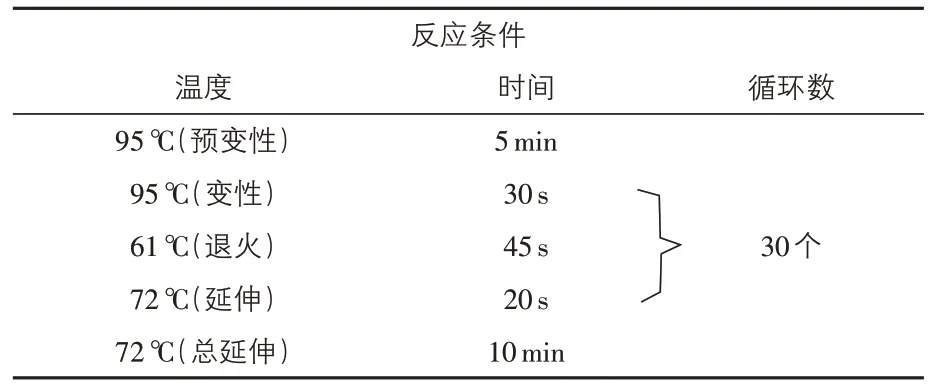
表2 EPEC和EHEC多重PCR反应条件
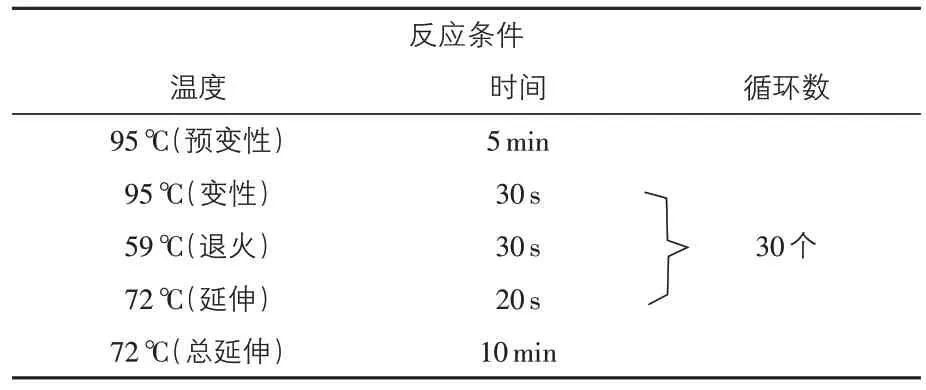
表3 ETEC和EAEC多重PCR反应条件
2.3 特异性试验结果 多重PCR 方法特异性检测结果显示,EPEC 和EHEC 多重PCR 仅在escV(544bp)、stx1(244bp)、stx2(324bp)和bfpB(910bp)基因扩增为阳性;ETEC和EAEC多重PCR仅在astA(102 bp)、sth(171 bp)、lt(655 bp)、aggR(400 bp)和pic(1 111 bp)基因扩增为阳性。两组多重PCR对肺炎克雷伯菌、多杀性巴氏杆菌、金黄色葡萄球菌、奇异变形杆菌、绿脓杆菌、粪肠球菌、鲍曼不动杆菌、盲肠肠球菌、巴氏链球菌、摩氏摩根菌均未观察到扩增条带,表明该方法的特异性较强。
2.4 敏感性试验结果 在本试验建立的多重PCR 方法中,EHEC 和EPEC 的最低DNA 检测限为2.71×104拷贝/μL(图2A),EAEC 的最低DNA检测限为3.23×104拷贝/μL,ETEC 的最低检测限为3.23×103拷贝/μL(图2B)。菌液检测中,EPEC和EHEC的最低检测限为1.85×104CFU/mL,ETEC的最低检测限为2.9×103CFU/mL,EAEC 的最低检测限为2.62×104CFU/mL。以上结果表明该方法具有较高的敏感性。
2.5 重复性试验结果 将提取的细菌基因组DNA利用建立好的EHEC和EPEC多重PCR方法与ETEC 和EAEC 多重PCR 方法在不同时间进行8次重复扩增。结果表明每次多重PCR结果都能扩增出相应的目的片段,说明该方法的稳定性、重复性好。
2.6 人工模拟粪便污染样品的检测结果 采用本试验建立的两组多重PCR分别检测,结果都能扩增出相应的目的条带,说明该方法对人工模拟粪便污染样品的检测结果较为准确。
2.7 临床腹泻粪便样品的检测结果 临床样品检测结果显示,均检出phoA 阳性(图3),将phoA阳性菌株分别用EHEC 和EPEC 多重PCR 方法、ETEC 和EAEC 多重PCR 方法进行4 种致 泻性 大肠杆菌的检测,结果检出2 个样品的escV 基因呈阳性,目的条带为544 bp,其余扩增结果均为阴性(图4A)。通过标准单一PCR 进行验证,确证escV 基因在544 bp 处扩增出条带(图4B),且通过测序再次验证了结果。本试验建立的多重PCR 与标准单一PCR 的阳性符合率为100%,表明两组多重PCR 方法均可用于临床样品的检测。

图3 部分临床粪便样本phoA基因扩增结果
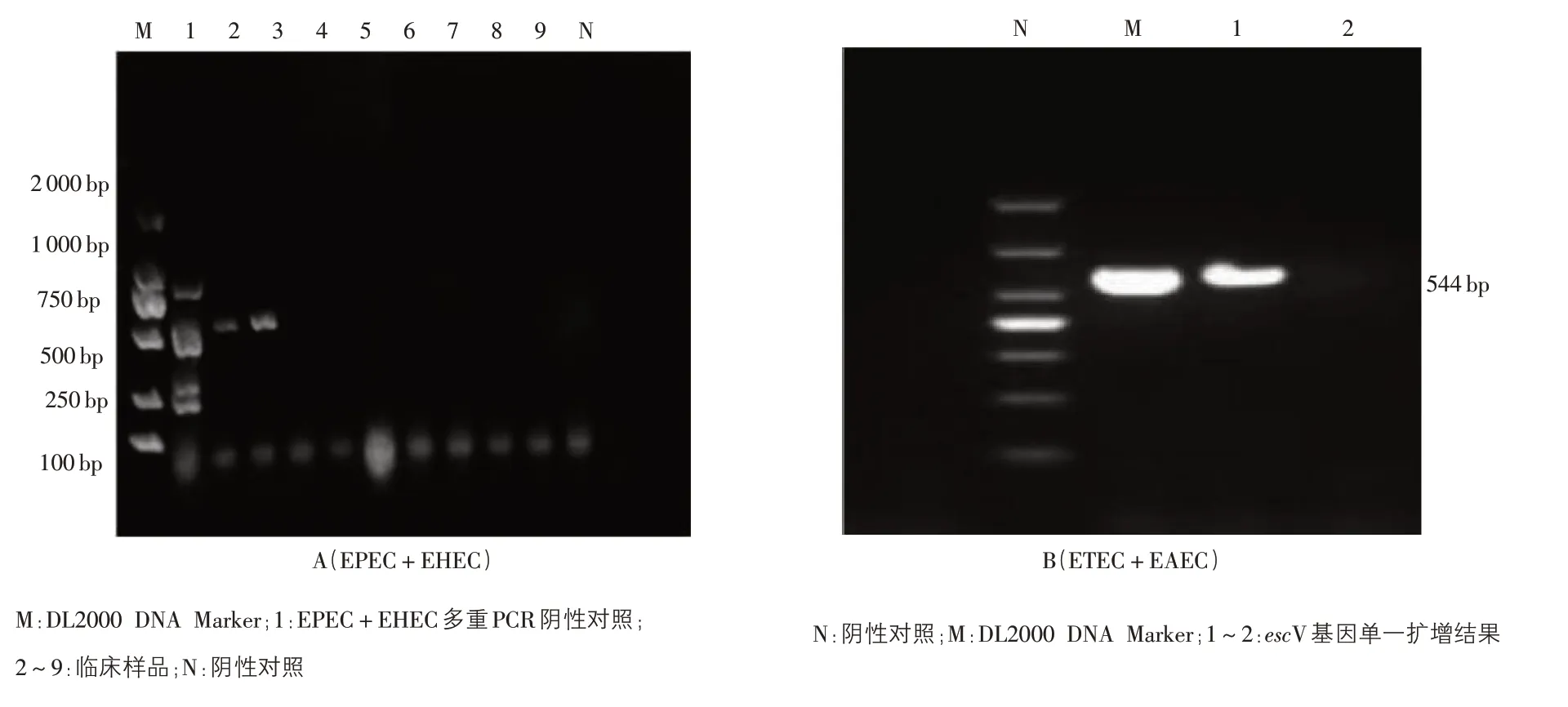
图4 临床粪便样品的多重PCR(A)和单一PCR(B)扩增结果
3 讨论
大肠杆菌作为一种常见的条件致病菌,在大熊猫临床粪便样本中普遍存在。EPEC、EHEC、ETEC 和EAEC 可引起大熊猫以腹泻症状为主的肠道疾病[9]。本研究建立了这4种不同致病性病原的多重PCR检测体系,结果证明该检测体系具有操作简单、快速、灵敏、准确等优点。
多重PCR 在扩增中的特异性和敏感性受到多方面因素的影响,本研究选用9 对毒力基因分别建立了2 组多重PCR,这9 对毒力靶标基因的分子质量大小范围不等,可以使目的片段分布在Marker 不同标尺大小的区域,不易造成对目的片段的误判。对于多重PCR 反应结果影响最大的因素是反应体系的退火温度和引物量。通过引物添加量的优化,可以避免引物问题导致错配和非特异性扩增[10]。Taq酶的添加量过低会造成产量降低,过高会导致非特异性扩增[11]。退火温度的优化可以提高PCR 扩增效率,在合适的范围内,较高的退火温度的特异性较强[12]。延伸时间在多重PCR里与酶的含量有一定的关系,在合适范围内增加延伸时间可以增加产物的量。故本试验对退火温度、引物添加量、酶添加量和延伸时间进行了反复多次优化,成功建立了2 组多重PCR体系,可以有效地检测出样本中的病原菌。张铁男等[13]的研究结果显示,ETEC 的检测下限为2.6×104CFU/mL,本试验方法的检测下限为2.9×103CFU/mL,相比之下用本试验建立的方法检测ETEC更为敏感。
4 结论
本研究建立的2组多重PCR检测方法具有良好的特异性、灵敏性和重复性,在临床样本检测中提高了检出效率,为大熊猫种群4 种致泻性大肠杆菌感染的快速诊断及流行病学调查提供了技术支撑。

