荜茇明碱抗乳腺癌研究进展
马 强 苏 芳 李慧娟 吴小兰 吕运成
1 桂林医学院-邵阳学院附属第一医院医学硕士专业学位研究生联合培养基地 湖南邵阳 422000; 2 广西医科大学附属肿瘤医院 广西南宁 530000
乳腺癌是目前全球女性癌症发病和死亡的首要原因,严重威胁着全球女性健康[1]。由于绝大多数中晚期患者在治疗过程中会逐步耐药,继而出现治疗失败,并引发疾病进展、恶化,甚至死亡[2]。因此,开发新型低毒、高效和廉价的治疗方法和治疗药物,对于控制这种危及生命的疾病具有重要意义。
天然生物碱荜茇明碱(piplartine,PL),又称荜茇酰胺、荜鲃酰胺、荜拨明宁碱等,最初分离自胡椒科植物荜茇。当代研究发现,它具有独特的抗肿瘤活性,可杀伤乳腺癌、肺癌、结肠癌、淋巴瘤、白血病等多种肿瘤细胞[3],然而PL在抗乳腺癌活性与机制方面尚无系统研究。本文回顾了PL近年在抗乳腺癌领域中的研究进展,为临床应用及基础研究提供新思路。
1 来源、结构、理化性质及生物活性
PL于1961年被Atal和Banga分离并命名,1986年由Banerjee等人明确结构。“Piplartine”是文献中出现最早的术语,后商业公司奥德里奇采用新名词——“Piperlongumine”,目前两种名称并存。
PL早先多从天然植物中提取,目前主要来自化学合成。它可按照化学结构分为顺式及反式,但仅有反式结构具有细胞毒活性。其中C7~C8双键及C2~C3双键是最具抗癌活性的一部分结构,常被用于研究增加新修饰,以合成抗瘤活性更高的衍生物[3],见图1。
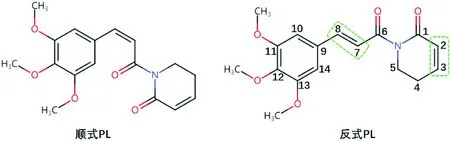
图1 PL的分子结构
PL存在疏水基团,溶解度相对不高,导致在血液循环中易被快速清除,在治疗靶器官区域的蓄积性不佳,对其生物学活性的发挥存在不利影响[4]。
近20年来,研究人员发现PL存在抗肿瘤、抗高血脂、抗血管生成、抗血小板聚集、抗焦虑、抗抑郁、神经保护、抗动脉粥样硬化、抗糖尿病、抗真菌、抗寄生虫等多种功效[5-6]。其中最明显的是其广谱低毒的抗癌潜能,也是目前的研究热点。既往文献已证实,PL对乳腺癌等十余种恶性肿瘤细胞存在明显细胞毒活性,对正常细胞则无显著毒性[7]。
与丰富的药理效能对应,PL对哺乳动物生命活动过程中的多个关键靶点具有调控活性。目前主流观点认为,PL主要通过活性氧(ROS)依赖性的机制——促进癌细胞内ROS蓄积及还原型谷胱甘肽(GSH)耗竭,介导其对参与疾病进展相关通路和核心靶点的调节和乳腺癌的抑制,见图2。
2 PL的抗乳腺癌活性
2.1 促进乳腺癌细胞死亡
PL在体内及体外试验中均能抑制乳腺癌生长,对乳腺癌存在显著的细胞毒活性。多项研究已证实它能激活凋亡、自噬、焦亡、铁死亡等程序性细胞死亡过程,诱导乳腺癌细胞死亡。
陈镝[8]发现PL对三阴乳腺癌细胞系MDA-MB-231和MDA-lMB-l453细胞集落形成存在剂量依赖性抑制效能,可促进癌细胞凋亡。Makhov报道MCF-l7乳腺癌细胞经PL处理后增殖受抑,同时免疫荧光分析可见自噬体形成,提示PL能促进乳腺癌细胞自噬。新近上海交通大学药学院的研究显示,加载了纳米输送系统的新型PL剂型——Tf-lLipoMof@PL,既可促使小鼠乳腺癌4T1细胞GSH降低、GPX4下调、LPO积累,又可增加IL-l1β、LDH和GSDMD表达以及电镜下细胞表面孔斑点现象。鉴于前者为铁死亡验证的关键因素,后者则是焦亡的主要证据;表明PL具有促进乳腺癌细胞焦亡和铁死亡的潜能[10]。
2.2 阻滞乳腺癌细胞周期
细胞周期检查点可检测潜在DNA损伤,并允许在细胞分裂前修复;若损伤无法修复,会引发细胞增殖抑制或者细胞凋亡[11]。而与正常细胞相比,癌症存在大量恶性增殖导致的DNA损伤。因此,抑制G1/S周期可导致癌细胞延迟分裂或进入G0期,抑制G2/M周期则可迫使癌细胞带有持续增加的损伤DNA进入有丝分裂期,诱发有丝分裂灾难,甚至细胞死亡。
Jeong等[12]的报道展示PL能以剂量依赖性方式抑制乳腺癌MCF-l7细胞增殖,流式细胞术测定发现G2/M期细胞分布增加,证实PL通过阻滞周期抑制癌细胞生长。Grigolo[13]发现PL的一种衍生物PL也诱导进细胞G2/M群体增加及G0/G1群体减少,促进乳腺癌细胞周期停滞和增殖抑制。
2.3 遏制乳腺癌EMT激活
上皮-间质转化(EMT)是一种短暂的、可逆的细胞去分化过程,癌细胞能在上皮、部分EMT和间充质细胞状态的各阶段转化。EMT激活不仅可加速乳腺肿瘤转移,还可促进疾病癌性侵袭和治疗抗性,因此抑制EMT能有效遏制乳腺恶性肿瘤远处转移并延缓疾病进展[14]。
Delaney等[15]探索了PL对乳腺癌EMT及侵袭能力的影响,结果显示PL可明显增加MDA-MB-231细胞上皮样形态,抑制癌细胞运动性及侵袭性,还可显著减少4T1细胞的BALB/c小鼠肺转移。Singh等[16]的试验也证实PL的新型纳米制剂能抑制三阴乳腺癌癌症干细胞的EMT。
2.4 遏制乳腺癌血管生成
肿瘤新生血管生成是恶性肿瘤生长、增殖、进展和转移的核心环节,可为癌症细胞生长提供充足的氧气和营养物质供应,并为其远处转移提供必要的途径。长期以来,抑制血管生成都是乳腺癌治疗的重要策略之一[17]。
新近郑州大学的一项研究显示,PL衍生物Ⅱ-14b具有潜在的抗血管生成能力,可在无细胞毒性剂量下抑制HUVECs细胞迁移、侵袭及内皮管形成。该研究发现浓度为0.2 μm的PL能够诱导血管破裂、阻碍HUVEC细胞的迁移与侵袭,并破坏毛细血管样管的形成,还能抑制斑马鱼异种移植物肿瘤的生长和转移[18]。
2.5 乳腺癌放化疗增敏减毒
放化疗是中晚期乳腺癌的标准治疗模式。然而随着疾病发展,绝大多数患者会出现治疗抵抗。此外,治疗相关毒副作用既影响患者的生活质量,也限制临床疗效[19]。因此,寻找有效的增敏减毒手段,对乳腺癌临床治疗实践具有重要现实意义和应用价值。
陈镝[8]报道,与单独使用相比,PL和多柔比星的联合使用对三阴乳腺癌细胞系细胞增殖与细胞活力的抑制更为显著。此外,流式细胞术分析表明二者联用存在出协同效应,可更加明显地诱导癌细胞凋亡,而蛋白质印迹结果显示PL还可提高多柔比星对癌细胞的耐药性。陆叶[20]对PL在恶性肿瘤放射治疗应用和机制的系统研究,显示PL能增强乳腺癌细胞的放射敏感性,降低细胞死亡阈值,恢复细胞放射敏感性。
另外,Ntagwabira[21]发现PL可作为化疗诱导性认知障碍的神经保护剂。在试验中,他探索了在乳腺癌方案TAC(多柔比星、环磷酰胺及多西紫杉醇)处理小鼠中,PL对中枢神经的保护作用。结果显示,在与TAC共同使用时,PL能通过涉及氧化应激和突触可塑性的多因素机制,防止化疗小鼠的社会记忆障碍。
3 PL的抗乳腺癌机制
胞内活性氧(ROS)水平中度上升可诱导转录因子恶性转化,有利于癌细胞存活与恶性增殖。但ROS含量过高会导致氧化损伤,抑制癌细胞维持增殖信号传导、激活侵袭转移、血管生成及细胞死亡抵抗[22]。既往文献已报道,PL对乳腺癌的抑制伴随细胞内H2O2水平上升和GSH浓度下降,同时抗氧化剂N-乙酰-L-半胱氨酸(NAC)可消除PL的抗癌效果。上述结果表明ROS参与并介导了PL对乳腺癌细胞的抑制过程[12]。PL可诱导ROS直接抑制乳腺癌细胞生物过程,也可通过ROS调控PI3K/AKT/mTOR、NF-κB、JAK/STAT3细胞周期等通路与其他核心转录因子的表达,介导其抗乳腺癌效力。
3.1 细胞周期信号通路
细胞周期失调可以实现无限的细胞分裂,是癌症的标志之一。细胞周期蛋白、细胞周期蛋白依赖性激酶(CDK)、CDK抑制剂蛋白在正常细胞周期控制和乳腺癌发生发展进程中均存在重要作用[23]。
Jeong报道PL可通过上调细胞周期蛋白依赖性激酶抑制剂p21水平,下调cyclin D1、p-CDK1、CDK4、CDK6及PCNA蛋白表达,导致乳腺癌细胞周期停滞和增殖抑制。另外,上述过程能被NAC逆转,表明PL能通过ROC蓄积介导细胞周期抑制作用[12]。Shrivastava[24]的试验发现,PL能以浓度依赖的方式上调p21 mRNA,进而下调cyclin D1等细胞周期调节蛋白的表达,导致三阴乳腺癌细胞增殖抑制。
3.2 PI3K/AKT/mTOR信号通路
PI3K/AKT/mTOR信号通路在增殖、生长和存活等细胞过程中存在重要作用,此通路异常激活是恶性肿瘤常见病理生理表现和疾病干预靶点[25]。已有大量研究报道PL通过下调PI3K/AKT/mTOR通路抑制乳腺癌。
Makhov发现PL可抑制乳腺癌细胞中AKT靶蛋白的磷酸化,进而抑制mTORC1活性,并促进自噬标志物LC3-II的积累;同时NAC能完全逆转上述变化,提示PL通过ROS依赖性的机制抑制AKT/mTOR通路,促进乳腺癌自噬。
值得注意的是,Shrivastava[24]的研究证实PL也能通过直接抑制PI3K/AKT/mTOR途径诱导三阴乳腺癌细胞凋亡。在试验中,他观测到PL可与PI3K及mTOR激酶的保守结构域发生物理相互作用,抑制mTOR途径并下调Bcl-2,进而促进Bax表达及其介导MDA-MB-21细胞凋亡。
3.3 JAK2/STAT3信号通路
JAK2/STAT3信号通路可在乳腺癌细胞的增殖、血管生成和EMT激活过程中发挥重要作用。其中,STAT3参与氧化应激、自噬、线粒体、肿瘤转移前生态位的形成等病理生理过程,与乳腺癌的发生、发展也存在密切关联,是当下乳腺癌临床及临床前研究中的明星靶点[26]。
陈镝[8]报道PL能显著降低MDA-MB-231细胞STAT3表达,通过抑制JAK2/STAT3途径下调Bcl-2蛋白水平,诱导Bax及其介导乳腺癌凋亡。此外,他的另外一项研究发现PL可通过ROS抑制STAT3活化来调控Survivin和HIF-1α表达,进而上调Bcl-2及p53等凋亡分子以促进MDA-MB-231细胞死亡;同时NAC可阻断PL对p-STAT3的抑制及其介导MDA-MB-231细胞凋亡,证实PL通过ROS依赖性方式介导STAT3-凋亡通路,促进乳腺癌细胞凋亡[27]。
3.4 NF-κB信号通路
NF-κB在细胞因子诱导的基因表达中起关键调控作用,可编码多种生长因子和调控因子,并广泛参与免疫反应、氧化应激、炎症反应、肿瘤发生、细胞凋亡等多种生物过程,其中也包括乳腺癌的增殖和转移等疾病进程[28]。
Awasthee[29]报道PL可诱导乳腺癌细胞产生ROS,还可通过调解葡萄糖输入、NF-κB活化和lncRNAs表达,增强其对乳腺癌的抑制。Jeong等[12]的研究显示,PL能通过下调IKKβ表达,减弱NF-κB p65的核易位,从而遏制ER阳性乳腺癌细胞增殖。同时,上述过程可为NAC逆转,表明PL能通过ROS依赖的方式,抑制NF-κB通路及其乳腺癌调控。
3.5 其他通路及靶点
除了上述通路,PL诱导的胞内ROS蓄积,还通过调控其他通路和转录因子表达,参与乳腺癌疾病进程。
Li[30]报道PL可通过促进ROS积累,介导JNK和p38激活MAPK,继而上调TRAIL受体DR5的表达,并最终增强TRAIL诱导的MDA-MB-231细胞凋亡。Park[31]发现PL能上调ROS水平降低SETDB1表达,干预FosB的转录活性,进而加速乳腺癌MCF7细胞死亡。Delaney[15]证实PL可通过促进ROS蓄积,抑制TGFb介导的乳腺癌EMT促进因子ZEB1与Slug的表达。
Punganuru[32]发现PL的一种衍生物能通过诱导ROS生成,激活p53突变并恢复细胞中突变R3H的活性,诱导乳腺癌SKBR3细胞死亡。Jin[33]的研究表明PL能通过ROS依赖性机制,下调乳腺癌细胞中HER家族受体HER1、HER2和HER3表达,而HER2的过表达能进一步增加MCF7细胞对PL的敏感性。
4 讨论
综上所述,PL可通过ROS调控PI3K/AKT/mTOR、NF-κB及JAK2/STAT3等传导通路,介导干预凋亡蛋白、细胞周期蛋白、癌基因及抑癌基因等核心因子表达,进而促进乳腺癌细胞死亡,抑制细胞周期、EMT激活和血管生成,还能通过放化疗增敏减毒为乳腺癌治疗带来裨益,具有巨大的研究价值和光明的应用前景。
然而,迄今为止关于PL的研究多为细胞及动物试验,研究范围主要集中于细胞毒性相关表型及调控靶点领域的基础研究阶段,尚缺乏更有说服力的临床试验。另外,尽管既往细胞及动物试验未发现PL存在明显毒性作用,但鉴于它也可提升正常细胞ROS水平,而且长期中等浓度ROS水平具备促炎、促癌的等致病潜能,因此探讨其远期毒副反应,对PL未来应用存在重要意义。同时,胞内ROS可来源于线粒体、内质网和过氧化物酶体等细胞器,与细胞呼吸过程、脂肪酸代谢、药物及毒素代谢等生理病理过程也存在密切关联,PL与上述亚细胞结构和生物过程有无联系,还有待更加深入的研究。
由于PL水溶性不佳,降低了治疗靶区域暴露剂量,不利于其在体内的代谢、药效的发挥、口服或静脉等标准制剂的合成与后续研发。为克服上述缺陷,添加结构修饰研发新的衍生物,以及研制脂质体、微球和纳米颗粒制剂等新的药物载体,设计性能优越的理想药物分子综合体是一条有前景的道路。瘤内注射、动脉灌注等给药方式可显著提高靶器官内的药物浓度,能否用以增强PL的控瘤效果,值得进行探索。此外,PL还具有调脂、降糖、抗炎、调节免疫等多重药理学特性,除了作为其他抗乳腺癌药物的生物增强剂,PL是否能调控乳腺癌中代谢重编程、炎症、免疫失衡等重要特征和病理生理改变,甚至成为乳腺癌支持治疗过程中的代谢或免疫调节剂,也具有进一步研究的价值。

