Ag-HA涂层种植体对牙周炎大鼠牙周炎症及种植体骨结合能力的影响
马 兰,杨 磊,丹 丹,贾 慧,来卫东
(邯郸市口腔医院,河北 邯郸 056001)
牙周炎是微生物相关导致牙周附着丧失的炎症,已经成为成人牙列缺损、牙列缺失的主要病因,其对机体的损伤不仅限于口腔,细菌可通过血运循环进入全身,是许多全身系统性疾病的危险因素[1-2]。口腔种植修复技术逐渐成为恢复口腔美观、功能的首选方式,远期预后良好[3]。但牙周炎患者自身存在牙周致病菌,口腔固有菌群失调、术中致病菌清理困难、常规种植体表面处理无抗菌性能,使常规种植的种植体周围炎发生率较高,故改进种植体材料成为重点研究方向[4]。此外,种植体成功修复的前提为良好骨矿化及骨结合能力,种植体材料则是影响其能力的重要因素[5]。种植体表面的羟基磷灰石(hydroxyapatite,HA)涂层与哺乳动物牙齿无机质成分相同,结构相似,生物活性、相容性较好,但HA易吸附蛋白质、氨基酸及其他有机质,给细菌提供营养,利于细菌生长繁殖[6]。为增加HA抗菌性,常将其与不同具有抑制性的金属结合,其中Ag+具有微动效应,对种植体周围炎中革兰阴性细菌有较强杀菌作用[7],因此将Ag+与HA混合形成新骨结合材料Ag-HA,无论是在富营养还是贫营养环境都表现出抗菌性能,可加强细胞附着,促进成骨性能[8-9]。本研究观察了Ag-HA涂层种植体对牙周炎大鼠牙周炎症及种植体骨结合能力的影响,旨在为Ag-HA涂层种植体的临床应用提供实验依据。
1 实验材料与方法
1.1实验动物 40只牙周健康清洁雄性大鼠,确认大鼠无真菌感染、系统性疾病,5~8周龄,体重225~255 g,由河北医科大学(实验动物公共服务平台)提供,合格证号:SYXK(冀)2020-002。大鼠于层流架内由专人负责管理分笼饲养,饲养环境定期消毒,环境温度22~25 ℃,相对湿度40%~60%,饲养垫以干净的木屑为主,自来水、普通饲料喂养,自由饮食、饮水,适应性喂养1周后开始实验。本实验经邯郸市口腔医院伦理委员会批准(IRM-DWLL-2019036)。
1.2Ag-HA涂层制备方法 将97%的HA粉末(瑞士Sulzer Metco,粉末粒径15~50 μm)和3%Ag粉混合2 h,使用瑞士Sulzer Metco真空等离子喷涂设备在30 mm×30 mm×2 mm钛合金基材上制备HA涂层和载Ag抗菌剂的Ag-HA涂层,喷涂参数设置:等离子气体Ar 40 L/min,等离子气体H210 L/min,喷涂距离300 mm,涂层厚度200 μm,真空室气压100 Pa,送粉载气Ar 2.0 L/min,送粉率20 g/min,电流650 A,电压60 V。根据 ASTM C-633标准,HA和Ag-HA涂层结合强度分别为20.1 MPa、23.4 MPa。Ag-HA涂层由HA、磷酸三钙、氧化钙、Ag+组成,磷酸三钙、氧化钙由HA喷涂中分解而得。电解液中Ag+浓度0.5 mmol/L,溶液温度40 ℃,pH 4.0,脉冲电位-2 V,沉积时间2 h,热处理温度700 ℃,利用CHl660D电化学工作站,肽片为工作电极、铂盒板为对电极、饱和汞电极为参比电极进行电化学沉积,用烧杯取电解液100 mL,将其置于恒温加热磁力搅拌器中,温度设置40 ℃,初始电位为3次开路电位测量均值,高电位0.30 V、低电位-2 V,阶跃72 次,脉冲宽度100 s,间隔1 s采样,静置0.5 s,完成电沉积,将制得样品放入马弗炉高温处理,升温速率5 ℃/min,然后进行热处理、保温得出沉淀物,将沉淀物用去离子水5 L洗涤,放入高温箱干燥,温度设置为70 ℃,得到的晶体首先进行马尔文粒度测试及其他性能测试,从而检测获得材料的小大、含Ag量及HA合成情况,使用玛瑙研磨器研磨,得到Ag-HA颗粒。
1.3实验方法 40只大鼠采用丝线结扎和10%的高糖水饲养方法建立牙周炎模型:采用5%的水合氯醛腹腔注射麻醉大鼠,将其仰卧位固定后撑开上下切牙,暴露上颌第一磨牙和第二磨牙间隙,扩大间隙后用0.2 mm正畸结扎丝于大鼠第一磨牙穿入腭侧远中邻间隙,颊侧穿出,结扎丝位于龈沟,防止脱落,再用10%的高糖水和黏性饮食饲养,每日更换新鲜食物、水,每3 d检查1次结扎丝有无脱落,发现脱落重新结扎。结扎饲养8周后随机抽取3只大鼠,内眦静脉采血,采用ELISA法检测炎症因子[肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、白细胞介素-1β(IL-1β)]水平,然后麻醉大鼠,使用牙周探针重复测量3次龈沟出血指数、牙龈指数、探诊深度,均由一人统一完成测量,再根据牙龈炎症、牙槽骨破坏情况确定牙周炎是否造模成功。确认造模成功后,去除结扎丝,恢复正常饮食,然后将大鼠随机分为牙周炎组5只、Ag-HA涂层组18只和HA涂层组17只。牙周炎组大鼠不给予任何干预;其余2组大鼠禁食、禁饮12 h后,肌内注射1.5 mL速眠新,10 min后再将30 g/L的戊巴比妥钠按1 mL/kg肌肉注射,麻醉成功后消毒固定大鼠,Ag-HA涂层组植入Ag-HA涂层种植体,HA涂层组植入HA涂层种植体,缝合创口,术后肌肉注射头孢唑啉钠预防感染。
1.4检测指标及方法
1.4.1牙周指标 分别于术前及术后1周、2周、4周、8周对各组大鼠进行牙周检查,记录龈沟出血指数、牙龈指数、探诊深度。龈沟出血指数测量分级:0为牙龈健康,无炎症、出血;1为牙龈有炎症改变,探诊不出血;2为探诊后出现点状出血;3为探诊后出血呈线状;4为出血溢满、溢出龈沟;5为自动出血。牙龈指数测量分级:0为牙龈正常;1为炎症轻,牙龈颜色轻度改变、水肿;2为炎症中度,牙龈颜色红、水肿,探诊出血;3为炎症重,牙龈颜色红肿或有溃疡形成,有自发性出血倾向。记录颊侧近中、中央、远中,舌侧近中、中央、远中共6个部位牙周探诊深度,正常牙龈龈沟深度不超过3 mm。
1.4.2血清炎症因子水平 分别于术前及术后1周、2周、4周、8周内眦静脉采血,3 000 r/min离心10 min获取血清,采用大鼠TNF-α、IL-6、IL-1β ELISA试剂盒(上海初态生物科技有限公司)检测相应指标水平。
1.4.3骨结合能力 根据血清碱性磷酸酶(ALP)水平和种植体-骨结合率评估骨结合能力。分别于术后1周、2周、4周、8周内眦静脉采血和处死动物(术后1周、2周、4周时间点Ag-HA涂层组、HA涂层组各4只,牙周炎组1只,术后8周Ag-HA涂层组、HA涂层组各5只,牙周炎组2只),采用大鼠ALP ELISA试剂盒(上海初态生物科技有限公司)检测3组大鼠血清ALP水平。Ag-HA涂层组、HA涂层组取大鼠种植体及其周围3 mm范围内骨组织,牙周炎组取牙周炎周围3 mm范围内的骨组织,采用美国西门子Inveon MM CT系统行显微CT扫描,进行三维重建、骨形态计量,种植体周围1 mm的区域设为感兴趣区域,将扫描完成的组织块用德国E300CP EXAKT硬组织切片机、德国E400CS艾卡特硬组织磨片机及其配套平行粘合压片装置制作硬组织切片,厚度30 μm,每个标本取2张切片进行亚甲基蓝-酸性品红染色,用Image-ProPlus 6.0 专业图像处理软件计算种植体-骨结合率。
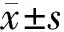
2 结 果
2.1各组大鼠牙周指数比较 研究期间Ag-HA涂层组大鼠因麻醉意外死亡1只。Ag-HA涂层组和HA涂层组大鼠术后1周、2周、4周、8周的龈沟出血指数、牙龈指数、探诊深度均明显低于同组术前及同期牙周炎组(P均<0.05),且Ag-HA涂层组术后1周、2周、4周的探诊深度均明显低于同期HA涂层组(P均<0.05)。见表1。
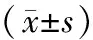
表1 牙周炎各组大鼠术前及术后不同时间牙周指标比较
2.2各组大鼠血清炎症因子水平比较 Ag-HA涂层组和HA涂层组大鼠术后4周、8周的血清TNF-α、IL-6、IL-1β水平均明显低于同组术前及同期牙周炎组(P均<0.05),且Ag-HA涂层组术后4周、8周的血清TNF-α、IL-6、IL-1β水平均明显低于同期HA涂层组(P均<0.05);3组大鼠术前及术后1周、2周的血清TNF-α、IL-6、IL-1β水平比较差异均无统计学意义(P均>0.05)。见表2。
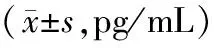
表2 牙周炎各组大鼠术前及术后不同时间血清炎症因子水平比较
2.3各组大鼠骨结合能力比较 Ag-HA涂层组和HA涂层组大鼠术后1周、2周、4周、8周的血清ALP水平均明显高于同期牙周炎组(P均<0.05);Ag-HA涂层组和HA涂层组大鼠术后1周、2周的血清ALP水平比较差异均无统计学意义(P均>0.05),Ag-HA涂层组大鼠术后4周、8周的血清ALP水平和术后2周、4周、8周的种植体-骨结合率均明显高于同期HA涂层组(P均<0.05)。见表3。
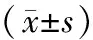
表3 牙周炎各组大鼠术后不同时间骨结合能力比较
3 讨 论
牙周炎是导致成年人牙齿缺失的主要原因,种植牙与正常牙结构相似,咀嚼效率高、舒适美观,因此种植修复成为牙缺失治疗最常用的手段[10-11],但存在种植修复后易感染问题。种植体与骨间无牙周膜保护,一旦发生感染,炎症会迅速进展,种植体和周围骨结合被破坏,影响新骨形成,导致种植修复失败[12]。传统抗生素治疗对细菌生物被膜引起的感染效果欠佳,但种植体抗菌涂层的出现赋予了种植体抗菌性能,为牙周炎患者种植修复术后感染提供了新思路。
随着国内口腔种植技术的广泛开展,各种植体广泛应用于临床,种植体周围炎的发生率也在不断提高[13-14]。HA是高温熔融雾化后高速喷射在种植体表面而形成的涂层,因其具有良好的生物相容性、生物安全性而成为最经典的种植体涂层,能增加种植体与骨组织接触的表面积,增强了生物-金属间的结合能力,因此术后前期稳定性较好,但HA涂层种植体的高纯度结晶涂层会被逐渐吸收,之后骨组织直接与种植体接触[15]。Ag+具有抑菌作用,它可直接与细菌接触,可抑制、杀灭细菌[16]。本研究比较了HA涂层种植体和Ag-HA涂层种植体修复对牙周指标的影响,结果显示2组大鼠术后1周、2周、4周、8周的龈沟出血指数、牙龈指数、探诊深度均降低,且Ag-HA涂层组大鼠术后1周、2周、4周的探诊深度低于HA涂层组,提示Ag-HA涂层种植体在改善牙周炎大鼠探诊深度方面更有优势,同时提示探诊深度的改变与龈沟出血指数、牙龈指数关系不大。炎症因子TNF-α、IL-6、IL-1β可通过旁分泌、自分泌形式调节免疫细胞,增强破骨细胞活性,参与种植体周围炎的发生发展[17-18]。生物材料引发感染中有45%是细菌黏附在材料表面破坏材料结构造成的。HA用于种植体表面涂层,因其抑菌效果不佳,故常在材料中加入抗生素,但抗生素易被体液迅速冲洗,不能长期保护材料,另外微生物在抗生素长期作用下可产生耐药性[19]。Ag+在低浓度范围即可对致病菌表现出较强抗菌活性[20],其从Ag-HA涂层种植体表面缓慢释出,通过静电力吸附于带负电的细菌细胞壁,与细胞壁发生肽聚糖反应,破坏细菌固有成分;Ag+穿透细胞壁,导致其破裂,细胞质外流,可导致细菌死亡;Ag+还能破坏DNA复制,其与DNA相结合,置换DNA分子双螺旋结构中的氢,导致细菌DNA分子结构变形,使细菌失活[21-22]。本研究结果显示,Ag-HA涂层组大鼠术后2周、4周血清TNF-α、IL-6、IL-1β水平明显低于术前及同期HA涂层组,提示Ag-HA涂层种植体有助于减轻牙周炎大鼠术后炎症反应,利于种植体存活和种植成功。
种植体涂层可通过改变种植体表面微观形态、化学形成,在种植体-骨结合过程中起作用[23]。骨结合概念于1969年由Branemark教授提出,当时需取出种植体和部分软硬组织才可观察骨结合情况,切片技术的发明使得骨结合理论得到证实[24]。种植体表面粗化可增加表面张力,获得更大骨结合面积,促进成骨细胞吸附、分化、扩增,可增加种植体-骨结合能力,促进成骨细胞ALP表达[25]。ALP在骨矿化中起重要作用,是成骨细胞表型的可靠标志,其活性可反映成纤维细胞转化为成骨细胞的趋势。黄正非等[26]研究显示,氧化锆涂层钛种植体植入组兔的骨-种植体结合率较纯钛种植体植入组高,涂层后种植体表面粗糙度增加,粗糙度大利于成骨细胞矿化,促进种植体-骨结合形成。本研究结果显示,Ag-HA涂层组大鼠术后4周、8周的血清ALP水平和术后2周、4周、8周的种植体-骨结合率均明显高于同期HA涂层组,提示Ag-HA涂层种植体中Ag+可改变材料表面粗糙度,使得种植体-骨结合能力更好。
综上所述,Ag-HA涂层种植体有助于改善牙周炎大鼠牙周指标,减轻炎症反应,提高大鼠种植体骨结合能力。
利益冲突:所有作者均声明不存在利益冲突。

