miR-183-5p靶向FOXN2促进前列腺癌细胞PC3增殖及侵袭的机制研究
杨帅,汪盛,陈志军,伍宏亮,关翰
(蚌埠医学院第一附属医院泌尿外科,安徽 蚌埠 233000)
前列腺癌严重威胁人类生命健康,2021年癌症数据统计显示,不论是新发病率还是死亡率,前列腺癌在男女中均位于第3位,且>65岁人群的发病率逐年升高[1]。前列腺癌的发病过程复杂,影响因素较多,早期诊断治疗患者可得到较好的治疗效果,一旦病情发展至晚期,常规抗雄激素治疗常常无效,进展至去势抵抗性前列腺癌预后极差。故尝试寻找前列腺癌新的诊断及治疗方向,对于提高前列腺癌诊断和治愈具有重要意义。微小RNA(micro RNA,miRNA)在肿瘤的发生发展中发挥着重要的作用[2],可通过与互补位点结合诱导靶点mRNA的降解或翻译后的表达[3-4],调控细胞分化、发育、增殖、凋亡等多种生理功能。 GEO数据库中GSE36803数据集显示miR-183-5p在前列腺癌中显著高表达,但相关报道极少,miR-183-5p对前列腺癌细胞PC3生物学功能影响的研究尚无。因此,本研究拟通过在前列腺癌细胞PC3细胞中过表达miR-183-5p探索miR-183-5p对细胞生长及侵袭作用的影响。
1 材料与方法
1.1 细胞培养及瞬时转染
人前列腺癌细胞株(DU145、LNCAP及PC3)、人前列腺上皮细胞RWPE-1来自ATCC细胞库。细胞培养在10%胎牛血清、100 U/mL含青霉素-链霉素的RPMI-1640培养基中,在37 ℃、5%二氧化碳的细胞培养箱中培养。由GenePharma公司(中国,上海)合成Hsa-miR-183-5p模拟物(miR-183-5p mimics)和阴性对照(miR-NC),叉头框蛋白(Forkhead box N2,FOXN2)过表达质粒(pcDNA3.1-FOXN2)和空质粒(Vector-NC),转染过程使用Lipo3000和Opti-MEM培养基,转染效率通过荧光定量聚合酶链式反应(real-time quantitative polymerase chain reaction,RT-qPCR)进行验证。
1.2 RT-qPCR实验
使用Trizol提取细胞中的核糖核酸(ribonucleic acid,RNA),严格按照说明书进行操作,RNA样品在260 nm和280 nm下的光密度比值(OD260/280)=1.9~2.1代表RNA无明显杂质可用于后续实验。使用逆转录试剂盒(Thermo Fisher)按照说明书进行操作。miRNA逆转录引物为RT-Primer,内参和mRNA的逆转录引物为Random Hexamer Primer。将RNA逆转录为cDNA。荧光试剂盒购买自罗氏公司。八连管中加入引物,cDNA模板、荧光染料,无菌去离子水补足体积至20 μL。上机检测仪器PCR条件设置为 95 ℃ 10 min,40个循环,循环条件95 ℃ 15 s,60 ℃ 1 min。循环结束后在60 ℃时收集数据,绘制扩增曲线。以U6作为内参,通过2-△△Ct法计算miR-183-5p的相对表达量。
1.3 MTT实验
转染48 h后,2 000个细胞/孔接种于96孔板中,将细胞分为24、48、72、96 h组,在每孔加入MTT试剂20 μL,培养4 h后去除上清,加入200 μL二甲基亚砜(DMSO),37 ℃培养箱孵育10 min后检测每孔的OD值,吸收波长570 nm。
1.4 5-乙炔基-2′-脱氧尿苷(5-Ethynyl-2′- deoxyuridine,Edu)实验
使用BeyoClickTMEdU-594细胞增殖检测试剂盒进行细胞增殖检测,将转染48 h后的细胞布孔到24孔板中,细胞核使用4′,6-二脒基-2苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI,碧云天公司,C1002)染色标记,实验方法遵循生产商的使用说明。使用荧光显微镜拍照,在高倍镜下每张玻片随机选取5个不同的视野。
1.5 细胞克隆实验
将转染后的前列腺癌细胞(500个/孔)种植到6孔板中,3~4 d进行细胞换液,培养8~12 d后观察阳性克隆团块形成(>50细胞/团块)数量。甲醇固定15 min,结晶紫进行染色20 min后拍照。
1.6 Transwell小室迁移及侵袭实验
侵袭实验使用Transwell小室在24孔板中进行,在小室的基底膜上层加入基质胶。将转染后的细胞(5×104个/孔)种植于小室上层,24 h后擦去上层细胞,甲醇固定小室下层侵袭的细胞15 min,然后用结晶紫染色20 min。迁移实验所有操作步骤相同,但不使用基质胶。高倍显微镜下(200×)每个小室中随机选取5个视野进行拍照。
1.7 生物信息学靶基因预测
采用TargetScan (http://www.targetscan.org/)、miRDB (https://mirdb.org/)、miR Walk(http://mirwalk.umm.uni-heidelberg.de/)、miR Tarbase (https://ngdc.cncb.ac.cn/)预测miR-183-5p的潜在靶基因,将数据库筛选出靶基因取交集,最终筛选出26个潜在下游靶基因,结合既往文献报道,选择FOXN2作为靶基因进行进一步研究。
1.8 Western blot
48 h后从转染的PC3细胞中提取蛋白并进行BCA蛋白浓度测定。采用SDS-PAGE配制试剂盒配置10%的分离胶,电泳时的电压设置为80 V运行约30 min电压调增至110 V。PVDF转膜时电流设置为200 mA运行90~120 min。封闭使用5%的脱脂奶粉,摇床封闭2~3 h。孵育一抗使用的抗体分为:内参-小鼠来源的β-actin(1∶1 000,AA128,碧云天公司),目的-鼠来源的FOXN2(1∶1 000,ab17204,Abcam公司)。孵育二抗使用的抗体有:羊抗小鼠(1∶1 000,A0216,碧云天公司),羊抗兔(1∶1 000,A0208,碧云天公司)。最后使用Bio-Rad公司的曝光仪进行条带发光显影。
1.9 裸鼠皮下成瘤实验
裸鼠购买自杭州子源实验动物科技有限公司,品系为BALB/c Nude小鼠,SPF级别,4周雄性,饲养于SPF级屏障系统内,使用无菌饲料及垫料[生产许可证号SCXK(浙)2019-0004]。慢病毒LV-miR-183-5p及其对照慢病毒购自上海吉凯生物科技有限公司。按照说明书进行操作,将过表达miR-183-5p的慢病毒和对照病毒按病毒感染复数(multiplicity of infection,MOI)MOI=10感染PC3细胞,72 h后使用2 μg/mL嘌呤霉素筛选细胞。慢病毒转染效率及方法是否成功通过转染带绿色荧光蛋白的(green fluorescent protein,GFP)慢病毒,在荧光显微镜下观察绿色荧光明确。取0.2 mL细胞悬液(细胞密度1×107/mL)分别在裸鼠腋下皮下接种,瘤体生长至合适大小后处死裸鼠,获取瘤体。肿瘤体积=长径×短径2×0.5。
1.10 荧光素酶报告基因实验
应用TargetScan预测库预测miR-183-5p的靶基因可能为FOXN2并且存在结合位点,构建含有FOXN2的3'UTR序列及突变后FOXN2的3′UTR序列,合成两种目的基因片段分别克隆至双荧光素酶报告基因载体上,构建双荧光素酶报告基因野生型载体(p-FOXN2-3′UTR Wt)及其突变型载体(p-FOXN2-3′UTR Mut)。使用Lipofectamine 2000转染试剂分别将两种载体质粒与miR-183-5p mimics或miR-NC阴性对照共转染PC3细胞,应用双荧光素酶检测系统检测各组细胞。
1.11 统计学分析
2 结果
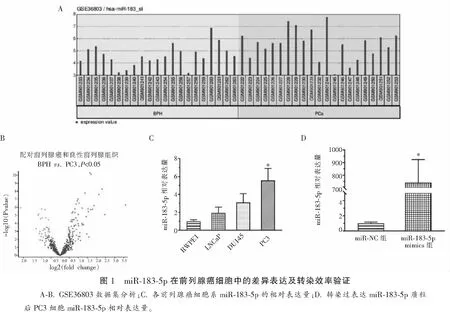
2.1 miR-183-5p在前列腺癌细胞中的差异表达及转染效率验证
分析GEO数据库GSE36803数据集,收集和处理来自21对前列腺癌和癌旁良性前列腺组织的总RNA进行差异miRNA检测,选择P<0.05且排名靠前的miR-183-5p进行研究。miR-183-5p在前列腺组织中的表达高于癌旁组织(P<0.05)。前列腺上皮细胞RWPE-1、3种前列腺癌细胞中采用RT-qPCR检测miR-183-5p的相对表达量,癌细胞中miR-183-5p表达量均高于上皮细胞,PC3细胞中miR-183-5p表达量最高(P<0.05),故选取PC3细胞进行后续实验。为确保后续实验可靠性,瞬时转染PC3细胞后应用RT-qPCR检测PC3细胞中miR-183-5p表达量,结果高于对照组(P<0.05),可进行后续功能学实验。见图1。
2.2 过表达PC3细胞中的miR-183-5p可促进细胞的增殖、迁移及侵袭
miR-183-5p过表达后可增强PC3细胞的增殖能力。miR-183-5p mimics组细胞迁移及侵袭细胞数量均多于对照组(P<0.05)。在细胞内转染慢病毒LV-miR-183-5p和LV-miR-NC,在细胞内稳定过表达miR-183-5p进行裸鼠皮下成瘤实验,皮下注射细胞15 d后瘤体成形,LV-miR-183-5p组瘤体体积较大,重量较重,生长较对照组相快(P<0.05)。见图2。
2.3 过表达FOXN2可逆转miR-183-5p mimics的促癌作用
采用TargetScan、miRDB、miR Walk、miR Tarbase数据库预测miR-183-5p的潜在靶基因,将数据库筛选出靶基因取交集,最终筛选出26个潜在下游靶基因包括ITGB1、IDH2、PPP2CB、FOXN2、CTDSPL、AKAP12、KIF2A、SREK1IP1、EZR、STC1、KLHL24、PDCD4、LRP6、CLCN3、ENAH、PDCD6、ARHGAP21、TMED7、ARFGAP2、SRSF10、FOXP1、CELF1、NR3C1、ZBTB34、DGKH、NUFIP2。TargetScan网站预测miR-183-5p与FOXN2结合位点。在PC3细胞中瞬转双荧光素酶报告基因野生型载体(p-FOXN2-3′UTR Wt)及其突变型载体(p-FOXN2-3′UTR Mut)、miR-183-5p mimics 或miR-NC后进行实验,miR-183-5p和野生型载体共转染组荧光素酶相对活性下降(P<0.05),提示miR-183-5p可直接和FOXN2的3′UTR区结合。Western blot结果提示转染miR-183-5p后FOXN2的蛋白表达量下降。在转染miR-183-5p的基础上共转染FOXN2过表达质粒(pcDNA3.1-FOXN2)和空质粒(Vector-NC)进行CCK8实验,共转染pcDNA3.1-FOXN2后细胞96 h的OD值下降(P<0.05),提示增殖能力减弱;克隆形成实验结果显示共转染pcDNA3.1-FOXN2组克隆形成数量低于对照组(P<0.05),侵袭及迁移实验说明共转染pcDNA3.1-FOXN2组细胞侵袭及迁移细胞数量下降(P<0.05)。故miR-183-5p可直接靶向FONX2,降低FOXN2的表达,过表达FOXN2可逆转miR-183-5p的促癌作用。见图3。
3 讨论
miRNA的异常表达虽不直接发挥功能,但通过调控转录后基因表达参与机体各种生理过程,并且miRNA可通过各种方式进入循环系统,与AGO2等RNA结合蛋白结合,防止被降解,可作为各种肿瘤的潜在标志物[5]。miR-183-5p在众多肿瘤或肺肿瘤疾病的发生发展过程中异常表达,可靶向调节FAT1基因,通过miR-183-5p/FAT1/YAP1信号通路调节唾液腺腺样囊性癌的生物学行为[6],还可被长链非编码RNA吸附发挥作用,如lncRNA LINC00960即可通过海绵吸附miR-183-5p从而减少其对下游靶基因泛素连接酶 Nrdp1的降解作用从而发挥功能[7];在乳腺癌中,过表达的miR-183-5p可引起非肿瘤性乳腺上皮细胞的侵袭和增殖能力增强[8];miR-183-5p 在肌萎缩侧索硬化症患者脊髓中异常上调,并可以靶向SOSTM1/p62减少其表达并导致神经元和非神经元细胞中TDP-43蛋白水平的增加[9];miR-183-5p还在甲基苯丙胺成瘾过程中发挥重要作用,重复注射甲基苯丙胺可增加纹状体miR-183-5p表达并通过调节大鼠的糖皮质激素受体的表达来调节甲基苯丙胺成瘾诱导的运动,可作为甲基苯丙胺诱导的新型调节剂[10];在大肠癌中,miR-183-5p的过表达与结直肠癌的晚期临床分期、淋巴结转移和不良预后高度相关[11]。本研究发现miR-183-5p在前列腺癌中显著高表达,且在PC3细胞中过表达miR-183-5p后PC3细胞的增殖能力增强,侵袭及迁移能力也增强,过表达miR-183-5p的PC3细胞在裸鼠体内的生长速度较对照组相比显著增加,即miR-183-5p可能在前列腺癌中发挥促癌的作用。
miR-188-5p与FOXN2 的 3'-UTR 结合,导致 FOXN2 表达失调从而促进癌症进展[12];FOXN2在肝癌组织和细胞中的表达均显着降低,FOXN2的上调显着抑制肝癌细胞的增殖和侵袭[13];FOXN2是 miR-203a-5p的直接下游靶基因,miR-203a-5p的上调可逆转WT1-AS基因在宫颈癌细胞中的抑癌作用[14],故FOXN2在乳腺癌组织和细胞中表达下调,并与肿瘤大小、病理分级和淋巴结转移相关,可显着抑制乳腺癌细胞的增殖、迁移和侵袭,抑制FOXN2还可通过调节SLUG促进乳腺癌的上皮-间质转化(epithelial-mesenchymal transition,EMT)[15]。本研究表明,体内或体外miR-183-5p的过表达均增强PC3细胞的增殖、侵袭和侵袭能力,且miR-183-5p可直接结合FOXN2的3’UTR区抑制其表达。此外,本研究还显示共转染pcDNA3.1-FOXN2后可逆转miR-183-5p mimics的促癌作用,提示miR-183-5p可通过靶向FOXN2促进细胞的恶性进展。
综上,miR-183-5p在前列腺癌中发挥促癌作用,并可能成为前列腺癌的新的监测和治疗靶点。

