控制营养状况、预后营养指数对骨髓增生异常综合征患者预后分析
张权娥 陈秋妮 陈月 张丽娟 马晶晶张欣 陈侃侃 王春玲 何正梅
1南京医科大学附属淮安第一医院血液科 (江苏淮安 223300);2南京医科大学血液病重点实验室(南京 210029)
骨髓增生异常综合征(myelodysplastic syndromes,MDS)是一组起源于造血干细胞的异质性髓系克隆性疾病,表现为无效造血、难治性血细胞减少,有高风险向急性髓系白血病(acute myeloid leukemia,AML)转化的特征[1-2]。MDS 患者临床表现和预后有很大的异质性,治疗方式应根据患者的危险程度个体化选择[3]。个性化诊疗最重要的是更加精确的预后风险分层。目前较常用的MDS 常用危险度分层工具包括国际预后积分系统(international prognostic scoring system,IPSS)、修订的国际预后积分系统(IRSS-R)和WHO 分型预后积分系统(WHO adapted prognostic scoring system,WPSS)[4]。然而,现有的MDS 预后分层系统并没有考虑营养状况对患者的预后影响。很多研究发现营养状态与肿瘤患者的临床预后相关[5-6]。在血液系统恶性肿瘤领域,最近的研究表明[7-9],营养状态是影响急性白血病、弥漫性大B 细胞淋巴瘤和多发性骨髓瘤预后的指标。然而,营养状态对MDS 预后的作用报道较少。近年来控制营养状况(controlling nutritional status,CONUT)评分和预后营养指数(prognostic nutritional index,PNI)在肿瘤性疾病中的预测预后作用受到越来越多的人关注,两者是评估机体营养状态的客观、简易指标。本研究通过回顾性分析119 例MDS 患者的临床特征,探讨了CONUT 评分、PNI 在MDS 中的预后价值,以期为临床找到一种简便易得的MDS 预后评估工具,结合现有的预后评估系统,更精准地评估初诊MDS 患者的预后。
1 资料与方法
1.1 研究对象 回顾性收集2010 年3 月至2020年12 月期间在南京医科大学附属淮安第一医院血液科治疗的119 例初诊MDS 患者的临床资料。本研究获得淮安市第一人民医院伦理委员会批准(编号:KY-2022-067-01)。
1.2 研究对象纳入标准 (1)符合2008年或2016年世界卫生组织(WHO)定义的MDS诊断标准;(2)有完整的血液样本资料;(3)有详细的临床资料。排除标准:(1)年龄< 18 岁;(2)临床资料不完整。本研究遵循的程序符合2013 年修订的《世界医学协会赫尔辛基宣言》要求。
1.3 CONUT 评分 根据初诊患者血清白蛋白(ALB)、总胆固醇水平(CHO)和外周血淋巴细胞计数(ALC)的结果进行评分。3个指标分数相加得总分(范围0 ~ 12 分),根据评分结果判断患者的营养状态,评分越高提示营养不良越严重,CONUT评分标准见表1。

表1 CONUT 营养评分标准Tab.1 CONUT Nutrition Score criteria
1.4 PNI 计算方法 根据初诊患血清白蛋白水平和外周血淋巴细胞计数计算得出,即:PNI=ALB(g/L)+5×ALC (109/L)。
1.5 随访 采取病历调查或电话回访的方式进行随访,随访日期截至2022 年12 月31 日。总生存期(overall survival,OS)定义为自疾病确诊到任何原因导致死亡或末次随访日期的持续时间,时间单位为月。
1.6 统计学方法 采用R 语言(R4.1.3)进行数据统计分析,符合正态分布的计量资料用均值±标准差表示,两组间比较采用独立样本t检验;不符合正态分布的计量资料以中位数(四分位数[M(P25,P75)]表示,两组间比较采用Wilcoxon 秩和检验,分类变量的组间比较采用χ2检验。分类变量的组间比较采用χ2检验。计数资料以百分比表示。通过单因素与多因素Cox 比例回归确定CONUT评分及PNI 与OS 的关联,将单因素Cox 回归分析中P< 0.2 的变量纳入多因素Cox 回归分析。以P< 0.05 为差异有统计学意义。
2 结果
2.1 一般临床资料 本研究119 例初诊MDS 患者临床特征见表2,其中男82 例,女37 例;年龄59 ~72 岁,中位年龄65 岁。根据WHO 分型标准进行分型,本研究中MDS伴单系血细胞发育异常(MDSSLD) 3 例,MDS 伴多系血细胞发育异常(MDSMLD) 19例,MDS 伴环状铁粒幼红细胞单系血细胞发育异常(MDS-RS-SLD) 11 例,MDS 伴环状铁粒幼红细胞多系血细胞发育异常(MDS-RS-MLD) 5 例,MDS伴单纯del(5q)(MDS-5q-) 2例,MDS伴原始细胞增多-1(MDS-EB-1) 26 例,MDS 伴原始细胞增多-2(MDS-EB-2) 33 例,MDS-不能分类型(MDS-U)20 例。根据IPSS 预后积分系统将MDS 分为两组:较低危组(IPSS-低危组、中危-1 组)和较高危组(IPSS-中危-2组、高危组)。根据治疗方案分为4组:支持治疗59 例,免疫治疗9 例,去甲基化和(或)化疗48 例,移植治疗3 例。

表2 119 例MDS 患者CONUT 评分和PNI 与临床特征的相关性Tab.2 Correlation of CONUT score and PNI with clinical features in 119 patients with myelodysplastic syndrome M(P25,P75)
2.2 CONUT 评分和PNI 的cut-off 值确定 根据受试者工作特征(ROC)曲线,119 例MDS 患者CONUT 评分、PNI 的ROC 曲线下面积(AUC)分别为0.697、0.372,根据约登指数最大原则,CONUT 评分cut-off 值为4(95%CI:0.576 ~ 0.818),敏感度为67.32%,特异度为16.97%;PNI cut-off 值为36.75(95%CI:0.216 ~ 0.527),敏感度为93.13%,特异度为81.83%(图1)。以CONUT 评分 = 4 为分界值将患者分为低CONUT 组(≤ 4,51 例,42.86%)和高CONUT 组(> 4,68 例,57.14%),PNI = 36.75 为分界值将患者分为低PNI 组(≤ 36.75,16 例,13.45%)和高PNI 组(> 36.75,103 例,86.55%)。

图1 初诊时MDS 患者CONUT 评分、PNI 的ROC 曲线Fig.1 ROC curve of CONUT score and PNI of MDS patients at initial diagnosis
2.3 CONUT 评分和PNI 与MDS 患者临床特征的相关性 高CONUT 组与低CONUT 组患者年龄(P< 0.01)、血清白蛋白(P< 0.01)、淋巴细胞计数(P< 0.01)的差异有统计学意义。而两组间性别、WHO 亚型、骨髓原始细胞计数、白细胞计数、中性粒细胞计数、血红蛋白水平、血小板计数、IPSS 评分、治疗方案分组等特征的分布差异无统计学意义(P> 0.05)。高PNI 组与低PNI 组患者的血清白蛋白(P< 0.001)、淋巴细胞计数(P= 0.024)差异有统计学意义。而两组间性别、年龄、白细胞计数、绝对中性粒细胞计数、血小板计数、WHO 亚型、血红蛋白水平、骨髓原始细胞计数、IPSS 评分、治疗方案分组等特征的分布差异无统计学意义(P> 0.05)。见表2。
2.4 生存期分析 截至随访日期,119 例患者中存活16例(13.4%),死亡103例(86.5%),中位OS时间23.03(7.73 ~ 32.83)个月。低CONUT 评分组与高CONUT 评分组患者相比,高CONUT 评分组患者中位OS 较短,差异有统计学意义(P= 0.003)。为了进一步明确CONUT 评分在MDS 不同危险度分层患者中的预后价值,根据IPSS 积分将MDS患者分为较低危组和较高危组。结果显示较低危组的患者中,高CONUT 评分组中位OS 较短,差异有统计学意义(P= 0.049)。较高危组的患者中,高CONUT 评分组中位OS 亦较短,差异有统计学意义(P= 0.008)。以上结果显示CONUT 评分对MDS 患者预后的作用不受IPSS 危险度分层的影响。低PNI 组与高PNI 组患者相比,两组患者中位OS 无明显差异,差异无统计学意义(P= 0.128)。见图2。
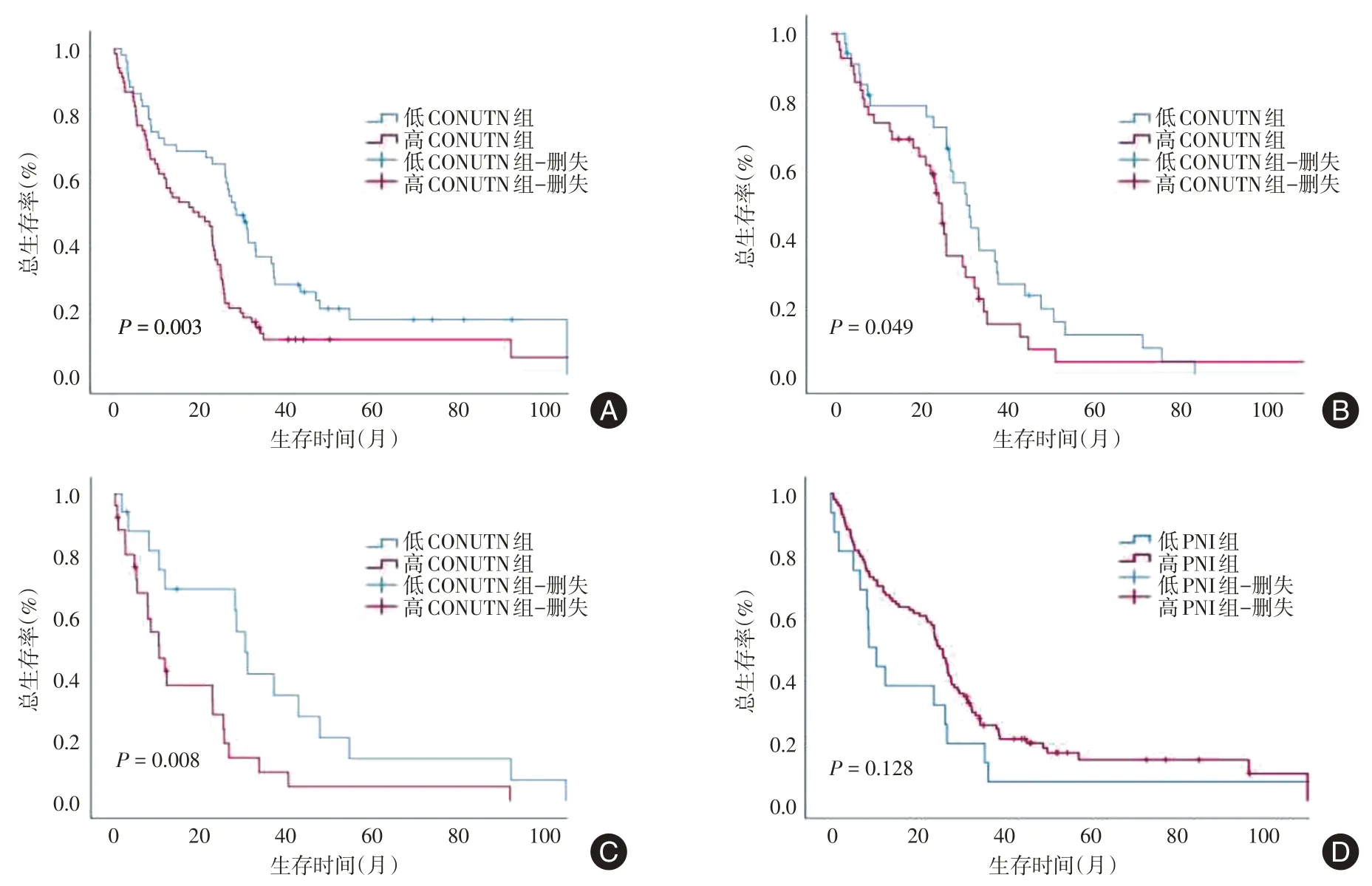
图2 生存期分析Fig.2 Survival analysis
2.5 预后影响因素分析 单因素分析显示血小板计数(P= 0.012)、骨髓原始细胞计数(P< 0.001)、IPSS 评分(P= 0.012)、CONUT 评分(P= 0.003)是MDS 患者OS 的影响因素。将单因素分析中P<0.2 的变量(年龄、血红蛋白水平、血小板计数、血清白蛋白、骨髓原始细胞计数、IPSS 评分、PNI、CONUT 评分)纳入多因素分析,结果显示,骨髓原始细胞计数(P= 0.028)、CONUT 评分(P= 0.028)是MDS 患者OS 的独立危险因素。见表3。

表3 影响骨髓增生异常综合征患者总生存时间的单因素及多因素分析Tab.3 Univariate and multivariate analysis of influencing the overall survival time of patients with myelodysplastic syndrome
3 讨论
MDS 是一种血液系统髓系恶性肿瘤,尚无特效的治疗方法,异基因造血干细胞移植是目前唯一能根治MDS 的方法,但异基因移植风险极大。为了能延缓MDS 患者疾病进展,延长生存期,应根据患者个体差异制定个体化治疗方案。近期研究发现CONUT 评分、PNI 可用于预测某些肿瘤患者的生存期。根据Meta 分析结果[10],常用的评估营养不良的生化指标有总蛋白、ALB、前白蛋白、血红蛋白和总胆固醇等。常用的营养评估工具有:微型营养评定法、营养不良通用筛查工具等[11]。营养状况会影响机体的免疫系统,研究报道[12]血细胞计数与免疫系统异常密切相关,从而可影响肿瘤性疾病患者的预后。中性粒细胞可分泌多种炎症因子,作用于肿瘤微环境,从而促进肿瘤细胞的增殖、浸润和转移。淋巴细胞作为免疫系统的重要组成部分,淋巴细胞比例下降,容易引起肿瘤细胞的增殖、侵袭及转移[13]。血小板的增多可抑制宿主的免疫功能,促进肿瘤的进展和转移[14]。
既往研究显示初诊时CONUT 评分与恶性血液病患者的预后相关。如OKAMOTO等[15]发现MM移植患者中,高CONUT 评分组较低评分组OS 较短,而高CONUT 评分(> 4)是MM 患者的独立预后因素。URESHINO 等[16]发现年轻的成人型T 细胞性白血病患者中,低CONUT 评分(≤ 3)的患者有较长的OS 相关。PNI 最早由BUZBY 等[17]提出,用于评估胃肠道手术患者术前的营养和免疫炎症状况,近期已运用到肿瘤领域,如肺癌、胰腺癌、骨髓瘤、淋巴瘤等[18-21]。然而,PNI 是否可以预测MDS患者的预后尚不清楚。
本研究回顾性分析119 例MDS 患者的临床特征,首先利用ROC 曲线计算出初诊MDS 患者的CONUT 评分、PNI 最佳cut-off 值,然后分析CONUT评分、PNI 和MDS 患者临床特征的关系。结果显示不同CONUT 评分组患者的年龄、血清白蛋白、淋巴细胞计数的差异有统计学意义。不同PNI 组患者的性别、白细胞计数、绝对中性粒细胞计数、血小板计数的差异有统计学意义。通过CONUT评分和PNI 与MDS 患者生存率的分析,发现高CONUT 评分与 MDS 患者的不良预后密切相关。多因素分析显示骨髓原始细胞计数、CONUT 评分是MDS 患者OS 的独立影响因素。既往研究[15-16]表明,初诊患者CONUT 评分与恶性血液病患者的预后相关,CONUT 评分可以作为血液系统恶性肿瘤患者的预后工具。在本研究中,我们发现高CONUT 评分组MDS 患者的OS 比低CONUT 评分组患者的OS 短,与相关研究报道[22]一致。由此推断,CONUT 评分可能成为判断MDS 患者预后的独立影响因素。SAITO 等[23]报道PNI 较低反映患者营养欠佳甚至失调,与高PNI 组相比,低PNI 组患者的OS 较短。而本研究中高PNI 组与低PNI 组的MDS 患者预后无显著差异,与相关研究报道不一致,可能是由于样本量小和研究中的偏差有关。
综上所述,CONUT 评分和PNI 两者均是评估机体营养状态的客观、简易指标。早期营养状况筛查和评估对于为肿瘤患者指导制定个体化综合治疗方案具有重要意义。CONUT 评分和PNI 在MDS 中研究较少,本研究发现CONUT 评分是MDS患者OS 的独立影响因素,而PNI 不是MDS 预后的独立因素。CONUT 评分可能成为评估MDS 患者预后的重要指标,有益于制定更全面的治疗方案。本研究存在一定的局限性,样本收集的选择偏倚不能完全避免,样本量较少,还需进一步行大样本的前瞻性研究。
【Author contributions】ZHANG Quan'e performed the experiments and wrote the article.CHEN Qiuni,CHEN Yue,ZHANG Xin and MA Jingjing collected data,analyzed and followed up investigation.CHEN Kankan and ZHANG Lijuan conducted supervision and verification.WANG Chunling and HE Zhengmei designed the study and reviewed the article.All authors read and approved the final manuscript as submitted.

