肺动脉平滑肌细胞外泌体上调miR-106b-5p增强肺动脉内皮细胞Warburg效应促进动脉型肺动脉高压的分子机制
艾丽菲热·买买提 高静 于子翔 马依彤
1新疆医科大学第一附属医院冠心病一科(乌鲁木齐 830054);2新疆医科大学第五附属医院内分泌科(乌鲁木齐 830000)
肺动脉高压(pulmonary hypertension,PH)的定义为个体在静息状态下平均肺动脉压为25 mmHg或以上。临床上,PH分为五大类,其中第一大类为动脉型肺动脉高压(pulmonary arterial hypertension,PAH),指的是因肺血管疾病所致的PH,是一种预后较差的慢性疾病[1]。PAH 是一种以心肺为单元的疾病,其特征是肺动脉高压下阻塞性肺血管重塑增加右心室后负荷,导致右心室肥厚和衰竭[2-3]。全球范围内成人PAH 的发病率为2.0 ~ 7.6 例/100 万人年,患病率为11 ~ 26 例/100 万人年[4]。我国PAH 患者普遍面临着诊断延误、治疗不规范,医疗经济负担和心理负担重的问题[5]。迫切需要开发新的有效筛选和治疗PAH 的医疗策略。
目前临床上治疗PAH 的药物主要是利尿剂和肺血管扩张剂,以及使用靶向药物。虽然可以改善患者的肺功能和血流动力学,但它们仅可改善症状,却无法治愈疾病和降低死亡率。PAH 的5 年死亡率仍约为50%[6]。肺动脉高压的病变过程涉及肺动脉内皮细胞(pulmonary artery endothelial cells,PAECs)、肺动脉平滑肌细胞(pulmonary arterial smooth muscle cells,PASMCs)等发生癌样增殖、抗凋亡、类癌表型(包括上皮-间质转化和纤维化等)转化等[7]。其中相关细胞所发生的代谢重编程类似于在肿瘤细胞中被广泛研究的Warburg效应[8]。然而是什么导致了这些细胞在缺氧和炎症状态下,能量代谢途径发生转换,尚未知晓。这是阻遏PAH 血管相关细胞癌样病变的关键和靶向药物开发的重点。在癌症相关领域的研究表明microRNAs(miRNAs)是调控癌细胞Warburg 效应的重要参与者之一[9]。且在PAH 的肺血管重塑过程中,肺血管细胞间可通过外泌体(exosomes)相互沟通,加速疾病进展[10]。因此在该研究中,拟对健康对照组和PAH 患者外周血浆中的外泌体进行分离纯化,并对其内的miRNAs 进行微阵列测定和差异表达分析,以期发现PAH 相关的核心miRNAs分子,并探讨在PASMCs 与PAECs 的胞间通讯的外泌体中此miRNAs 分子的关键作用。
1 材料与方法
1.1 实验材料 原代人肺动脉平滑肌细胞(hPASMCs)和原代人肺动脉内皮细胞(hPAECs)购自上海名劲生物(中国)。总外泌体分离试剂盒(4484450),外泌体-人CD63 分离试剂盒(内含超顺磁性 Dynabeads)(10606D),mirVana™ miRNA 分离试剂盒(不含苯酚)(AM1561),GeneChip miRNA 4.0 Array(902446),兔抗人CD63单抗(PA5-96217),兔抗人β-tubulin 多抗(PA1-16947),兔抗人USP32多抗(PA5-60690),兔抗人PKM2多抗(PA5-28700),兔抗人GLUT1 多抗(PA1-46152),兔抗人HK2 多抗(PA5-29326),兔抗人LDHA 多抗(PA5-27406),兔抗人GAPDH 多抗(PA1-988),miR-106b-5p mimic和其对照组miR-NC(4464066),miR-106b-5p inhibitor 和其对照组Inhibitor-NC(AM10067)购自Thermo Fisher(美国)。PKM2 ORF 上、下游引物,shRNA-NT,PKM2 shRNA 委托上海生工生物科技有限公司(中国)代为合成。
1.2 方法
1.2.1 PAH 患者血浆样本的采集 招募2022 年3 - 5 月期间被我院诊断为PAH 并住院治疗的患者(n= 10,男4 例,女6 例)参加本项目的研究。同时招募未接受任何药物治疗的健康个体(n= 9,男5 例,女4 例)作为健康对照(healthy controls,HC)纳入本次研究,并与PAH 患者在同一时间采集外周静脉血样本。本次研究得到了我院伦理委员会的批准(审批号:20220113-08),并根据《赫尔辛基宣言》的伦理原则进行。采用(3.8%)柠檬酸抗凝管采集PAH 患者和HC 个体外周静脉血5 mL。分离上层血浆,约2 mL/样本,冻存于-80 ℃冰箱备用。
1.2.2 外泌体囊泡的分离与鉴定 取1 mL 血浆样本,使用总外泌体分离试剂盒分离血浆中的总外泌体。具体分离方法参见试剂盒说明书进行即可。分离获得外泌体颗粒悬液后,使用外泌体-人CD63 分离试剂盒(内含超顺磁性 Dynabeads)进一步富集CD63+外泌体。
1.2.3 外泌体miRNAs 的纯化 取100 µL CD63+外泌体样品,使用mirVana™ miRNA 分离试剂盒(不含苯酚)分离其中的miRNAs,具体操作按照试剂盒的说明书进行。
1.2.4 外泌体miRNAs 的微阵列测定和差异表达分析(MicroArray analysis) 外泌体miRNAs 的微阵列测定和差异表达分析,委托北京诺禾致源科技有限公司(中国)代为进行。微阵列芯片使用GeneChip miRNA 4.0 Array(902446)。使用R语言中的46ip miRNA 4.软件包,采用实验性贝叶斯法调节后的t-检验(an empirical Bayes moderatedt-test)进行分析,使用“进行分atmap (v1.0.12)”软件包生成热图。
1.2.5 生物信息学分析miR-106b-5p 与USP32 的序列互作 通过TargetScanHuman (v7.2) (网页版)(https://www.targetscan.org/vert_72/)进行miR-106b-5p 与USP32 的序列互作分析。
1.2.6 细胞培养 hPASMCs 和hPAECs 细胞培养于含10%胎牛血清的RPMI-1640 完全培养液中。细胞置于37 ℃恒温湿润的CO2孵育箱中维持培养。腺病毒转染hPASMCs 48 h 后,收集并测定细胞上清液外泌体中miR-106b-5p 的表达水平,确认转染成功后,建立hPASMCs 和hPAECs 的共培养体系。hPASMCs 培养于24-孔板下层细胞培养皿中,hPAECs 培养于上层细胞小室,细胞培养液连通两种细胞培养物。共培养细胞置于37 ℃恒温湿润的CO2孵育箱中,再培养48 h 后测定下游指标。
1.2.7 体外细胞缺氧诱导 hPASMCs 和hPAECs细胞在常氧条件下(21% O2,5% CO2,74% N2)或缺氧(4% O2,5% CO2,91% N2)条件下维持培养4 d,结束后收集细胞上清液,分离和纯化其中外泌体并进行下游指标测定[11]。
1.2.8 双荧光素酶报告基因分析 使用双荧光素酶报告基因检测试剂盒进行测定。将USP32 3′-UTR-WT(USP32 WT)或USP32 3′-UTR-MUT(USP32 MUT)克隆并连接入试剂盒自带的pGMCMV Luciferase Reporter Plasmid 报告载体中。将1 × 105HEK 293T 细胞接种在24-孔板中,过夜培养待细胞贴壁。然后按照实验要求,使用Lipofectamine 3000 进行共转染。转染48 h 后,按照试剂盒说明书的操作方法,上机酶标仪检测荧火虫荧光素酶活力和海肾荧光素酶活力。
1.2.9 qPCR 使用TRIzol 裂解液裂解细胞培养物。使用EasyPure RNA Kit 提取细胞总RNA,使用EasyPure miRNA Kit 提取细胞总miRNA。使用EasyScript One-Step gDNA Removal and cDNA Synthesis SuperMix 反转录合成cDNA。使用TransStart Green qPCR SuperMix 进行qPCR 反应。
1.2.10 Western blot 使用RIPA 裂解液裂解细胞培养物,收集总蛋白。BCA 法测定蛋白浓度,SDS-聚丙烯酰胺凝胶电泳分离目标蛋白,湿转法转印目的蛋白至PVDF 膜上,5%脱脂奶粉室温封闭2 h,一抗于4℃过夜孵育,次日孵育二抗1 h,随后ECL 显影呈像。
1.2.11 转染 采用腺病毒转染的方式敲低/过表达hPASMCs 的miR-106b-5p,或敲低/过表达hPAECs的PKM2。腺病毒过表达载体为pADV-mCMV-MCS-3xFLAG。腺病毒shRNA 沉默载体为pADV-U6-shRNA-CMV-EGFP。PKM2 ORF上游引物:5′-GGATCCAGGGCGTCTGGGATG-3′,PKM2 ORF 下游引物:5′-UGACAUACAGGUAGGCUCUA-3′。shRNANT:5′-CTGTCTCACGATAGATGGATA-3′,PKM2 sh-RNA:5′-GCTGACACATTCCTGGAGCAC-3′。委托上海和元生物进行腺病毒颗粒包装。腺病毒转染hPASMCs 或hPAECs 时的滴度为1010PFU/mL。转染24 h 后进行下游指标的测定。
1.3 统计学方法 计量数据均以均数±标准差的方式表示。使用GraphPad Prism v8 软件对数据结果进行统计学分析。组间比较,两组间采用t检验,多组间采用单因素方差分析。当P< 0.05 时认为差异有统计学意义。
2 结果
2.1 PAH 患者血浆外泌体中miR-106b-5p 水平上调 对来自HC 和PAH 个体外周血浆分离的外泌体表面标志物CD63 的表达情况的鉴定结果,显示两种来源外泌体均为CD63+(图1)。微阵列法测定上述两种来源外泌体中前5 位显著上调/下调的miRNAs,其中miR-106b-5p 为显著上调的第3 位(表1)。qPCR 法测定常氧组和缺氧组hPASMCs或hPAECs 来源外泌体中miR-106b-5p 的相对表达水平,与常氧组相比,缺氧组hPASMCs 来源的外泌体中miR-106b-5p 的相对表达水平显著上调;而hPAECs 来源的外泌体中,常氧组和缺氧组miR-106b-5p 的相对表达水平无明显差异(表2)。
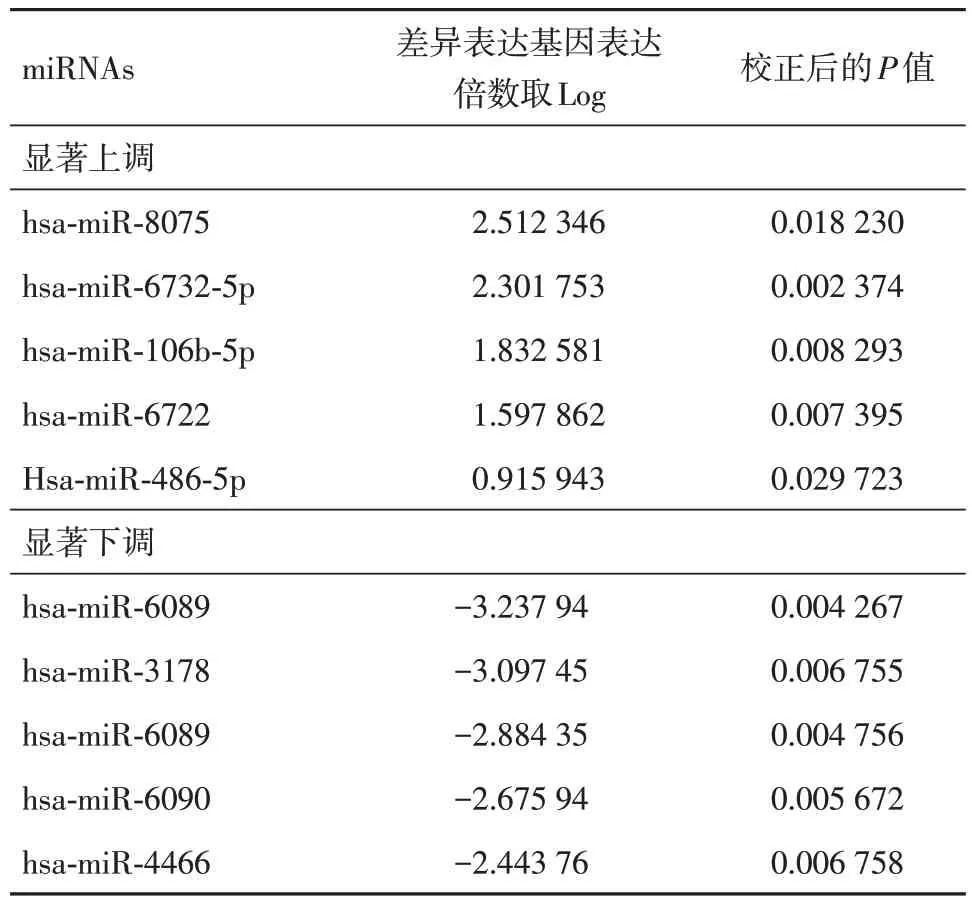
表1 PAH 患者(n = 10)血浆中前5 位显著上调/下调的miRNAs,对照组为HC(n = 9)Tab.1 The top 5 significantly up-regulated/down-regulatedmiRNAs in the plasma of PAH patients (n = 10) and HC in the control group (n = 9)
表2 细胞上清液外泌体中miR-106b-5p 的表达水平Tab.2 Expression level of miR-106b-5p in cell culture supernatant exosomes ±s

表2 细胞上清液外泌体中miR-106b-5p 的表达水平Tab.2 Expression level of miR-106b-5p in cell culture supernatant exosomes ±s
组别常氧组缺氧组t值P值hPASMCs 1.0ECssi 7.62Cssio 34.01 0.001 hPAECs 1.0ECssi 1.07Cssio 2.38 0.072

图1 对HC 和PAH 个体外周血浆分离的外泌体标志物的测定Fig.1 Identification of exosome marker for peripheral blood plasma separation in HC and PAH individuals
2.2 miR-106b-5p通过负调控USP32上调PKM2 通过TargetScan (v7.2)(网页版)对miR-106b-5p 与USP32 的序列互作位点分析(图2)。双荧光素酶报告基因分析结果显示,与USP32 WT 共转染的miR-NC 组相比,与USP32 WT 共转染的miR-106b-5p mimic 组荧光素酶报告基因相对表达水平明显降低;而在与USP32 MUT 共转染的miR-NC 组和miR-106b-5p mimic 组之间,荧光素酶报告基因相对表达水平无明显差别(表3)。对hPASMCs 进行miR-106b-5p 过表达处理,然后测定与其共培养的上层hPAECs 胞内USP32 和PKM2 蛋白质的表达情况,发现与miR-NC 组相比,miR-106b-5p mimic 组USP32 的相对表达水平明显降低;miR-NC 组和miR-106b-5p mimic 组胞内PKM2 的相对表达水平明显上调(表4)。
表3 荧光素酶报告基因相对表达水平Tab.3 Relative expression levels of the luciferase reporter gene ±s
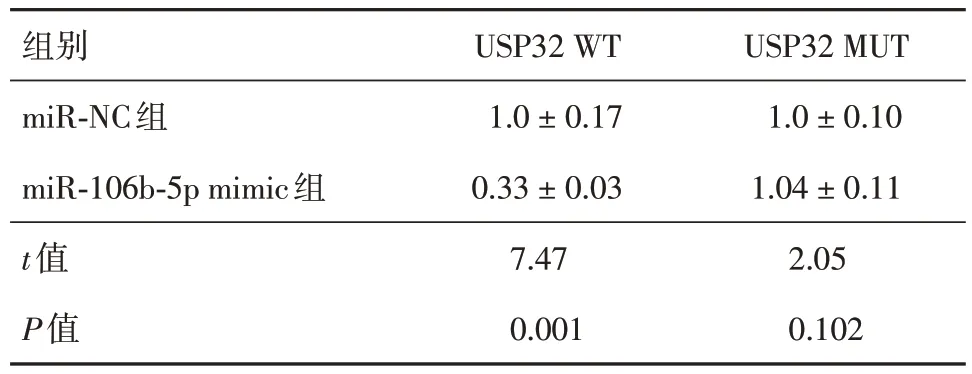
表3 荧光素酶报告基因相对表达水平Tab.3 Relative expression levels of the luciferase reporter gene ±s
组别miR-NC组miR-106b-5p mimic组t值P值USP32 WT 1.0 ± 0.17 0.33 ± 0.03 7.47 0.001 USP32 MUT 1.0 ± 0.10 1.04 ± 0.11 2.05 0.102
表4 qPCR 测定USP32 和PKM2 mRNA 的表达Tab.4 Expression of USP32 and PKM2 mRNA as determined by qPCR ±s
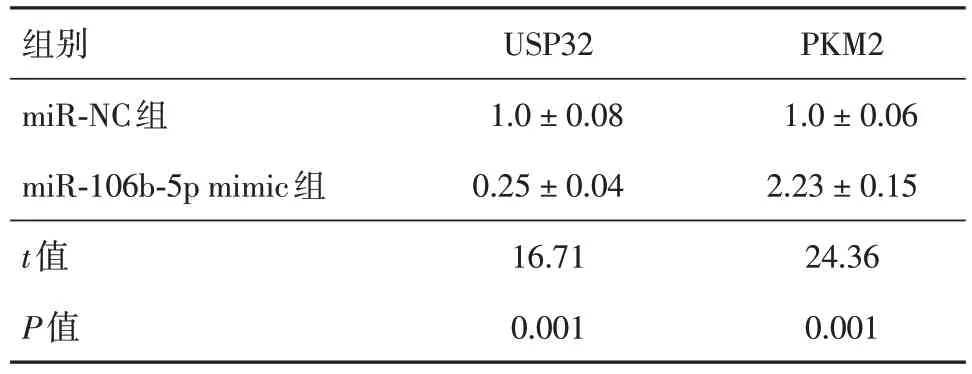
表4 qPCR 测定USP32 和PKM2 mRNA 的表达Tab.4 Expression of USP32 and PKM2 mRNA as determined by qPCR ±s
组别miR-NC组miR-106b-5p mimic组t值P值USP32 1.0 ± 0.08 0.25 ± 0.04 16.71 0.001 PKM2 1.0 ± 0.06 2.23 ± 0.15 24.36 0.001

图2 miR-106b-5p 与USP32 的序列互作分析Fig.2 Sequence interaction analysis of miR-106b-5p and USP32
2.3 hPASMCs 中过表达/敲低miR-106b-5p 改变hPAECs 的Warburg 效应 对hPASMCs 进行过表达/敲低miR-106b-5p 处理后,与hPAECs 共培养,随后通过Western blot 法测定上述hPAECs 胞内Warburg-相关蛋白因子的表达情况,发现与miRNC 组相比,miR-106b-5p mimic 组hPAECs 胞内PKM2、GLUT1、HK2 和LDHA 的相对表达水平均明显升高;而与Inhibitor-NC 组相比,miR-106b-5p inhibitor 组hPAECs 胞内PKM2、GLUT1、HK2 和LDHA 的相对表达水平均明显降低(表5)。
表5 hPAECs 胞内Warburg-相关蛋白因子PKM2、GLUT1、HK2、LDHA 的表达水平Tab.5 Expression levels of Warburg-related protein factors PKM2,GLUT1,HK2,and LDHA in hPAECs±s
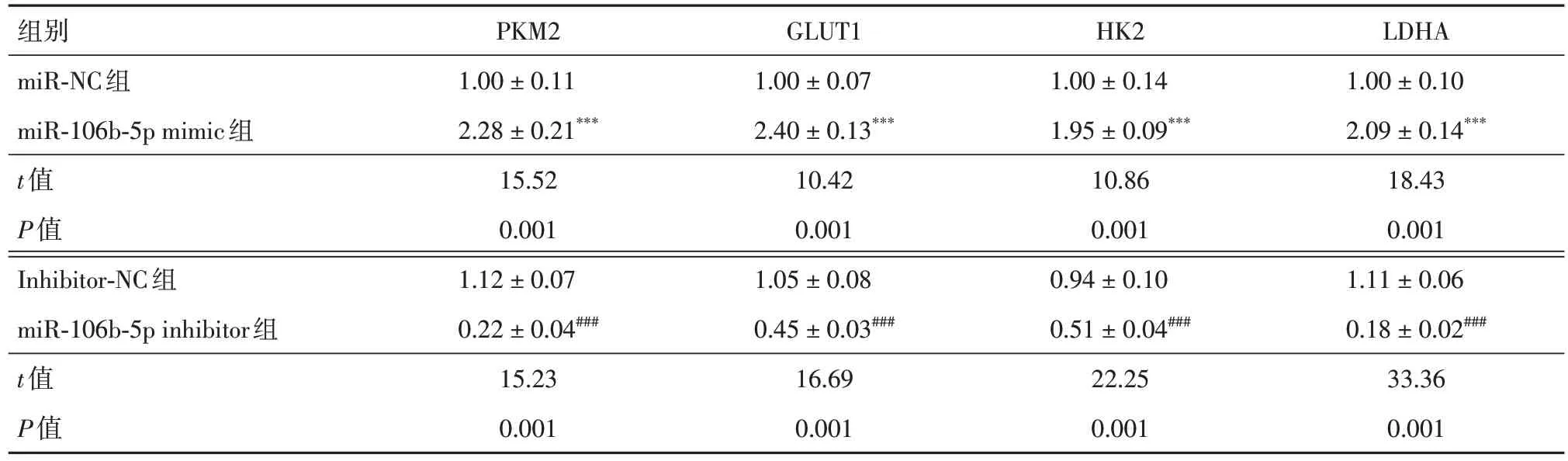
表5 hPAECs 胞内Warburg-相关蛋白因子PKM2、GLUT1、HK2、LDHA 的表达水平Tab.5 Expression levels of Warburg-related protein factors PKM2,GLUT1,HK2,and LDHA in hPAECs±s
注:与miR-NC组比较,***P < 0.001;与Inhibitor-NC组比较,###P < 0.001
组别miR-NC组miR-106b-5p mimic组t值P值Inhibitor-NC组miR-106b-5p inhibitor组t值P值LDHA 1.00 ± 0.10 2.09 ± 0.14***18.43 0.001 1.11 ± 0.06 0.18 ± 0.02###33.36 0.001 PKM2 1.00 ± 0.11 2.28 ± 0.21***15.52 0.001 1.12 ± 0.07 0.22 ± 0.04###15.23 0.001 GLUT1 1.00 ± 0.07 2.40 ± 0.13***10.42 0.001 1.05 ± 0.08 0.45 ± 0.03###16.69 0.001 HK2 1.00 ± 0.14 1.95 ± 0.09***10.86 0.001 0.94 ± 0.10 0.51 ± 0.04###22.25 0.001
2.4 敲低/过表达PKM2 改变hPAECs 的Warburg 效应 Western blot 法测定Warburg 效应相关蛋白质因子的相对表达水平,在hPAECs 内敲低/过表达PKM2 后,与shRNA-NT 组相比,PKM2 shRNA 组胞内PKM2、GLUT1、HK2 和LDHA 的相对表达水平明显降低;与vector 组相比,PKM2-OE组胞内PKM2、GLUT1、HK2 和LDHA 的相对表达水平明显增强(表6)。
表6 Western blot 法测定上述胞内Warburg-相关蛋白因子PKM2、GLUT1、HK2、LDHA 的表达水平Tab.6 Expression levels of Warburg-related protein factors PKM2,GLUT1,HK2,and LDHA as determined by Western blot analysis±s
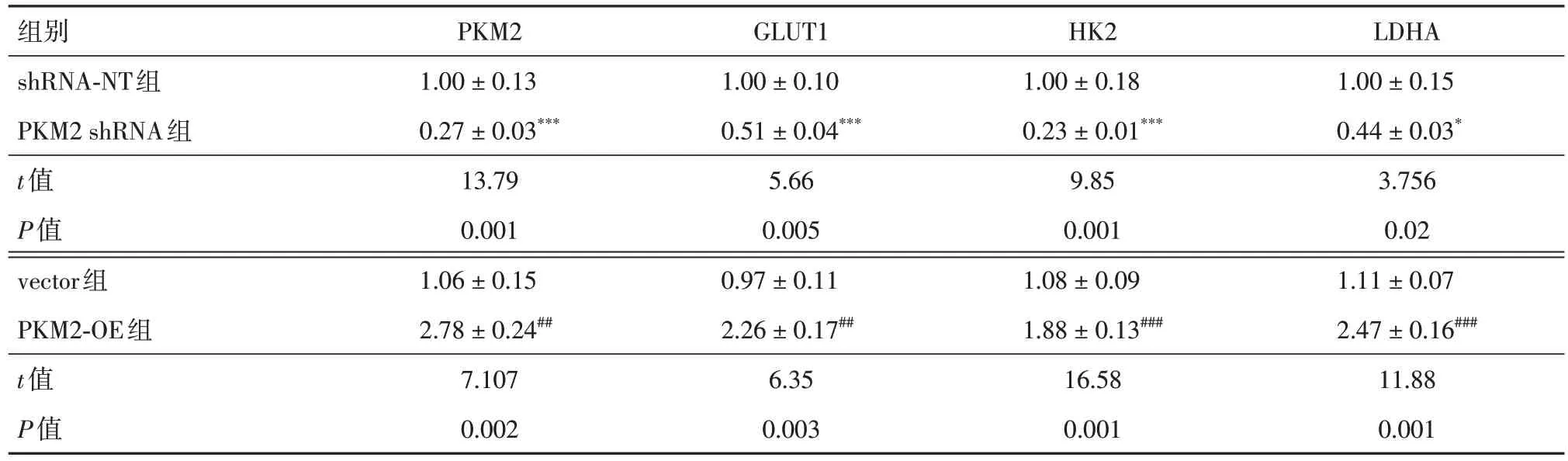
表6 Western blot 法测定上述胞内Warburg-相关蛋白因子PKM2、GLUT1、HK2、LDHA 的表达水平Tab.6 Expression levels of Warburg-related protein factors PKM2,GLUT1,HK2,and LDHA as determined by Western blot analysis±s
注:与shRNA-NT组比较,*P < 0.05,与shRNA-NT组比较,***P < 0.001;与vector组比较,##P < 0.01,与vector组比较,###P < 0.001
组别shRNA-NT组PKM2 shRNA组t值P值vector组PKM2-OE组t值P值LDHA 1.00 ± 0.15 0.44 ± 0.03*3.756 0.02 1.11 ± 0.07 2.47 ± 0.16###11.88 0.001 PKM2 1.00 ± 0.13 0.27 ± 0.03***13.79 0.001 1.06 ± 0.15 2.78 ± 0.24##7.107 0.002 GLUT1 1.00 ± 0.10 0.51 ± 0.04***5.66 0.005 0.97 ± 0.11 2.26 ± 0.17##6.35 0.003 HK2 1.00 ± 0.18 0.23 ± 0.01***9.85 0.001 1.08 ± 0.09 1.88 ± 0.13###16.58 0.001
3 讨论
PAH 血管重塑过程中,hPAECs 和hPASMCs 均表现出不同形式的类癌表型转化,包括高增殖和抗凋亡以及上皮-间质转化和纤维化等[12]。且二者在其各自的类癌表型转化过程中会通过外泌体进行胞间通讯和协同促进彼此的恶性进展[13]。为了发现在这种胞间通讯中起着核心调控作用的关键分子,本研究对HC 组和PAH 组外周血浆中的外泌体内含有的miRNAs 进行了微阵列测定和差异表达分析。在显著上调的miRNAs 列表里miR-106b-5p 位居第3 位。由于miR-106b-5p 与多种癌症的恶性表型和较差的预后密切相关[14-15]。且本研究对hPAECs 和hPASMCs 给予缺氧诱导处理后,miR-106b-5p 在hPASMCs 的外泌体中上调,而在hPAECs 的外泌体中无变化。随后对miR-106b-5p 的下游mRNAs 表达调控靶点进行了生物信息学分析,发现miR-106b-5p 能够与USP32(ubiquitin specific peptidase 32,泛素特异性肽酶32)的3′-UTR 区结合并充当“海绵体”并与PKM2(Pyruvate Kinase M2,丙酮酸激酶M2)表达上调呈正相关。进一步的结果显示,在hPASMCs 中过表达/敲低miR-106b-5p,将通过抑制/上调PKM2 的表达,改变hPAECs 的Warburg 效应。
泛素-蛋白酶体系统(ubiquitin-proteasome system,UPS)负责蛋白酶体降解,调节蛋白质的半衰期。先前针对其生物学功能的研究主要集中于其在促进乳腺癌和胃癌恶性进展和化疗药物耐药方面的关键作用[16]。在该研究中发现,hPASMCs通过外泌miR-106b-5p 负调节hPAECs 胞内USP32 促进PKM2的稳定,并增强hPAECs的Warburg效应。
丙酮酸激酶是Warburg 效应的限速酶,在肿瘤细胞中,这一过程由PKM2的表达上调介导调控[11]。PKM2 的二聚体可转运至细胞核,与HIF-1α(hypoxia inducible factor 1 subunit alpha,缺氧诱导因子-1α 亚基)相互作用,调节许多Warburg 效应相关酶的表达[11,17]。早期炎症刺激可激活血管内皮细胞代谢方向转向Warburg效应,并发出“伪缺氧”信号,稳定HIF-1α[18-19]。然后,大量稳定的HIF-1α进入核内进一步正向调节其他HIF-依赖性Warburg效应相关酶基因的表达。在该研究结果中也显示,敲低/过表达PKM2能够改变hPAECs的Warburg效应。
因此,在该研究结果中miR-106b-5p在hPASMCs与hPAECs 的胞间通讯中通过充当USP32 的“海绵体”,调控hPAECs 的代谢重编程。这是一项重要的发现。筛选获得的标志物miR-106b-5p,可通过后续更大规模PAH 患者血样分析加以验证。该研究为以miR-106b-5p 为靶标,开发PAH 治疗性分子靶向药物,奠定了一定的前期研究基础,积累了临床前研究资料。
尽管在该研究中,未对miR-106b-5p 作为PAH标志物的临床价值开展更大规模的验证研究,这是本次研究的局限。但目前基于该研究结果可知,hPASMCs 通过外泌体上调miR-106b-5p 增强hPAECs 胞内Warburg 效应和细胞增殖,在动脉型肺动脉高压中具有潜在的促进疾病进展的作用。
【Authors contributions】MAIMAITI Ailifeire conducted all the experiments,processed statistical analysis of data and wrote the manuscript.GAO Jing participated in the experiments partially and reviewed the data independently.YU Zixiang reviewed the data and the manuscript independently.MA Yitong designed the research program,reviewed all of the data and the manuscript.All authors read and approved the final manuscript as submitted.

