烯壳铁氮磁珠介导Survivin ASO对肿瘤细胞的转染和抑制作用
张晓旭 , 肖向茜,2 , 潘逸群 , 顾烨翔 , 董礼 , 党浩然 , 康茜 , 王明连,2
1.北京工业大学环境与生命学部,北京 100124;2.抗病毒药物北京市国际科技合作基地,北京 100124
恶性肿瘤增殖迅速且易于产生耐药性,因此治疗困难[1]。近年来,寡核苷酸疗法因其高效性、安全性、药物制备相对容易等优势,在肿瘤治疗方面显示出优越的前景[2]。其中,反义寡核苷酸(antisense oligonucleotide,ASO)是一类由人工设计合成以反义方式调控目的基因表达的寡核苷酸片段,通常由15~25个核苷酸组成,通过与mRNA形成杂合体后被RNase H降解,这种降解作用依赖ASO与目的基因的严格匹配,所以较其他小核酸药物具有不易脱靶的优越性,如此使目的基因沉默,阻止其翻译合成蛋白质。目前,一些ASO药物已获得美国食品和药物管理局(United States Food and Drug Adminis-tration,FDA)认证,如Fomivirsen、Eteplirsen、Golodirsen、Viltolarsen和Casimersen等[3]。ASO技术由于其序列配对的高度选择性、设计过程简易及体外可大量合成等优点[4],在肿瘤治疗领域展现出巨大的应用潜力。
Survivin是凋亡抑制蛋白(inhibitor of apoptosis proteins,IAP)家族成员,作为一种细胞凋亡抑制基因,它在胚胎和肿瘤组织中均表达,而在正常分化的组织中几乎不表达[5]。过表达的Survivin能够调节细胞周期,其抗凋亡作用在于能够促进有丝分裂,加快细胞增殖,并且抑制Caspase-3、Caspase-7表达和细胞凋亡[6-7]。Survivin在肺癌、结肠癌、胰腺癌、前列腺癌和乳腺癌等多种肿瘤组织中高表达,被认为是肿瘤治疗的靶分子[8-9]。针对Survivin mRNA序列和二级结构设计合成ASO,抑制Survivin表达,有望实现抗肿瘤的作用。
寡核苷酸需要进入细胞内发挥作用,而核酸的负电性使其难以跨膜;无处不在的核酶使得寡核苷酸易被降解,因此,寡核苷酸药物的递送方式就显得十分重要[10]。核酸药物的递送方式大体分为病毒载体和非病毒载体[11-13]。病毒载体包括腺病毒(adenovirus, AdV)、慢病毒(lentivirus, LV)、逆转录病毒(retrovirus, RV)等,病毒载体生产技术繁琐、价格高,且安全性一直被质疑。非病毒载体包括阳离子脂质体、无机纳米粒子和聚合物等[14],因成本低、制作方便而发展迅速,但有些因成分而异会产生一定细胞毒性和/或转染效率较低的问题。
烯壳铁氮磁珠(graphene-shelled ferro-nitride magnetic beads,GFeNMB)作为一种新型纳米材料,具有核壳结构,可通过低温等离子体法大量制备[15],制造成本低,原料和产物均无害。不同于目前大多以Fe、Fe2O3、Fe3O4[16]为主要成分的纳米磁珠,GFeNMB外壳是多层石墨烯,内部以Fe和Fe4N为磁芯,拥有着更强的磁响应性,在有着纳米载体优点的同时还具有优越的靶向特性。GFeNMB兼有石墨烯的生物相容性、特殊的吸附性能和磁响应性,对其表面进行基团修饰后可用于细胞分选和病毒富集等领域[17]。GFeNMB外层包覆的石墨烯具有较高的稳定性和生物相容性,因其结构特征会与裸露的碱基发生强烈的相互作用,其中π-π堆积作用和氢键都有助于单链核酸和石墨烯之间产生亲和力,从而对单链核酸有着较强的吸附能力[18-20]。吸附核酸的石墨烯能起到保护核酸的作用,使核酸免受酶的消化[21]。由于荧光共振能量的转移,石墨烯可以抑制附着的荧光,猝灭吸附的荧光团[22-23]。双链核酸较单链核酸而言,空间结构发生改变时,碱基被包裹在磷酸盐骨架内,石墨烯无法与其接触,从而对双链核酸的吸附能力减弱。因此,石墨烯吸附单链核酸后,一旦单链核酸与同一环境中的互补链发生杂交形成双链结构,就会从石墨烯表面解吸附[24-25]。因此,可以用荧光团修饰单链核酸,通过荧光团的荧光强度来监测石墨烯对单链核酸的吸附与解吸附情况。综上,GFeNMB对单链核酸的吸附性和磁靶向性,使其作为ASO载药工具递送到细胞具有天然独到的优势。
GFeNMB外壳成分石墨烯的安全性已被许多研究证实,石墨烯对细胞几乎无毒性,不影响细胞生长,以该磁珠材料分选的细胞可以附着于磁珠,且增殖旺盛[26-27],一些研究已将石墨烯用于药物递送的体内实验[28]。GFeNMB内核的氮和铁元素均是体内细胞的固有元素,性质相近的铁氧纳米悬液在体内药物使用中已有应用[29-30]。因此GFeNMB作为基础材料具有安全性和细胞相容性等优势。
本研究设计合成了靶向Survivin的ASO,GFeNMB吸附ASO形成载药体,将其磁性转染至肿瘤细胞中,通过检测转染情况和对肿瘤细胞增殖的抑制作用,对GFeNMB作为单链寡核苷酸药物运载工具的可行性进行了初步探讨。
1 材料与方法
1.1 磁珠均质溶液配制
GFeNMB通过低温等离子体法[15]制备,呈黑色粉末状,不易溶于水,需要经过超声仪处理后形成均质溶液。称取GFeNMB粉末20 mg,溶于40 mL去离子水,高压灭菌处理2 h,超声处理1 h,形成均匀的磁珠悬浮液(0.5 mg·mL-1)。
1.2 Survivin ASO
NCBI网址搜索人类细胞凋亡抑制基因Survivin的mRNA序列(GenBank登录号U75285.1),通过RNA Draw程序[31]预测了1619 bp Survivin mRNA在37 ℃的二级结构,在没有碱基互补配对的区域,RNA序列呈现单链构象,相对来说是反义寡核苷酸易于靠近的杂交区段。有效反义靶点的二级结构多为不稳定部位,如发夹、内部环、膨胀环、多分支环等。Survivin mRNA的大单链环序列以及由短双链间隔连接起来的小单链环序列都可能是反义寡核苷酸的有效杂交区段。基于识别位点,设计了一系列针对Survivin mRNA不同区域的20-mer反义寡核苷酸序列。寡核苷酸由上海生工公司合成及修饰,两端经硫代修饰以防止核酸酶降解。其中,用于显微镜观察的示踪ASO,在5'端以FAM修饰。使用可搜索数据库(Advanced BLASTN)检查序列与其他人类基因的同源性。
1.3 磁珠对Survivin ASO的吸附量检测
以FAM荧光团标记的ASO来研究单位质量GFeNMB的吸附量,通过不同质量磁珠吸附ASO后液体荧光强度减弱的幅度,来反应磁珠的吸附量,吸附后上清荧光强度减弱不大则吸附量少,减弱程度大则吸附量也大。按质量梯度(0、5、10、15、20 μg)分别吸取(0、10、20、30、40 μL)的磁珠溶液(0.5 mg·mL-1)与0.1 μmol·L-1的Survivin ASO(10 μL)在离心管中混合,加入不同体积的超纯水,使每管体积均为100 μL,每组3个复孔,涡旋振荡5 s,用锡纸包裹置于37 ℃培养箱中孵育30 min。所有工作溶液均采用超纯水。所有实验组的FAM-ASO浓度固定为0.1 μmol·L-1,反应体系为100 μL。用磁铁对离心管进行磁吸处理,视野中磁珠沉于离心管底部,吸取上清80 μL转移至微孔板中,酶标仪(吸收波长485 nm,发射波长528 nm)测量荧光强度。
1.4 磁珠吸附ASO的时间优化
以FAM荧光团标记的ASO来研究吸附荧光探针的最佳时间,通过计算不同时间磁珠吸附ASO后上清荧光强度的大小,研究最佳吸附时间,当上清荧光强度趋于不变,则吸附完全。将10 μL Survivin ASO(0.1 μmol·L-1)与30 μL磁珠溶液(0.5 mg·mL-1)在离心管中混合,加入60 μL超纯水,每管体积为100 μL,按时间梯度(0、10、20、30、60 min)每组3个复孔,涡旋振荡5 s,用锡纸进行包裹并在37 ℃培养箱进行孵育。所有工作溶液均采用超纯水。所有实验组的FAM标记Survivin ASO浓度固定为0.1 μmol·L-1。反应体系为100 μL。用磁铁对离心管进行磁吸处理,视野中磁珠沉于离心管底部,吸取上清80 μL于96孔板中,酶标仪(Enspire, Perkin Elmer)于吸收波长485 nm,发射波长528 nm测量荧光强度。
1.5 GFeNMB吸附反义寡核苷酸前后表征
GFeNMB由多层石墨烯片层包围,内核是氮化铁磁芯。GFeNMB由于石墨烯外壳具有石墨烯易团聚的特点,磁珠溶液中的实际颗粒是由大小和形状不同的颗粒组成,因此进行颗粒粒度检测,通常以平均粒径来表征颗粒的粒径。采用纳米颗粒粒径检测方法进行GFeNMB吸附Survivin ASO后的表征,包括以下步骤。①观察GFeNMB的形貌,将GFeNMB和GFeNMB-Survivin ASO置于TEM(JEM 2010,Japan)下观察粒径大小并拍照。②GFeNMB的粒度分析,将GFeNMB和GFeNMBSurvivin ASO使用激光粒度仪(Mastersizer 3000,Britain)检测磁珠于水相中的平均粒径。
1.6 GFeNMB的细胞毒性实验
将GFeNMB和空脂质体(Solarbio)分别制备成悬浮液加于细胞,比较两者在不同时间条件下对细胞的毒性作用,对GFeNMB的安全性进行评估。将肺癌A549细胞接种在96孔板中,每孔铺1×104个细胞,培养基体积为100 μL,待细胞密度达70%~80%时,将细胞分3组:GFeNMB组、空脂质体组、细胞对照组,每组设3个复孔,另设空白孔(只加100 μL培养基),按照时间梯度(0、24、48、72 h)常规培养后,每孔加入10 μL CCK-8(Sigma公司),培养箱中放置1.5 h后,观察到明显的颜色变化,溶液呈橙黄色,用全自动酶标仪测定各孔450 nm处吸光度,观察细胞活性。
1.7 GFeNMB-ASO转染
构建GFeNMB-ASO成功后进行磁转染。图2是GFeNMB吸附Survivin ASO形成载药体对细胞进行磁转染的过程,图3是载药体进入细胞内部的转染模拟图,包括载药体进入胞内囊泡,经历核内体逃逸后,ASO分别与胞内、核内Survivin mRNA发生杂交,ASO发挥作用阻断翻译,实现基因表达下调。转染步骤如下。①铺皿,在15 mm小皿(Corning)中将肺癌细胞A549培养于含10%胎牛血清、5%青霉素和链霉素的DMEM(Gibco公司,pH 7.2)培养基中,每皿2×105个细胞,培养基体积为1 mL;放置于37 ℃ 5% CO2培养箱(Thermo公司)中,待细胞密度达70%~80%时,进行转染。②转染,GFeNMB溶液磁吸后弃去上清,用1 mL无血清培养基重悬,加入Survivin ASO(152 μL,0.5 μmol·L-1)吹打混匀,在培养箱中孵育20 min,制成GFeNMB-Survivin ASO复合物,加入小皿中进行转染,脂质体转染组和未转染的细胞为对照。将磁铁放置在小皿底部,培养箱孵育40 min后撤掉磁铁,4 h后更换成10%胎牛血清和1%双抗的DMEM,继续培养24 h。③固定,吸出培养基,将细胞用PBS溶液清洗2遍后,用4%的多聚甲醛固定液固定细胞,每个皿中加500 μL固定液,固定液的量充分盖住样品,室温固定20 min,之后使用PBS溶液充分洗涤以去除残留的多聚甲醛。④DAPI染色,加入200 μL的DAPI染色液(Beyotime),覆盖住细胞,室温放置10 min,吸除DAPI染色液,用PBS溶液洗涤2~3次后,放入适量纯水,用激光扫描共聚焦显微镜(AX R,Nikon)进行荧光观测。
1.8 Western blot检测Survivin蛋白表达
将对数生长期细胞A549接种于6孔板中,每孔3×105个细胞,培养基体积为2 mL;待细胞密度达70%~80%进行转染,继续培养过夜。各组细胞分别加入裂解缓冲液(Beyotime)提取总蛋白,BCA法进行蛋白定量分析,用20 μg·孔-1上样,15% SDS-PAGE凝胶电泳分离,通过电转移法将蛋白质转移到硝酸纤维素膜后,在含5%脱脂奶粉的TBST中室温于摇床上慢速封闭1 h。封闭后TBST漂洗3次,每次10 min。加入一抗(1∶1000兔抗人Survivin,1∶10000 GAPDH),4 ℃孵育过夜后TBST漂洗3次,每次10 min,加入二抗(辣根过氧化物酶标记的羊抗兔IgG 1∶3000)室温于摇床上慢速孵育1 h。TBST充分漂洗3次,每次10 min。在膜上滴加化学发光试剂,显影仪进行显影,观察条带,用蛋白条带的平均光强度值表示Survivin蛋白表达的相对强度。
1.9 GFeNMB-Survivin ASO转染后肿瘤细胞凋亡情况
Annexin V-FITC/PI试剂(翌圣生物)双染检测细胞凋亡,以FITC标记的Annexin V作为探针,实现对早期凋亡细胞的检测。碘化丙啶(propidium iodide,PI)不能穿过活细胞的细胞膜,但可以把死细胞或晚期凋亡细胞的核染红。将A549细胞接种在6孔板中,每孔铺3×105个细胞,培养基体积2 mL,待细胞密度达70%~80%时进行转染。转染过夜后用不含EDTA的胰酶消化细胞后,300g4 ℃离心5 min。消化时间不要过长,防止假阳性。用预冷的PBS洗涤细胞2次,300g4 ℃离心5 min,离心管收集细胞。吸去PBS溶液,加入100 μL 1×Binding Buffer重悬细胞。加入5 μL Annexin V-FITC和10 μL PI 室温保存,轻轻混匀离心管。避光反应10~15 min。加入400 μL 1×Binding Buffer,混匀后放置于冰上,样品在1 h内用流式细胞仪进行检测。
1.10 GFeNMB-Survivin ASO对肿瘤细胞内活性氧水平影响
ROS在细胞中起着重要作用,它是许多大分子的潜在损伤源,ROS水平升高或者降低都会引起细胞的状态发生改变,造成细胞损伤。没有荧光的DCFH-DA可以穿过细胞膜,被细胞内的酯酶水解成DCFH。而DCFH不能透过细胞膜,因此使探针被装载到细胞内。在活性氧存在时,DCFH会被氧化生成荧光物质DCF,其荧光强度与细胞内ROS水平成正比,因此DCF的荧光强度可以反应细胞内活性氧的水平。ROS检测采用Beyotime法:在96孔板中接种A549细胞,每孔1.5×104个细胞,载药体转染过夜后,用无血清细胞培养液洗2遍,按1∶1000用无血清培养液稀释DCFH-DA,使终浓度为10 μmol·L-1。去除培养基,加入稀释好的DCFH-DA。37°C细胞培养箱内孵育20 min。用无血清细胞培养液洗涤细胞3次,以充分去除未进入细胞内的DCFHDA。酶标仪在488 nm激发波长、525 nm发射波长处检测荧光强度。
1.11 CCK-8检测GFeNMB-Survivin ASO对肿瘤细胞增殖的抑制作用
将状态良好的A549细胞接种在96孔板中,每孔铺1×104个细胞,培养基体积为100 μL,待细胞密度达70%~80%时进行转染。实验组为4个针对靶基因不同位点的ASO(表1),细胞对照组不加ASO处理,每组设3个复孔,另设空白孔(只加100 μL培养基),按照时间梯度(0、24、48、72 h)常规培养后,每孔加入10 μL CCK-8(Sigma公司),注意不要在孔中生成气泡,它们会影响OD值的读数。培养箱中放置1.5 h后,观察到明显的颜色变化,溶液呈橙黄色,用全自动酶标仪(波长450 nm)测定各孔吸光度,以评估细胞增殖能力的差异。
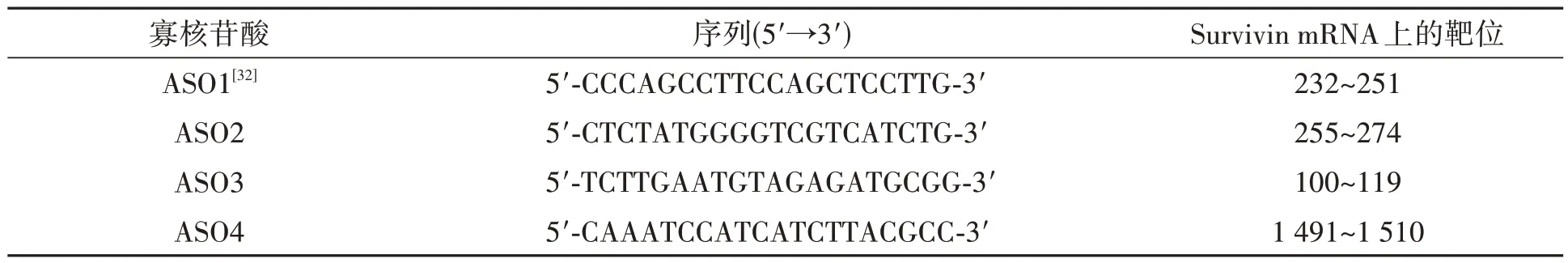
表1 反义寡核苷酸序列及其在Survivin mRNA上的靶位Table 1 Sequences of antisense oligonucletides and their target sites on the Survivin mRNA
1.12 细胞划痕实验检测A549细胞迁移能力
将处于对数生长期的A549细胞接种于6孔板中,调整细胞密度,使每孔的细胞密度为2×105个,待细胞分布均匀后放入培养箱过夜培养。待细胞密度达70%~80%时进行转染。将GFeNMB-Survivin ASO加入6孔板中,放回培养箱培养,4 h后更换完全培养基继续培养。待细胞汇合度达到90%左右,弃去旧的培养基,换成无血清培养基,用10 μL枪头在6孔板底部划线(2~3条)。用PBS将多余的细胞洗去后加入无血清的培养基,于37 ℃,5% CO2细胞培养箱中继续培养,分别在转染0、24 h后对同一位置进行拍照记录。
2 结果与分析
2.1 GFeNMB-Survivin ASO载药体的构建
根据GFeNMB对单链核酸的吸附能力,单位质量GFeNMB对ASO的吸附量及吸附的最佳时间,构建GFeNMB-Survivin ASO载药体。由图4A可知,当30 min孵育之后,自15 μg GFeNMB开始Survivin ASO被吸附后液体荧光强度不再变化,表明15 μg的GFeNMB对于Survivin ASO吸附达最大量。以此计算单位质量GFeNMB的吸附量。Survivin ASO1的分子量(μg·μmol-1)为6598.88(碱基数相同的ASO相对分子质量相差不大,这里使用ASO1进行检测);0.1 μmol·L-1的Survivin ASO(10 μL,约为6.6×10-3μg)在30 min被15 μg的GFeNMB吸附,1 μg的GFeNMB吸附4.4×10-4μg的Survivin ASO1。由于孵育过程中,探针自身也会有一定程度的荧光淬灭,所以吸附时间不宜过长。
根据图4B可知,最佳的吸附时间是20 min,在此之后随着时间变化,荧光强度变化不大,表明ASO已被吸附完全。据此制备GFeNMB-Survivin ASO载药体,按照1 μg的GFeNMB吸附4.4×10-4μg Survivin ASO的比例,将GFeNMB吸附Survivin ASO在37 ℃的培养箱中孵育20 min来构建载药体。
2.2 GFeNMB与GFeNMB-Survivin ASO的表征对比
检测GFeNMB吸附ASO后得到GFeNMB-Survivin ASO与GFeNMB的透射电镜结果(图5)。GFeNMB有明显的壳核结构(图5A),其中氮化铁核芯粒径范围为20~80 nm,外壳由多层石墨烯包覆。对磁珠进行超声处理后,其平均粒径是402.5 nm(图6)。GFeNMB-Survivin ASO的壳核结构完整(图5B),外层仍然有多层的石墨烯包覆。GFeNMB-Survivin ASO水相的平均粒径较GFeNMB有所下降,为337.2 nm(图6)。GFeNMB由于石墨烯外壳具有易团聚的特点,磁珠溶液中的实际颗粒是由大小和形状不同的颗粒组成,出现磁珠相粘连的形态。烯壳铁氮磁珠吸附反义寡核苷酸后平均粒径有所下降,磁珠颗粒分布变窄,分散性变好,推测原因是单链核酸在溶液中带有负电,溶液中的电荷作用使纳米颗粒分布均匀。
2.3 GFeNMB作为转染试剂的毒副作用评价
不同样品转染A549细胞后(图7),与空白对照相比,GFeNMB组(只加GFeNMB溶液)和Liposome组(只加脂质体)对细胞增殖有抑制作用,随着时间变化,Liposome组抑制效果逐渐明显。从0~72 h,实验组的细胞活力有所下降,其中空脂质体对细胞活力下降影响明显,说明空脂质体对细胞有较为明显的毒性,能够抑制细胞生长。有研究表明使用烯壳铁氮磁珠进行细胞分选,未产生明显的细胞损伤,细胞可以继续生长,说明磁珠的细胞毒副作用较小,不影响细胞生长[33]。GFeNMB的细胞毒性明显低于脂质体,因此使用GFeNMB进行细胞转染,更具安全性、简易性。
2.4 GFeNMB-Survivin ASO磁性转染效果
细胞转染过夜后,固定细胞进行DAPI染色,共聚焦荧光显微镜下蓝色是肿瘤细胞核区域,绿色是Survivin ASO示踪区域。图8中A组可以观察到GFeNMB-Survivin ASO转染肿瘤细胞后,绿色荧光集中重合在细胞核区域。B组可以观察到Lip-Survivin ASO转染细胞后,绿色荧光集中于细胞核周围,以此推断GFeNMB-Survivin ASO转染后大量ASO进入细胞核内,GFeNMB在核转染方面优于脂质体转染。C组是转染后48 h经过PI染色,观察到细胞核区域呈红色,绿色荧光消失,说明此时细胞出现死亡情况,GFeNMB-Survivin ASO可以诱导细胞死亡,抑制细胞增殖。
2.5 GFeNMB-Survivin ASO转染后细胞中Survivin的蛋白表达
采用Western blot检测各组A549细胞中Survivin蛋白表达,各组细胞中GAPDH蛋白条带亮度相近,在16.5 kD蛋白条带位置是Survivin蛋白条带位置[6],由图9A可观察到GFeNMB-Survivin ASO转染组蛋白条带表达量低于空白对照和脂质体组;由图9B可知GFeNMB-Survivin ASO转染组蛋白条带与脂质体组和空白对照组差异显著(P<0.0001),Lip-Survivin ASO转染组与空白对照组差异不显著。说明GFeNMB-Survivin ASO明显抑制Survivin的蛋白表达,转染效果优于脂质体转染,基因下调能力更明显。
2.6 GFeNMB-Survivin ASO转染后细胞凋亡情况
流式细胞仪检测细胞凋亡情况,FITC激发波长为488 nm,发射波长525 nm,FITC的绿色荧光在FL1通道;PI检测的最大激发波长为535 nm,最大发射波长为615 nm,PI的红色荧光在FL2通道。以FITC为横坐标,PI为纵坐标检测细胞分布。由图10A可观察到,GFeNMB-Survivin ASO转染细胞24 h后,与正常培养的细胞相比,实验组细胞的凋亡率约为17%;转染48 h后,实验组A549细胞的凋亡率约为26%,表明随着转染时间增加,转染组细胞凋亡比例增加。由图10B可知,GFeNMBSurvivin ASO转染组与细胞组凋亡率有显著差异(P<0.001)。图10C是GFeNMB-Survivin ASO磁转染细胞测量细胞内ROS水平,实验组细胞内ROS水平上升,与正常细胞组相比有显著性差异(P<0.01)。说明GFeNMB-Survivin ASO转染到肿瘤细胞后,下调Survivin基因的表达,诱导细胞发生凋亡,细胞代谢受到影响,导致细胞内ROS水平上升。
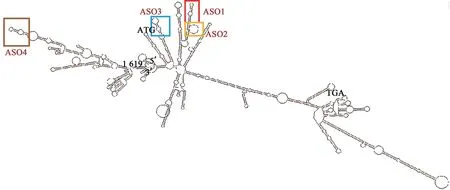
图1 37 ℃时Survivin mRNA的二级结构及ASO靶位Fig. 1 Secondary structure of Survivin mRNA at 37 ℃ and the target sites of ASOs
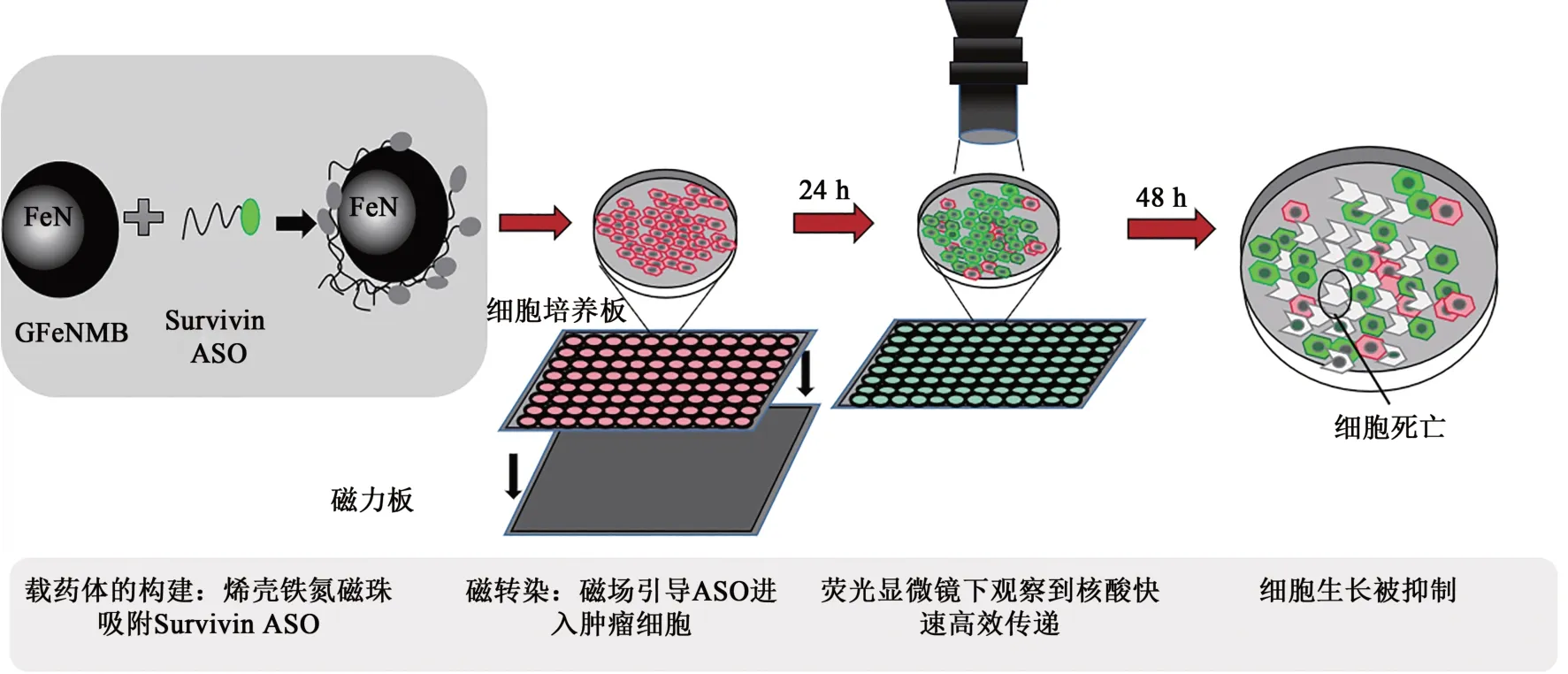
图2 GFeNMB运载Survivin ASO磁转染肿瘤细胞过程Fig. 2 Magnetofection of tumor cells with Survivin ASO carried by GFeNMB
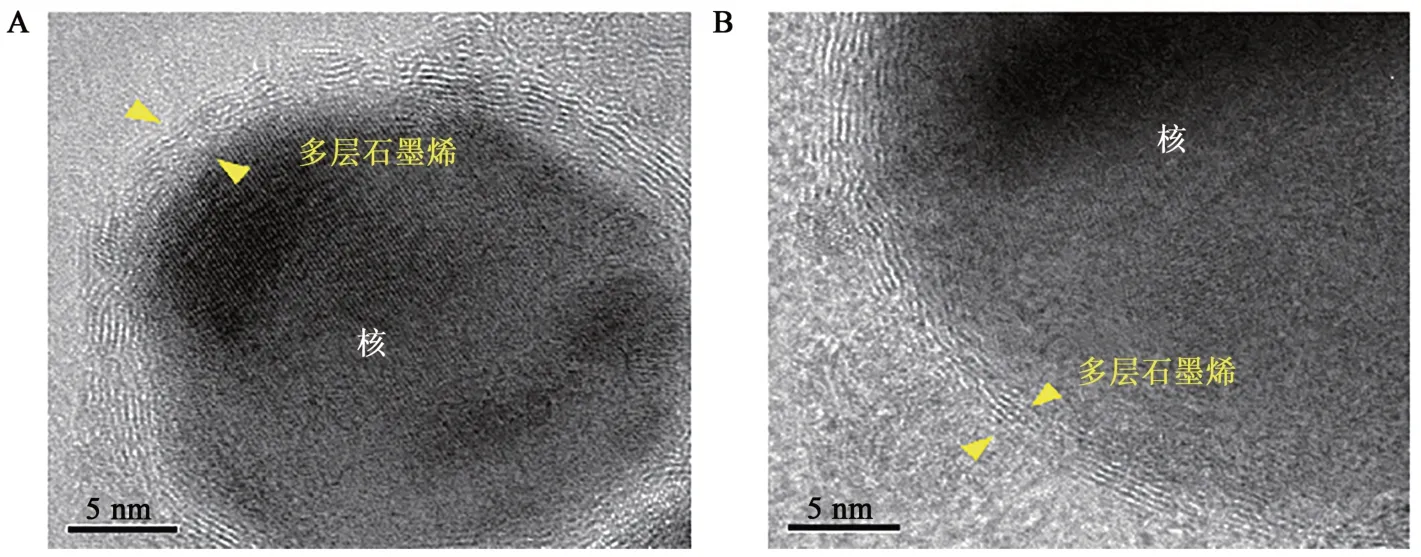
图5 GFeNMB与GFeNMB-Survivin ASO的TEM图Fig. 5 TEM images of GFeNMB and GFeNMB-Survivin ASO
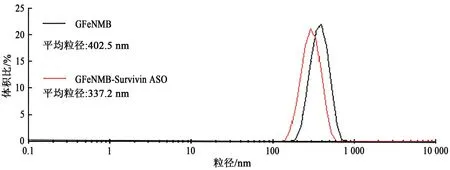
图6 GFeNMB与GFeNMB-Survivin ASO的水相粒径分布Fig. 6 Particle size distribution of GFeNMB and GFeNMB-Survivin ASO in water
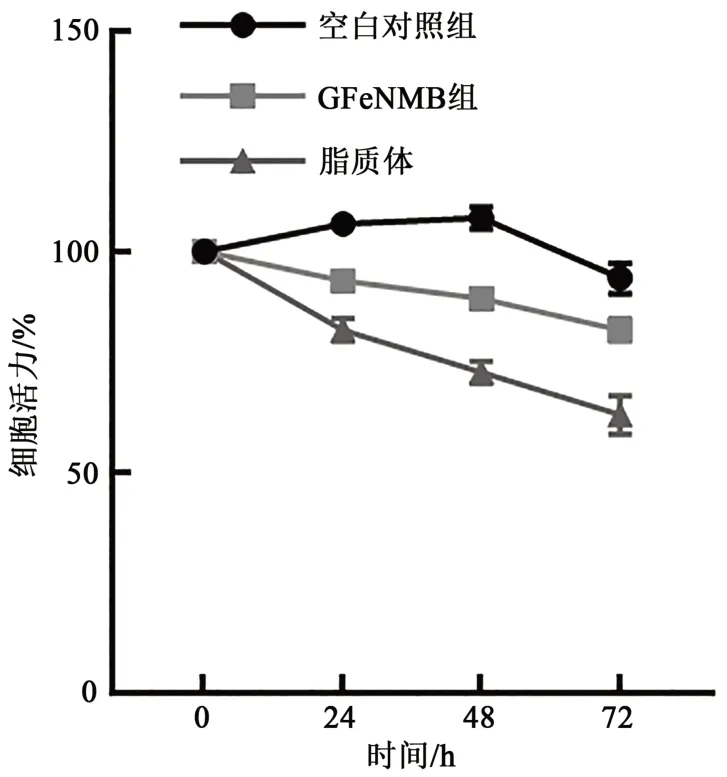
图7 GFeNMB和脂质体对细胞的毒性作用Fig. 7 Cytotoxicity of GFeNMB and liposome
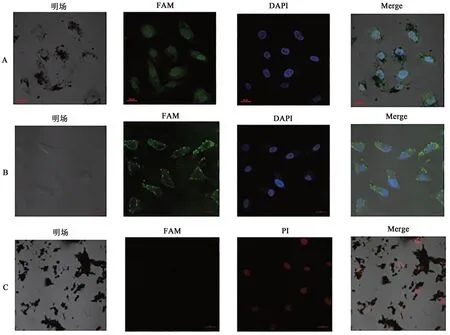
图8 GFeNMB-Survivin ASO转染后细胞的共聚焦显微镜荧光结果Fig. 8 Fluorescence images of cells after GFeNMB-Survivin ASO transfection
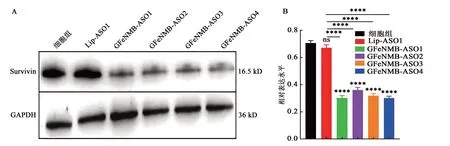
图9 GFeNMB-Survivin ASO和Lip-Survivin ASO转染后Western blot检测蛋白表达Fig. 9 Protein expression of GFeNMB-Survivin ASO and Lip-Survivin ASO transfected by Western blot
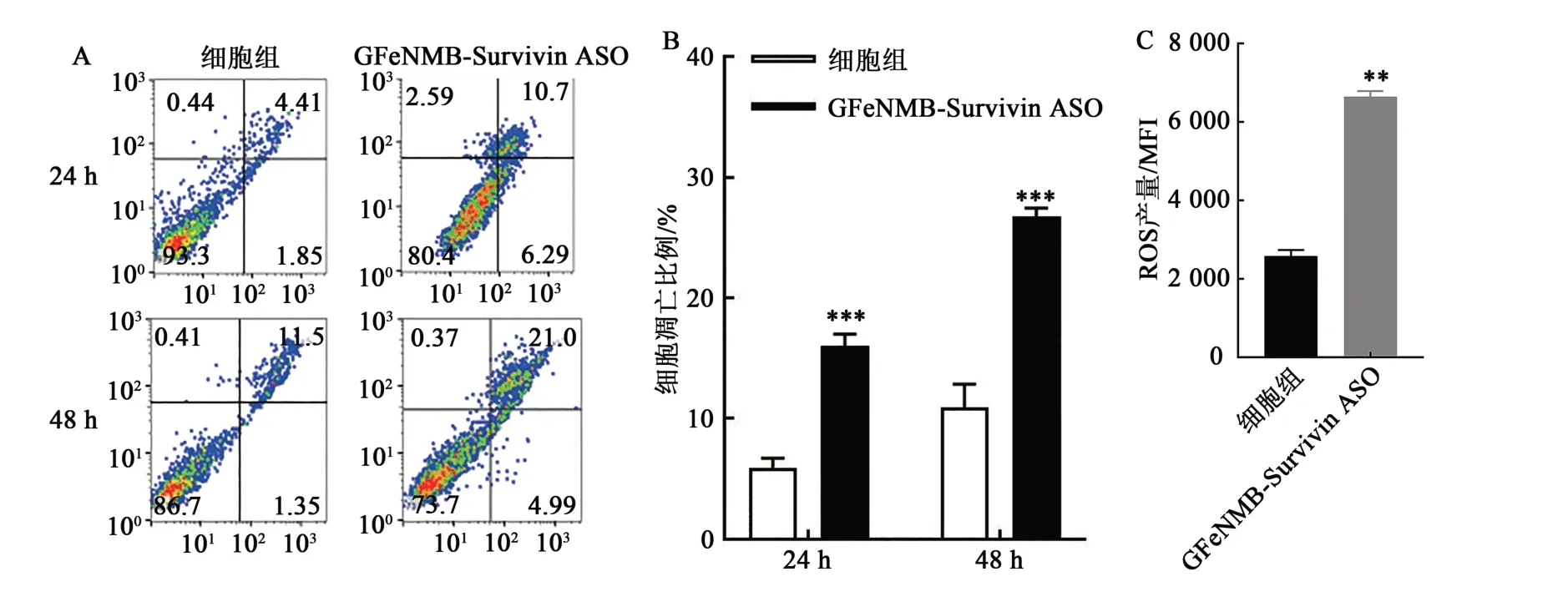
图10 GFeNMB-Survivin ASO转染后细胞凋亡情况Fig. 10 Apoptosis of cells after transfection with GFeNMB-Survivin ASO
2.7 GFeNMB-Survivin ASO磁性转染对肿瘤细胞的增殖抑制作用
不同序列的Survivin ASO分别转染A549细胞后,观察不同时间段各组细胞活力变化(图11)。与对照组相比GFeNMB-Survivin ASO转染后对细胞的增殖有一定的抑制作用,随着时间变化,抑制效果增加,实验组A549细胞活性明显低于正常对照组,实验组之间细胞活力差异不大。表明GFeNMB-Survivin ASO转染细胞后可显著抑制A549细胞的增殖。
2.8 GFeNMB-Survivin ASO对肿瘤细胞细胞迁移能力的影响
通过枪头在细胞生长区域划线模拟体外伤口愈合,在0、24 h观察细胞伤口距离变化,以研究细胞的愈合能力。实验结果如图12所示,空白对照组细胞在24 h后,细胞之间的迁移距离出现明显缩短,而磁性转染组细胞之间的迁移距离较空白对照有明显差距。数据分析结果(图12F)显示GFeNMB-Survivin ASO转染的A549细胞的迁移速度较对照组明显下降,与空白对照相比有显著性差异(P<0.0001),这一结果显示GFeNMB-Survivin ASO磁转染后降低了肺腺癌A549细胞的迁移能力。
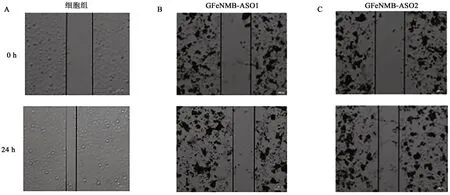
图12 GFeNMB-Survivin ASO转染后划痕实验在0、24 h细胞迁移结果Fig. 12 Cell migration results after transfected by GFeNMB-Survivin ASO at 0 and 24 h
3 讨论
目前研究较多的寡核苷酸药物包括ASO、siRNA、miRNA、aptamer等,其中ASO是将特定序列精准结合到靶RNA,进而抑制疾病相关基因的翻译,ASO正在被用于针对多种疾病的新型药物开发,在肿瘤治疗领域的应用前景可期[34-35]。Survivin基因作为肿瘤治疗的靶分子,通过Survivin基因序列设计合成ASO为癌症治疗提供了新的方向。有研究报道,Survivin ASO已经尝试用于调控非小细胞肺癌、急性髓系白血病、乳腺癌等多种肿瘤细胞的基因表达中,能够观察到抑制细胞增殖的情况[36-38],基于本文研究结果推测以脂质体作为ASO的转染工具,调控基因表达效果不明显,我们推测可能是其中有脂质体本身的细胞毒性导致细胞增殖能力受损,而非调控目的基因的表达。本研究中合成的靶向Survivin的ASO能够有效下调Survivin基因和蛋白的表达,从而抑制肿瘤细胞的增殖,诱导肿瘤细胞死亡,说明根据Survivin mRNA设计的ASO能发挥作用,为之后ASO的药物研究提供了参考。
当GFeNMB进行药物递送时,不同于许多寡核苷酸通过共价偶联脂质、抗体、糖分子等来实现药物递送,使其更容易接近目标细胞[39]。GFeNMB与单链寡核苷酸形成载药体,单链核酸简化药物处理工序,不需要对寡核苷酸进行其他修饰,一定程度上减少了对寡核苷酸的药物前加工,将药物制备工艺简化,便于生产均一化产品,并且在运载过程中GFeNMB的强吸附能力还能起到保护寡核苷酸的作用。脂质体是常用的转染试剂,本文毒性试验结果表明GFeNMB的细胞毒性远低于脂质体,因此具有安全性优势;Western blot蛋白分析中以脂质体为载体没有明显降低靶基因表达,以GFeNMB为载体时出现了明显蛋白表达下降的情况,因此具有有效性。
凭借GFeNMB表面石墨烯层对单链核酸的吸附性和生物相容性,形成稳定的GFeNMB-Survivin ASO复合体,通过磁场对载药体的操纵将载药体引入细胞内后,单链核酸与互补链杂交脱离GFeNMB,ASO发挥作用抑制Survivin mRNA翻译过程。以GFeNMB作为运载工具,相比于转染所用的脂质体和转染试剂,缩短了转染时间,采用磁转染方式,转染工具简易方便,只需要磁铁磁吸处理,在磁场引导下就能完成转染过程;就转染效果来说,通过共聚焦显微镜观察的磁转染图片可见GFeNMB具有核转染的优势,我们推测这是GFeNMB运载ASO调控靶基因作用优于脂质体的主要原因。GFeNMB制备简单可控,它的磁靶向特性,磁转染肿瘤细胞诱导细胞死亡的结果,为未来肿瘤疾病的磁靶向治疗提供了基础应用价值,也提示GFeNMB未来有可能成为单链核酸转染的通用工具。
总之,本研究根据Survivin mRNA设计的ASO是有效的,GFeNMB可安全有效性递送ASO。GFeNMB-ASO复合材料的抗肿瘤作用有待后续体内试验进一步确认。

