鸽A群轮状病毒实时荧光RT-PCR检测方法的建立及应用
邢安琪,彭真奇,蒋文明,克军宏,4,李 阳,陈 璐,5,王静静,许立华,于晓慧,刘华雷
(1.中国动物卫生与流行病学中心,山东青岛 266032;2.宁夏大学,宁夏银川 750021;3.安徽农业大学,安徽合肥 230036;4.塔里木大学,新疆阿拉尔 843300;5.山东农业大学,山东泰安 271018)
轮状病毒(rotavirus,RV)属于呼肠孤病毒科(Reoviridae)轮状病毒属(Rotavirus),是一种无囊膜、二十面体对称、双股正链RNA病毒[1-3]。RV基因组由11个分段的双链RNA片段组成,编码6种结构蛋白(VP1—VP4、VP6—VP7)以及6种非结构蛋白(NSP1—NSP6)[3-5]。RV结构蛋白在病毒复制、抗原特性保持、病毒基因分型中起到决定性作用,非结构蛋白影响病毒的毒力与复制过程[6-9]。根据VP6蛋白群特异性抗原决定簇差异,RV可分为10个种(群)(A—J),其中A群RV(group rotavirus A,RVA)是引起人类及多种畜禽急性脱水腹泻的重要病原体之一。
RVA是鸽群中一种常见的病原体,幼鸽感染后常出现腹泻、脱水等临床症状。1981年,RVA首次从比利时鸽群粪便中被检出,随后国外学者对鸽源RVA进行了众多研究[10-11]。1988年,日本学者Minamoto等[12]检测发现野鸽中RVA阳性率为32.4%,并首次从野鸽粪便中成功分离出两株RVA。Rubbenstroth等[13]对2010—2018年欧洲部分地区家鸽中RVA的感染情况进行调查,发现德国鸽舍RVA阳性率为51.56%,比利时为57.14%,丹麦高达100%。据报道[14],2016—2017年澳大利亚鸽子RVA总个体阳性率达13.73%,推测在此期间存在被感染风险的鸽子数量达12 328只。我国对禽RVA的研究主要围绕鸡群的感染情况、病毒分子生物学特性等相关领域,而针对鸽RVA的相关研究较少[15-16]。
RVA检测主要依靠实验室,目前针对鸽RVA检测方法的研究较少。我国已报道利用高通量测序技术检测出鸽RV[17-18],但该方法操作复杂、成本较高。为满足我国鸽RVA的检测需求,本研究针对RVAVP6基因设计特异性引物和探针,建立了一种灵敏度高、特异性强、重复性好的实时荧光RT-PCR检测方法,以期为鸽RVA的临床快速检测和流行病学调查提供技术支撑。
1 材料与方法
1.1 病毒和临床样品
禽流感病毒(avian influenza virus,AIV,包括H5、H7、H9、H10亚型)、新城疫病毒(Newcastle disease virus,NDV)、鸽源冠状病毒(coronavirus,CoV)、鸽RVA、鸽腺病毒(pigeon adenovirus,PiAdV)、鸽圆环病毒(pigeon circovirus,PiCV)和鸽疱疹病毒(pigeon herpesvirus,PiHV),均由中国动物卫生与流行病学中心禽病监测室保存。
192份鸽口腔/泄殖腔拭子样品和8份鸽临床组织样品,均于2022年采自云南、广东、福建、江西、安徽、河北、山东等7个省,由中国动物卫生与流行病学中心禽病监测室保存。
1.2 主要试剂
Fine pure病毒DNA/RNA柱式提取试剂盒(离心柱型),购自GENFINE公司;PrimerScript One Step RT-PCR Kit Ver.2 RT-PCR Kit、One Step PrimeScript RT-PCR Kit(Perfect Real Time),购自TaKaRa公司;DNA Extraction Kit,购自Solarbio公司;TIANprep Mini Plasmid Kit,购自TIANGEN公司;RNeasy Mini Kit(50),购自QIAGEN公司;RiboMAX Large Scale RNA Production Systems-T7,购自Promega公司。
1.3 样品处理
1.3.1 拭子样品 以10 000 r/min离心5 min,收取上清,-80 ℃保存备用。
1.3.2 病死鸽组织样品 剖检病死鸽,取适量的肝脏、脾脏等组织置于洁净的2.0 mL离心管内,按体积比1:3加入PBS及灭菌小钢珠,随后置于组织研磨机内充分研磨,反复冻融3次后,10 000 r/min离心5 min,收取上清,-80 ℃保存备用。
1.4 核酸提取
按照Fine pure病毒DNA/RNA柱式提取试剂盒(离心柱型)说明书,进行病毒DNA/RNA提取,将提取的DNA/RNA立即用于PCR扩增或者于-20 ℃保存。
1.5 cRNA标准品制备
1.5.1VP6基因重组质粒构建 针对鸽RVAVP6基因保守序列设计特异性引物(表1),以本实验室保存的鸽RVA阳性核酸为模板,进行RT-PCR扩增,扩增产物用1%琼脂糖凝胶电泳鉴定。利用Solarbio快速胶回收试剂盒对RT-PCR产物进行纯化回收,并克隆至pCI-neo载体,随后转化到Trans-109感受态细胞中,构建重组质粒,测序鉴定无误后提取细菌质粒。

表1 VP6基因目的片段扩增引物
1.5.2VP6基因体外转录 利用XbaI限制性内切酶对重组质粒进行酶切,经鉴定后利用DNA回收试剂盒对其进行纯化;取适量完全线性化的重组质粒,用RNA Production System-T7试剂盒进行体外转录,最后用RneasyMiNi Kit试剂盒对体外转录产物进行纯化。cRNA标准品分装后于-80 ℃保存。
1.5.3 cRNA标准品浓度测定与拷贝数计算
1.5.3.1 浓度测定 对cRNA标准品进行10、100倍稀释后,利用Nano Drop核酸定量仪分别测量其浓度,若其浓度呈10倍梯度差则测量准确。
1.5.3.2 拷贝数计算 拷贝数(copies/µL)=(6.02×1023)×(ng/µL×10-9)/(DNA length×340)。
1.6 引物、探针设计与合成
参考GenBank中已公布的鸽RVAVP6基因序列(GenBank登录号D16329、MN481635、MK692882、OK185349、KX815083),利用Primer express分析软件,设计特异性引物和TaqMan探针(表2),引物与探针均由生工生物工程(上海)股份有限公司合成。

表2 荧光RT-PCR引物和探针
1.7 荧光RT-PCR反应体系优化
以cRNA标准品为模板,按照TaKaRa荧光RT-PCR试剂盒说明书配置反应体系,并在此基础上完成反应体系和退火温度的优化。
1.7.1 探针浓度优化 固定反应体系中引物终浓度不变,分别加入0.15、0.20、0.25、0.30 mmol/L终浓度的探针进行试验,根据荧光RT-PCR的最低检出限确定最优探针浓度。
1.7.2 退火温度优化 在加入探针浓度为最佳且其他反应条件固定不变的情况下,将退火温度分别设置为58、59、60、61 ℃进行试验,每个温度做3个重复,通过比较不同退火温度下的Ct值确定最佳退火温度。
1.8 标准曲线建立
将cRNA标准品进行10倍倍比稀释,选取5个浓度梯度,进行荧光RT-PCR试验,以获得的Ct值为Y轴,cRNA标准品的浓度为X轴,绘制标准曲线。
1.9 特异性试验
以鸽群常见的CoV、NDV、AIV、PiCV、PiHV、PiAdV、RVA阳性核酸为模板,进行荧光RT-PCR扩增,评价该方法的特异性。
1.10 灵敏度试验
将鸽RVA cRNA标准品进行10倍倍比稀释,选取不同的稀释度进行荧光RT-PCR扩增,每个稀释度做3份重复。根据相关研究[19]合成RVA常规RT-PCR检测引物,同时对上述模板进行常规RT-PCR,用1.5%琼脂糖凝胶电泳鉴定,预期扩增片段长度为396 bp。根据结果评价该方法的灵敏度。
1.11 重复性试验
选取5个浓度梯度的cRNA标准品,用同批次配置的荧光RT-PCR反应体系进行检测,重复3次,计算组内重复变异系数(CV);用不同批次配置的荧光RT-PCR反应体系进行检测,重复3次,计算组间重复CV。
1.12 临床样品检测
利用本研究建立的鸽RVA荧光RT-PCR检测方法,对192份鸽拭子样品和8份鸽病料样品进行检测,同时用常规RT-PCR方法进行平行检测,并对两种检测方法的结果进行比较。
2 结果
2.1 cRNA标准品制备
以鸽源RVA核酸为模板,RT-PCR扩增VP6基因片段,扩增产物经纯化回收后克隆至pCI-neo载体,构建了重组质粒pCI-VP6。利用XbaI限制性内切酶对重组质粒进行酶切,使其线性化,目的条带约为7 472 bp(图1)。将完全线性化的标准质粒pCI-VP6经体外转录纯化后获得cRNA标准品,利用公式计算cRNA标准品的拷贝数为7.22×1012copies/µL。

图1 标准质粒pCI-VP6的PCR鉴定结果
2.2 荧光RT-PCR反应体系优化
2.2.1 探针浓度优化 保证其他反应体系不变,以7.22×106~7.22×101copies/µL的cRNA标准品为模板,使用不同终浓度的探针进行荧光RT-PCR检测。结果(图2)显示,0.15 mmol/L探针的检测下限为7.22×103copies/µL,0.20~0.30 mmol/L探针的检测下限均为7.22×102copies/µL,故探针浓度选择0.20 mmol/L。

图2 不同浓度探针最低检测限的比较结果
2.2.2 退火温度优化 以7.22×106copies/µL的cRNA标准品为模板,在其他条件不变的情况下将退火温度分别设置为58、59、60、61 ℃进行荧光RT-PCR,每个温度做3次重复,各Ct值见表3。根据结果,最终选择最佳退火温度为60 ℃。
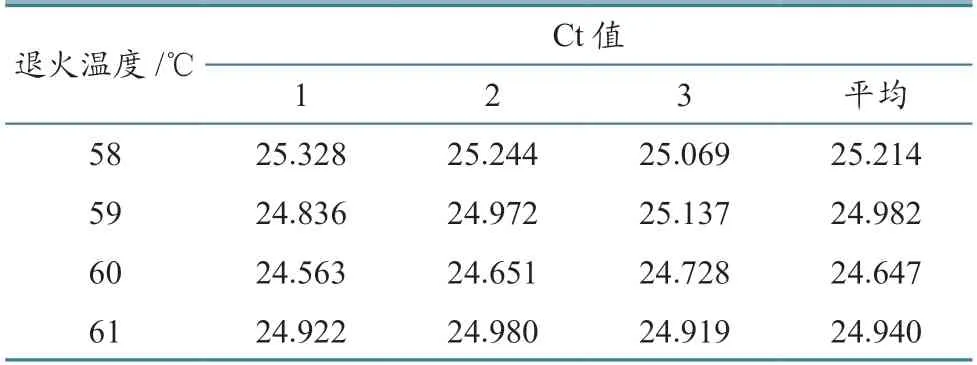
表3 荧光RT-PCR退火温度优化结果
2.2.3 反应体系及条件确定 最终确定的一步法实时荧光RT-PCR反应体系如表4所示。最佳反应条件:42 ℃ 5 min;95 ℃ 30 s;95 ℃ 5 s,60 ℃35 s,40个循环。
2.3 标准曲线建立
将cRNA标准品进行10倍倍比稀释,取7.22×(108~104)copies/µL浓度为模板,进行荧光RT-PCR反应,绘制标准曲线(图3)。标准曲线中Ct值和cRNA标准品拷贝数之间呈现良好的线性关系,获得的曲线方程为Y= -4.252X+15.852,相关系数R2为0.998。

图3 鸽源RVA荧光RT-PCR标准曲线
2.4 特异性试验
用鸽群7种常见的病毒核酸进行特异性试验。结果(图4)显示,只有鸽RVA核酸出现特异性扩增曲线,而建立的方法与其他鸽群常见病毒核酸无交叉反应,表明特异性良好。
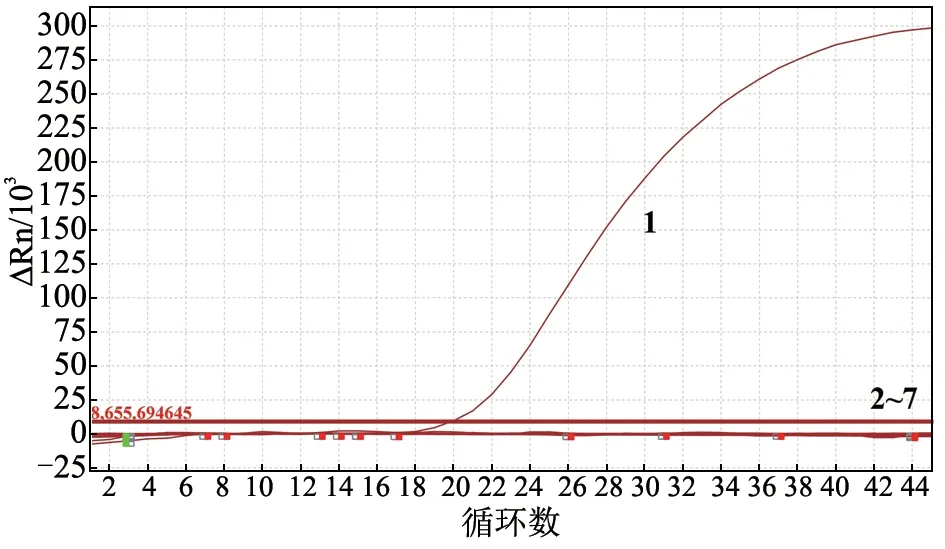
图4 鸽源RVA荧光RT-PCR特异性试验结果
2.5 灵敏度试验
以不同稀释倍数的cRNA标准品为模板,进行灵敏度试验。结果显示,本研究建立的实时荧光RTPCR方法的最低检测限为7.22×102copies/µL(图5),而常规RT-PCR最低检测限为7.22×104copies/µL(图6)。RVA荧光RT-PCR检测方法的灵敏度比常规RT-PCR高100倍。

图5 鸽源RVA荧光RT-PCR灵敏度试验结果
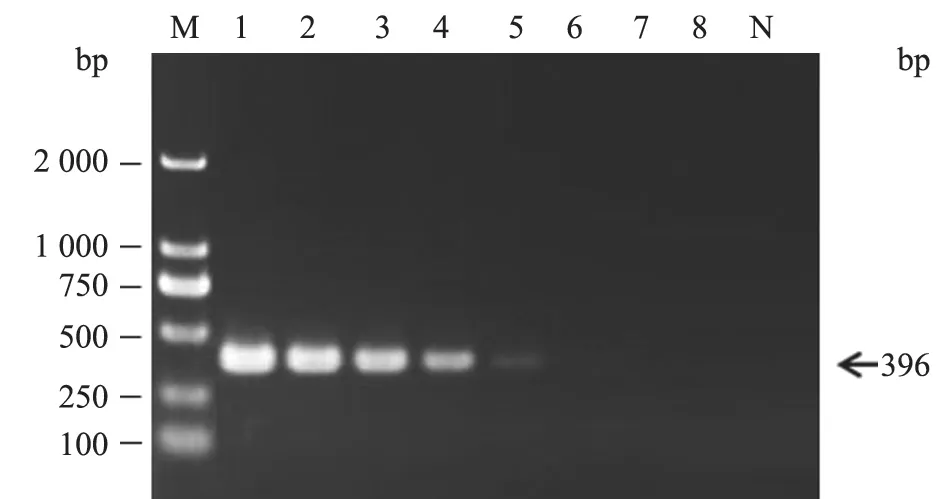
图6 鸽源RVA常规RT-PCR灵敏度试验结果
2.6 重复性试验
结果(表5~6)显示,该检测方法各稀释度标准品的组内重复CV为0.21%~0.91%,组间重复CV为0.28%~1.44%。组内重复CV均小于1%,组间重复CV均小于1.5%,说明该检测方法具有良好的重复性。

表5 鸽源RVA荧光RT-PCR组内重复试验结果
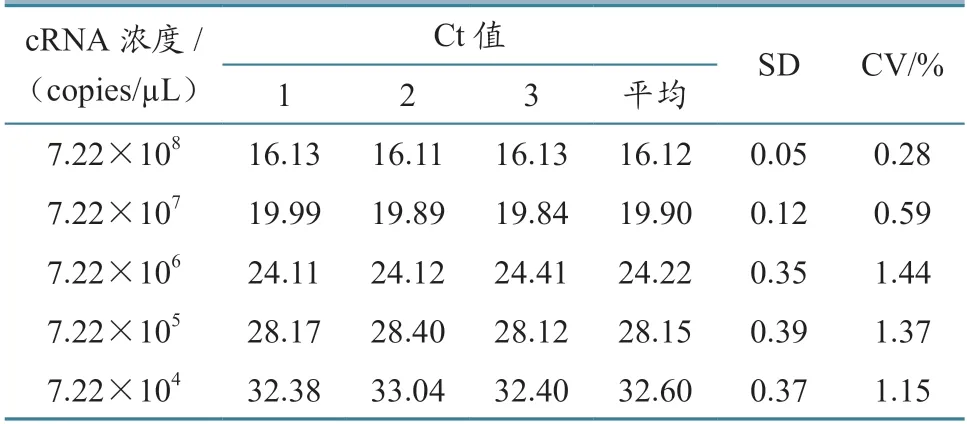
表6 鸽源RVA荧光RT-PCR组间重复试验结果
2.7 临床样品检测
利用本研究建立的实时荧光RT-PCR方法,对200份临床样品进行检测,结果检出37份阳性样品,阳性率为18.50%,而用常规RT-PCR方法从上述样品中检出25份阳性样品,阳性率为12.50%,两种方法的符合率为94.00%,Kappa值为0.773(表7)。
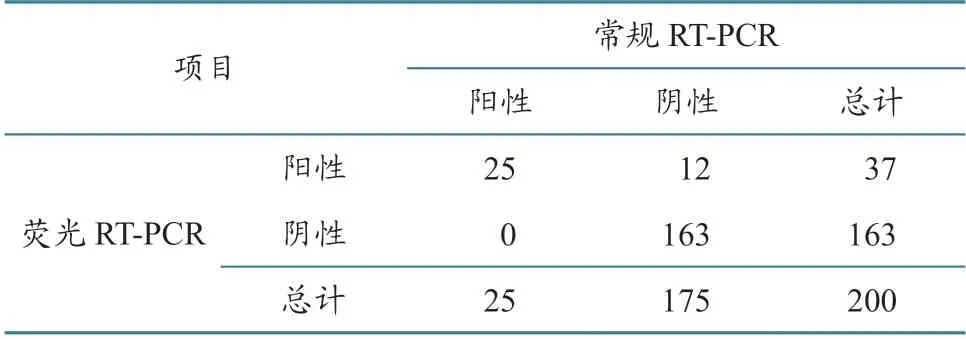
表7 RVA荧光RT-PCR与常规RT-PCR检测法检测结果比对 单位:份
3 讨论
近年来,随着我国养鸽业产业化、规模化、自动化发展,鸽子饲养数量逐年增加,饲养地区越加广泛,人们对鸽群中存在的相关疫病愈加重视。RV是鸽群中一种常见病原体,当鸽群感染RVA时,病鸽主要表现脱水、腹泻、增重减慢等临床症状。RVA可经粪-口传播,这使规模化鸽场存在大流行风险,尤其当与其他病原存在混合感染时,则会导致鸽群死亡率升高,严重影响鸽群生产力,阻碍养鸽产业发展[20]。
针对病原的早期检测是控制鸽群RV大规模感染和传播的关键[19]。目前临床上已有基于禽源RVA的多种检测方法,其中在电镜下观察细胞中存在的病毒粒子最为直观,但该方法中样品的处理环节较为繁琐;免疫荧光技术和RT-PCR技术是目前较为常用的检测技术,但均要求检测样本中的病毒载量较高,因此灵敏度相对较差;高通量测序技术成本相对较高,后续基因组序列拼接过程较为繁琐;此外,基于禽源RVA建立的检测方法对鸽源RVA敏感性不强。因此,亟需建立针对鸽群RVA的快速、灵敏、特异、准确的检测方法,以期为开展鸽源RVA的早期检测提供技术支持。
本研究基于鸽RVAVP6基因保守序列设计特异性引物及探针,并对其反应体系及反应条件进行优化,建立了鸽RVA实时荧光RT-PCR检测方法。本研究中使用的标准品是经过体外转录过程合成的cRNA,具有良好的稳定性和灵敏度,提高了对样品处理以及逆转录过程的控制,为检测方法的稳定提供了基础[21]。特异性、灵敏度试验结果显示,该检测方法特异性良好,只有鸽RVA核酸出现特异性扩增曲线;灵敏度高,最低检测限为7.22×102copies/µL,比常规RT-PCR灵敏100倍;重复性试验中组内重复CV为0.21%~0.91%,组间重复CV为0.28%~1.44%,均小于1.5%,提示该检测方法的可重复性好。
利用本研究建立的RVA实时荧光RT-PCR方法与常规RT-PCR方法,同时对200份临床疑似鸽RVA感染样品进行检测,发现两种方法的符合率为94.00%,且实时荧光RT-PCR阳性率(18.50%)高于常规RT-PCR(12.50%),提示本研究所建立的RVA检测法与临床上常用的检测法一致性良好,且灵敏度更高,具有良好的临床诊断性能。综上所述,本研究建立了一种快速、敏感、特异、准确的鸽RVA实时荧光RT-PCR检测方法,为鸽RVA感染的早期诊断及综合防控提供了必要的技术支持。

