关于次氯酸钠储存条件的研究
孙 瑞
(太原水质监测站有限公司,山西 太原 030009)
据监测,目前多数城市地下水受到一定程度的污染,进一步加剧了水资源短缺的矛盾,而且还影响到市民的安全饮水和健康问题。消毒是生活饮用水处理工艺中不可或缺的组成部分,20 世纪初发现氯可以灭除水体中的致病微生物,氯消毒在给水处理中得到广泛的应用,成为本世纪保护人体健康的重要技术之一[1]。
目前,从水体消毒剂的种类来说,有液氯、次氯酸钠溶液、现场电解食盐水制备次氯酸钠、二氧化氯等药剂和方式,此外还有臭氧、紫外线消毒等一些手段[2]。
液氯灭菌能力强,具有余氯的持续消毒作用,液氯在投加时会气化成剧毒气体,有强腐蚀性;运输和仓储要求高,极易造成泄漏和爆炸事故[3]。二氧化氯可有效地氧化细胞内的酶,还可以快速地抑制蛋白质的合成来破坏微生物,同时二氧化氯与污水中的有机物作用不产生三卤甲烷等致癌物质[4]。但存在成本较高、现场制取设备复杂、需要控制副产物氯酸盐和亚氯酸盐等的缺点。紫外线消毒是一种物理消毒法,在适当波长下的紫外线能够破坏微生物机体细胞中的分子结构,造成细胞死亡,达到杀菌消毒的目的。但由于设备长期运行,将会抑制紫外线的透射,同时紫外灯灯管的有效寿命有限[5]。次氯酸钠溶液毒性小,消毒系统更容易操作,易于储存等优势也使得次氯酸钠成为广泛应用的一类消毒剂。但次氯酸钠容易见光分解导致变质、成品生产及运输成本高、不宜长时间存储[6]的原因使得我们需要探寻一种更好的储存条件来实现高效节能的目的。
1 次氯酸钠的性质
1.1 物理性质
次氯酸钠溶液是一种呈微黄色,有类似氯气的刺激性气味,稳定性差于氯气,见光易分解、易挥发的液体,故应避光储存,不可曝晒和久藏[7]。
1.2 不稳定性
1.2.1 自然分解
次氯酸钠是一种强氧化剂,即使在常温且没有外在因素的情况下也会释放出活性氧原子发生自然分解。光照、高温、紫外线都会加速这一进程,其反应如式(1):
1.2.2 水解和酸解
次氯酸钠在水中发生水解反应,产生次氯酸,为可逆反应,而且在一定的pH 范围内,pH 越低,HClO的比例越高,氧化性和消毒能力越强。
次氯酸是一种弱酸,其电离度很低,在25 ℃时解离常数为2.9×10-8,所以次氯酸钠极易发生水解反应。或在酸性条件下,次氯酸根离子与氢离子结合生成次氯酸而进一步分解[8]。
1.2.3 歧化反应
次氯酸钠在极高浓度会发生歧化反应,(Cl-)在溶液中与(O)经过反复碰撞形成[ClO-…2O]或[Cl-…3O],生成更加稳定的氯酸盐副产物[9],其反应如式(2):
1.2.4 催化反应
在次氯酸钠溶液中,钴、镍、锰、铜和铁等过渡金属离子可以催化次氯酸钠的分解反应,同时氨、铵盐和胺也会加速次氯酸钠分解[10]。
次氯酸钠的分解往往是以上几个反应同时进行。次氯酸钠分解机理近似于一级化学动力学反应,即反应速率与反应物浓度的一次方成正比,且反应一段时间后,反应物的浓度主要和体系温度有关。
2 次氯酸钠的消毒原理
次氯酸钠的灭菌原理主要是通过它的水解,再进一步分解形成新生态氧[O],新生态氧的极强氧化性使菌体和病毒的蛋白质变性,从而使病源微生物致死。其过程可用化学方程式表示如式(3)、式(4):
次氯酸在杀菌、杀病毒过程中,不仅可作用于细胞壁、病毒外壳,而且因次氯酸分子小,不带电荷,能迅速扩散到菌(病毒)表面,并通过细胞壁穿透到细菌内,与病毒体蛋白、核酸、和酶等发生氧化反应,从而杀死病原微生物。同时,氯离子还能显著改变细菌和病毒体的渗透压使其丧失活性而死亡[11]。
3 影响次氯酸钠稳定性的因素
目前市场上供应的次氯酸钠原溶液质量分数均在10%左右,浓度高,挥发性强[12],因此在运输和储存过程中容易发生歧化和分解反应,导致有效氯降低,并可能形成影响饮用水质的副产物氯酸盐。氯酸盐是一种对人体有害的物质,易引起人体有用矿物质的流失,我国现行(GB 5749—2006)对氯酸盐质量浓度限值为0.7 mg/L[13]。
次氯酸钠溶液的稳定性受多方面因素的影响,温度、pH 值、光照、浓度、储存时间等,均会改变次氯酸钠的分解速率,影响其中有效成分,甚至降低消毒效果。为提高次氯酸钠的储存稳定性,进行了其储存条件的研究。
4 次氯酸钠储存条件的研究
4.1 次氯酸钠-有效氯的测定
4.1.1 测定原理
在酸性介质中,次氯酸根与碘化钾反应,析出碘,以淀粉为指示剂,用硫代硫酸钠标准溶液滴定,至蓝色消失为终点。反应过程如式(5)、式(6):
4.1.2 实验测定
利用碘量法,依据《次氯酸钠》GB 19106—2013方法进行测定,称取试样溶液(碘化钾溶液和硫酸溶液)置于碘量瓶中,迅速盖紧瓶塞后水封,置于暗处静置后,用硫代硫酸钠标准溶液滴定记录所消耗的体积。
4.1.3 结果计算
有效氯以氯的质量分数w 计算,按照式(1)计算,数值以%表示:
式中:V 代表硫代硫酸钠标准滴定溶液的体积,mL;c 为硫代硫酸钠标准溶液的浓度,mol/L;m 为试样质量,g;M 为氯的摩尔质量,g/mol(M=35.453)。
4.2 浓度对有效氯的衰减量的影响
为验证不同浓度下(次氯酸钠溶液原液和稀释至7%、5%、3%)次氯酸钠溶液的衰减速率,分别对次氯酸钠一系列的浓度的衰减速率进行了研究测定。将4 个不同质量分数(10%、7%、5%、3%)的次氯酸钠溶液同时放置在正常光线、温度保持在16~18 ℃、20~22 ℃、25~28 ℃的房间内、研究周期为30 d,观察有效氯随放置时间的变化情况。研究有效氯的衰减量变化情况以图形式表示如图1:
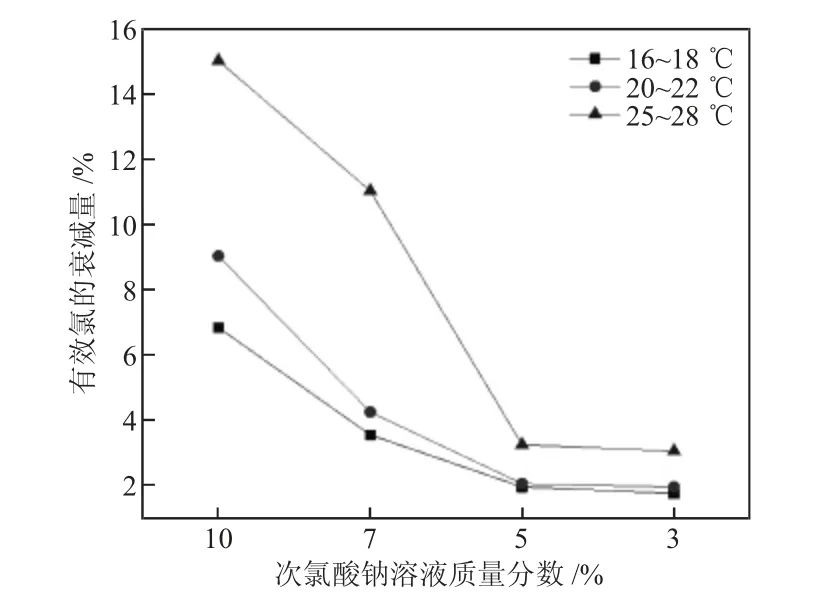
图1 次氯酸钠的质量分数与有效氯衰减量的关系
由图1 可知,在正常光线、储存温度相同的情况下,随着次氯酸钠溶液质量分数的增加,有效氯的衰减量逐渐升高。质量分数为3%时,具有最小的有效氯的衰减量,但为了更好地满足水厂日常运行的需要,必须保证足够的次氯酸钠浓度才能保证水处理的效果,因此,次氯酸钠的质量分数不可能无限的降低,结合水厂实际生产操作和相应的水处理效果,对投加的稳定性和运行成本进行综合分析,最终决定采用质量分数为5%的次氯酸钠溶液(将质量分数10%次氯酸钠成品进行1∶1 稀释)作为储备溶液。
4.3 温度对有效氯的衰减量的影响
实验将成品10%(质量分数)的次氯酸钠溶液分别稀释配制成质量分数约为7%、5%、3%的消毒剂溶液,然后研究不同质量分数(10%、7%、5%、3%)的次氯酸钠溶液在不同温度下一个月后有效氯的衰减变化情况。具体见图2。

图2 次氯酸钠的储存温度与有效氯的衰减量的关系
由图2 可知,在质量分数相同的情况下,随着温度的升高,有效氯的衰减量在逐渐增大,随着温度由16~18 ℃升到25~28 ℃,有效氯的衰减量在逐渐的升高。因而次氯酸钠溶液应该尽量在低温下保存,可以有效地降低其分解速度。
4.4 储存时间对有效氯的衰减量的影响
将4 个不同质量分数(10%、7%、5%、3%)的次氯酸钠溶液均放置在自然光线、温度保持在16~18 ℃,研究次氯酸钠的有效氯衰减量随放置时间的变化情况。
由图3 可知,在储存温度和浓度一定的条件下,随着储存时间的加长,有效氯的衰减量增大。结合水厂消毒剂的购买量和购买周期,建议将消毒剂的使用周期控制在一个月左右。
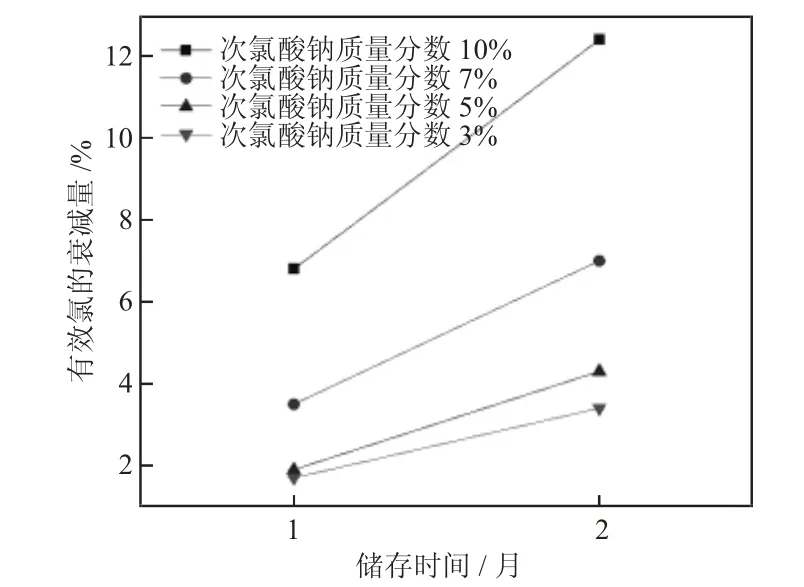
图3 次氯酸钠的储存时间对有效氯的衰减量的影响
4.5 光照以及遮光对有效氯的衰减量影响
在两个不同的环境中(一个环境中有少量时间的阳光直射光照,另一个环境为自然光线环境,无阳光直射),温度同为25~27 ℃,同时在每一个环境中放置2 桶相同质量分数的次氯酸钠溶液(约10%),区别是一个不遮光,另一个用黑布罩住遮光,在30 d 后,研究其有效氯的衰减情况,其研究结果见图4。
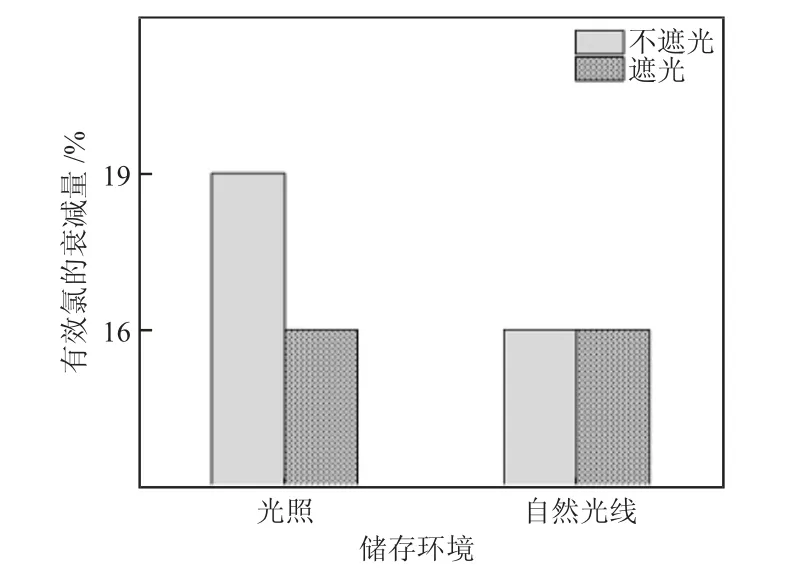
图4 光照及遮光对有效氯衰减量的影响
由图4 可知,在次氯酸钠质量分数为10%,储存温度为25~27 ℃,消毒剂在光照条件下比在自然光线情况下有效氯的衰减量大,衰减较为显著,因此研究结果为在自然光线下次氯酸钠的衰减速率较慢,且遮光与不遮光条件下区别不大,无需刻意遮蔽。
5 结果与讨论
1)影响次氯酸钠有效氯降低的主要因素是温度,随着温度的升高,有效氯降低的速度变快,在16~18 ℃的温度范围内最稳定,减小速度最慢。
2)质量分数为5%的次氯酸钠溶液有效氯稳定,在一个月的时间内其有效氯基本不受温度的影响变化。
3)次氯酸钠溶液的存储在自然光线条件下即可。
4)根据图2 研究结果显示,质量分数为5%时,在温度16~18 ℃和20~22 ℃下有效氯衰减量基本相同,考虑到温度控制成本,选择温度条件为20~22 ℃。
6 结论
根据研究结果与实际成本考虑,将次氯酸钠原液(10%)稀释到5%,将环境温度设置为20~22 ℃,自然光线,在这个条件下可保证次氯酸钠有效氯稳定保存更长时间。
另外,次氯酸钠分解会生成的O2、Cl2都是气体物质,长时间密闭保存会带来安全隐患。因此,储藏环境要低温、通风,可选用避光效果好的包装材料如玻璃纤维增强聚酯,橡胶的钢制容器以及棕色玻璃瓶等。

