归术益坤方通过调控LPS/TLR-4通路对多囊卵巢综合征大鼠的影响
林青 刘艳霞 佟庆 陈雨 颜芳 邢玉
多囊卵巢综合征(polycystic ovarian syndrome,PCOS)是一种以内分泌紊乱为主、多种代谢异常导致的异质性临床综合征,因其发病机制始终尚未明确,该病一直是妇科临床的难点重点。中医药治疗PCOS疗效突出,国医大师柴嵩岩治疗本病颇有心得,其自拟方“归术益坤方”已通过临床试验[1]证实,该方对于改善PCOS患者相关症状效果明确。本课题组前期研究通过大鼠及细胞实验证实,归术益坤方可以影响卵巢颗粒细胞自噬,发挥治疗效果[2],但该方对于PCOS的具体治疗机制尚不明确,需进一步细化。归术益坤方中多味中药被证实对于肠道菌群调控具有一定影响,本实验复制来曲唑诱导的大鼠模型,以归术益坤方进行干预,观察中药对PCOS大鼠体质量、卵巢大小及形态、血清睾酮、空腹血糖、脂多糖(ipopolysaccharide,LPS)、相关炎症因子、卵巢组织中Toll样受体4(toll like receptor-4,TLR-4)表达的影响,研究归术益坤方通过调控LPS/TLR-4通路治疗PCOS的潜在机制。
1 材料与方法
1.1 动物
SPF级6周龄雌性SD大鼠18只,体质量(180±15)g,北京维通利华实验动物技术有限公司提供,动物许可证号:SCXK(京)2016-0006。常规饲养于北京中医药大学SPF级屏障环境,12小时光照/黑夜循环,温度25 ℃,湿度60%,自由摄食饮水。本研究已通过北京中医药大学动物实验伦理委员会审查,伦理审查批号:BUCM-4-2018101001-4030。
1.2 实验药物、主要试剂与仪器
归术益坤方颗粒剂(菟丝子20 g、白术15 g、当归15 g、南沙参12 g、车前子15 g、茜草12 g、丝瓜络10 g、浙贝母10 g),购于北京中医药大学东方医院,常规开水冲泡,制成药液每mL含3 g颗粒剂;来曲唑片,江苏恒瑞医药股份有限公司,批号:190316KG,将来曲唑溶于1%羧甲基纤维素(carboxylmethyl cellulose,CMC)溶液中,每mL含0.5 mg来曲唑药粉。
血清睾酮(testosterone,T)测定试剂盒(北京北方生物技术研究所,批号:20190602);白细胞介素-18(interleukin-18,IL-18)酶联免疫试剂盒(南京建成生物工程研究所,批号:20190404);肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)酶联免疫试剂盒(南京建成生物工程研究所,批号:20190410);LPS酶联免疫试剂盒(上海赫澎生物科技有限公司,批号:HPBIO-Elisa711);血糖酶法试剂盒(北京百奥泰康生物技术有限公司,批号:DL201901)。离心机(恒诺仪器,AXTGL16M);切片机(Leica,RM2235);电子天平(Sartorius公司,Cubis®MSA224S-000-DA);石蜡包埋机(Leica G1150H);全自动生化仪(日本奥林巴斯株式会社,AU480);γ 放射免疫计数器(西安核仪器厂,XH-6080);全自动酶标仪(THERMO V.2.3);电泳仪(biorad,EPS 300);凝胶成像仪(biorad,2500)。兔抗大鼠TLR-4抗体(Abcam,Ab13556),山羊抗兔IgG(MDL公司,MD912577)。
1.3 分组、造模及给药
采用随机数字表法将18只大鼠随机分为空白组、模型组、中药组,每组各6只。适应性喂养后模型组及中药组大鼠按1 mg/(kg·d)连续灌服来曲唑药液21天; 空白组连续灌服同体积CMC溶液21天,复制PCOS大鼠模型[3]。第22天开始,中药组加灌归术益坤方药液3 g/(200 g·d),模型组及空白组加灌同体积蒸馏水,连续28天。造模及给药过程中无大鼠死亡。
1.4 取材
最后1次给药后,大鼠饥饿12小时,腹腔注射0.4%戊巴比妥(1 mL/100 g)麻醉,75%酒精消毒腹部皮肤,打开腹腔,腹主动脉取血,1500 转/分钟离心5分钟,收集血清。取大鼠双侧卵巢,右侧卵巢置于4%多聚甲醛固定,左侧卵巢-80℃保存。
1.5 大鼠形态学监测
适应性喂养7天后,每隔7天测量各组大鼠体质量,第1天给药前和最后1次给药后测量大鼠身长(鼻尖至肛门的距离),按公式计算Lee’指数[4],比较实验前后大鼠体质量及Lee’指数。公式如下:
Lee’s =体质量(g)^(1/3)×103/体长(cm)
1.6 大鼠动情周期监测
在取材前一周,监测大鼠阴道脱落细胞涂片,比较三组大鼠动情周期的变化[5],并分别绘制动情周期曲线图。
1.7 大鼠卵巢形态和病理切片变化
取材时,大鼠卵巢取出后立即对大鼠双侧卵巢分别称重,测量双侧卵巢长、宽和厚,比较三组大鼠卵巢体积。通过HE染色右侧卵巢组织,比较各组卵巢病理切片变化。
1.8 血清学检测
比较三组大鼠血清睾酮(testosterone,T)、空腹血糖(fasting plasma glucose,FPG)、白细胞介素-18(interleukin-18,IL-18)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、脂多糖(lipopolysaccharide,LPS)水平。T水平采用放射免疫法检测,FPG水平采用干化学法检测,血清IL-18、TNF-α、LPS水平采用ELISA法检测。
1.9 Western-blot法检测TLR-4蛋白表达
卵巢组织研磨匀浆后提取总蛋白,BCA蛋白定量法测定蛋白浓度,蛋白上样Buffer将蛋白定量为5 mg/mL。制备SDS-PAGE凝胶,上样,电泳。湿转法65V转膜2小时至PVDF膜上,置封闭液中封闭1小时。加入一抗(1∶1000稀释)4℃孵育过夜,TBST缓冲液室温下缓慢摇动洗涤三次,每次10分钟。二抗用TBST稀释300倍,室温、避光缓慢摇动作用1小时。洗膜后用ECL发光试剂盒显色,化学发光成像系统成像。目标蛋白相对表达量=目标蛋白灰度值/内参(β-actin)灰度值。
1.10 统计学方法

2 结果
2.1 各组大鼠体质量和Lee’s指数比较
造模前,三组大鼠体质量和Lee’s指数均无明显差异(P>0.05);实验结束后,模型组大鼠体质量、Lee’s指数均显著高于空白组,差异有统计学意义(P<0.01)。
给中药前,模型组大鼠和中药组大鼠体质量差异无统计学意义(P>0.05);给药后,中药组大鼠体质量较模型组显著下降(P<0.01),Lee’s指数较模型组无明显统计学差异(P>0.05)。具体结果见表1。

表1 各组大鼠给药前后体质量和Lee’s指数比较
2.2 各组大鼠动情周期监测结果
空白组大鼠可以观察到完整动情周期,模型组大鼠未见规律动情周期, 出现动情周期紊乱、 发情期缩短或无动情周期波动,中药组大鼠造模结束后出现动情周期消失或紊乱,给药结束后,动情周期波动好转,观察后期可见完整动情周期,部分中药组大鼠实验后期动情周期呈规律波动状态,具体见图1。
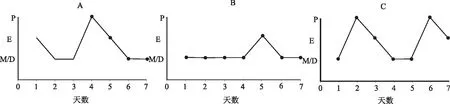
注:A:空白组;B:模型组;C:中药组。
2.3 各组大鼠血清睾酮水平、空腹血糖水平比较
与空白组相比,模型组大鼠T水平升高,差异有统计学意义(P<0.05);与模型组相比,中药组大鼠T值降低,差异有统计学意义(P<0.05)。与空白组相比,模型组大鼠FPG水平显著升高,差异有统计学意义(P<0.01),中药组大鼠FPG水平显著低于模型组,差异有统计学意义(P<0.01)。具体结果见表2。

表2 各组大鼠给药后血清睾酮、空腹血糖水平比较
2.4 三组大鼠卵巢重量及体积比较
左卵巢重量:模型组大鼠较空白组有所增加(P<0.05),中药组大鼠较空白组显著增加(P<0.01),中药组大鼠较模型组无明显差异(P>0.05)。
右卵巢重量:模型组大鼠、中药组大鼠较空白组均显著增加(P<0.01),中药组大鼠较模型组无明显差异(P>0.05)。
左卵巢体积:三组间比较均无明显差异(P>0.05)。
右卵巢体积:模型组大鼠较空白组显著增大(P<0.01),中药组大鼠较模型组显著缩小(P<0.01),空白组大鼠与中药组之间无明显差异(P>0.05)。具体结果见表3。

表3 各组大鼠给药后卵巢重量、体积比较
2.5 各组大鼠卵巢组织HE染色观察
空白组大鼠卵巢可见优势卵泡和黄体;模型组大鼠明显可见数个囊状卵泡,未成熟卵泡数量一个切面内大于12个,未见优势卵泡及黄体,卵泡大小明显减小,可见闭锁卵泡,囊泡颗粒细胞层较空白组明显变薄;中药组大鼠可见优势卵泡和黄体,未成熟卵泡数量较模型组减少,但较空白组有所增多,卵泡内可见卵丘,颗粒细胞层厚度接近于空白组颗粒细胞层厚度。具体见图2。
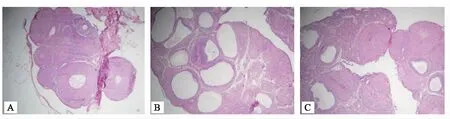
注:A:空白组;B:模型组;C:中药组。
2.6 各组大鼠血清LPS水平及IL-18、TNF-α促炎因子水平比较
与空白组大鼠相比,模型组大鼠血清LPS水平明显上升,差异有统计学意义(P<0.05),同时血清炎症因子IL-18、TNF-α水平均显著上升,差异有统计学意义(P<0.01);与模型组大鼠相比,中药组大鼠血清LPS、IL-18均明显下调,差异均有统计学意义(P<0.05,P<0.01)。具体见表4。

表4 各组大鼠给药后血清LPS、IL-18、TNF-α水平比较
2.7 各组大鼠卵巢组织TLR-4蛋白表达水平比较
空白组相对蛋白灰度比值为(1.00±0.185),模型组为(2.305±0.113),中药组为(1.474±0.292),从条带灰度值及相对蛋白灰度比值上看,与空白组比较,模型组大鼠卵巢组织中TLR-4蛋白表达水平显著上调(P<0.01),中药组卵巢组织中TLR-4蛋白表达水平较模型组大鼠显著下调(P<0.01)。具体见图3。
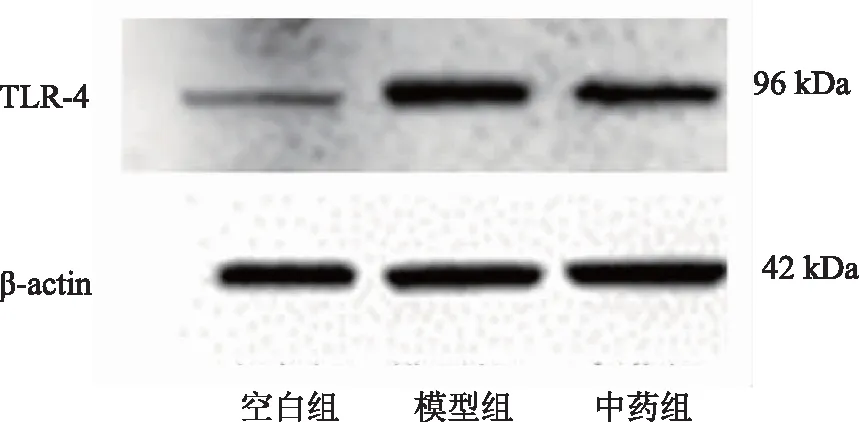
图3 各组大鼠卵巢组织中TLR-4蛋白表达水平
3 讨论
PCOS发病率日益升高,国外育龄期女性中约6%~20%会受到PCOS的影响[6],我国育龄期妇女中PCOS发病率也达到7.1%~11.2%[7]。PCOS患者因雄激素升高及糖脂代谢紊乱,继而出现一系列生理症状及外貌变化,加之不孕带来的家庭压力等社会因素,其心理健康及生活质量受到严重影响。本课题组前期已通过临床实验[1]和大鼠实验[8]证实,中药方剂归术益坤方对于此病的治疗疗效显著。近年来,对于PCOS的诊治和研究范畴已经远也涉及代谢性疾病、心血管疾病、肿瘤等多个方面,肠道菌群(gut microbiota,GM)及其代谢产物LPS、短链脂肪酸等逐渐被发现和PCOS的发病关系密切[9]。
肠道菌群是肠道微生态系统核心部分。正常情况下,人体肠道菌群处于动态平衡状态。但PCOS患者肠道菌群α多样性降低,同时肠道菌群整体丰度降低[10-11]。肠道菌群丰度降低会表现出明显的炎症反应,相关炎症因子水平更高[12-14]。LPS是肠道菌群的主要代谢产物之一,主要存在于革兰氏阴性菌细胞外膜层,也是细菌的内毒素,机体血清LPS升高,这种现象被称为“代谢性内毒素血症”[15]。LPS也被认为参于到PCOS的发生过程中。
3.1 模型评价
本研究中采用来曲唑建立PCOS大鼠模型,在造模前,空白组和PCOS组大鼠体质量、Lee’s指数均无明显差异,经过连续21天来曲唑给药,模型组和中药组大鼠体质量显著上升,动情周期明显紊乱,同时模型组大鼠血清睾酮、空腹血糖明显上升,双侧卵巢有不同程度的体积重量增加,卵巢切片也可看见多个小卵泡,HE染色后卵巢病理切片也可以观察到明显多于空白组大鼠卵巢组织的未成熟卵泡,未见优势卵泡及黄体,卵泡大小明显减小的同时可见闭锁卵泡,可以判断PCOS大鼠模型建立成功。
从机制相关研究结果显示,模型组大鼠血清LPS高于空白组,TLR-4蛋白表达也较空白组明显上调,同时模型组大鼠血清IL -6、IL-18和TNF-α显著高于空白组,这说明本研究中模型组大鼠机体处于慢性炎症状态。有学者认为PCOS肠道菌群变化[16],是菌群内过多的LPS透过肠上皮入血,血循环中内皮细胞及脂肪细胞等可识别并摄取LPS,与LPS结合蛋白结合,激活CD14受体,三者形成的复合物与TLR4结合[17-18],从而激活核转录因子-κB(nuclear factor kappa-B,NF-κB)和激活蛋白-1(activator protein-1,AP-1),进一步介导TNF-α和促炎因子产生,在脂肪组织及肝脏等组织中引起IL-6[19]、IL-18[20]等炎症因子的释放,造成慢性低水平炎症。炎症因子参于到糖脂代谢的过程中,引发胰岛素抵抗等效应[21],最终可出现代谢紊乱并加重高雄激素血症。
3.2 中药作用评价
在本研究中,中药组大鼠体质量较模型组显著下降,并恢复正常动情周期,同时卵巢HE染色切片可以观察到明确区别于模型组小卵泡的优势卵泡和黄体,并且中药组大鼠右卵巢体积较模型组而言有所下降。从各组血清睾酮、空腹血糖数值比较上看,归术益坤方对于PCOS大鼠有显著的降雄激素、降糖作用。由此可以得出结论,归术益坤方可以降低PCOS大鼠体质量,促进其恢复卵巢功能,帮助其规律排卵,降低其雄激素水平和空腹血糖水平,对于PCOS大鼠治疗效果良好。
与此同时,给药结束后,中药组大鼠血清中LPS水平较模型组明显下降,伴随炎症因子IL-18随之下降,这提示,归术益坤方可以降低血清LPS水平,下调体内慢性炎症水平。现代药理研究显示,归术益坤方中部分中药具有抗炎的作用。有实验人员利用LSP引发小鼠炎症反应后,加入部分茜草化学成分后,炎症状态得到缓解[22]。除茜草外,浙贝也被证实,具有良好的抗菌、抗炎的作用[23]。杨新铭等[24]用来曲唑联合LPS成功建立了PCOS肾虚血瘀大鼠模型,他认为内毒素血症对应中医“热邪”“毒邪”范畴。从归术益坤方配伍上看,归术益坤方中车前子利湿行水,当归、茜草入血分化瘀通利,配以浙贝母清热化痰散结,配以其它补肾健脾药物,既能给邪以出路,又可补虚扶正,标本兼治,PCOS大鼠体内浊热可除,LPS水平下降,炎症缓解,代谢异常、排卵异常得到改善。
3.3 创新点
本实验通过来曲唑建立了PCOS大鼠模型,并成功证实,归术益坤方对于来曲唑诱导的PCOS大鼠有明显的治疗作用,可以降低PCOS大鼠体质量,促进其恢复卵巢功能,帮助其规律排卵,降低其雄激素和空腹血糖水平,此过程可能是通过调控LPS/TLR4通路,下调LPS,降低大鼠体内相关炎性因子,减轻PCOS大鼠体内慢性炎症程度,降低雄激素水平,调整动情周期,最终改善卵巢多卵泡状态。为临床中治疗PCOS提供了基础实验支持,也提供了新的角度和靶点,为今后从肠道菌群及其代谢产物入手探究PCOS发病及治疗机制奠定了基础。
3.4 不足与展望
本实验各组例数太少,血清标本不足,仅在肠道菌群代谢产物LPS及其相应通路上进行了研究,同时由于课题组在粪便取样方面缺乏经验及其它不可抗因素,未能继续比较各组大鼠肠道菌群的差异,未能研究归术益坤方对于PCOS大鼠肠道菌群的影响,后续实验可采用粪菌移植实验,深入研究诱发LPS/TLR-4信号通路的菌群结构及归术益坤方在治疗PCOS过程中对于菌群产生了何种作用。

