皖南黑猪不同生长阶段血清免疫指标及肠道菌群的特征分析
郑先瑞,卓明雪,纪金丽,蒋维虎,邓在双,张吉成,田雅莉,丁月云,张晓东,殷宗俊*
(1.安徽农业大学动物科技学院,合肥 230036;2.地方畜禽遗传资源保护与生物育种安徽省重点实验室,安徽 合肥 230036)
动物胃肠道中含有种类繁多、数量巨大的微生物菌群。研究表明,哺乳动物胃肠道的微生物群,大约由1014个菌种组成[1],这些微生物菌群与动物体相互影响、相互依存、相互作用,构成了动物体的肠道微生态系统。
皖南黑猪是国家级保护品种(https://www.cdad-is.org.cn/admin/Login/index.html),具有耐粗饲、肉质鲜美、繁殖力强、早熟迟衰、产仔数多等优点。但与引进杂交猪品系相比,存在生长速度缓慢、瘦肉率低等问题,影响这些问题的因素主要为遗传、饲料、环境、饲养管理等,而这些因素也正是影响肠道菌群的重要原因[2]。Tan等[3]对育肥期高、低饲料利用率猪个体间肠道菌群进行了比较分析,发现肠道微生物在菌属水平上表现出差异,这些差异菌属可作为区分饲料效率差异的生物标记物,说明通过调控肠道微生物组来提高猪育肥期的生长性能可能是一种可行的策略。断奶期间的高发病率(如腹泻)和死亡率,与肠道微生物组失衡有关[4],通过益生菌调节猪肠道微生物组以保持健康的微生物组是预防病原体和促进有益细菌丰度的一种有效手段[5]。郭晓红等[6]研究表明,仔猪结肠微生物菌群结构与组成在不同品种、不同生长发育阶段均存在显著差异,对仔猪免疫性能具有重要作用。曹志鹏等[7]研究表明,藏仔猪粪便微生物菌群结构在不同生长发育阶段存在差异,随着藏仔猪的生长,其对营养物质的降解能力和肠道免疫能力提高。综上所述,猪肠道微生物是动态变化的,且肠道微生物组与猪关键生长阶段的健康状况和生产性能之间密切相关。尽管前人研究极大地扩展了人们对猪肠道微生物组的理解,但肠道微生物多样性在皖南黑猪这一优良地方猪品种的不同生长阶段是如何变化的?不同生长时期优势菌群和主要功能菌群的具体作用是什么?目前尚未见相关的研究报道,且多项研究证实,通过将地方猪种粪菌移植到商品猪种体内可以使受试猪种表现出与供体猪种相似的肠道微生物区系及表型性状[8],说明了研究地方猪肠道微生物多样性具有理论及实践意义。
因此,本研究采集哺乳期、保育期和育肥期皖南黑猪的粪便及血液样本,通过分析不同阶段皖南黑猪肠道微生物和血清免疫指标的纵向变化,以期初步揭示皖南黑猪肠道微生物多样性及其与生长发育的相关性,挖掘目的菌群在猪抗病力及生长发育等方面的作用,对后期提高皖南黑猪机体健康水平和提升畜产品质量具有重要意义。
1 材料与方法
1.1 试验设计与样本采集
试验猪由安徽省广德市三溪生态农业有限公司提供。选取同品种、体重和日龄相近的纯种健康皖南黑猪母猪,在相同的环境条件及饲养管理下,根据不同的生长阶段选择相应的饲粮进行饲喂,本研究中的试验猪从出生至试验结束均未接受抗生素治疗。
本试验在哺乳期(P,20 d)、保育期(B,60 d)和育肥期(Y,120 d)3个不同生长阶段分别筛选出9头体重和体型基本一致的个体猪进行粪便的采集,取粪便中心位置,混匀后放入5 mL冻存管,立即投入液氮罐,运回实验室及时提取样品DNA,共计27头。同时对3个不同生长阶段的猪进行颈部采血,采集后的血液置于10 mL非抗凝采血管中低温保存,采集后的血液样本放入低速离心机中,3 500 r·min-1离心10 min,吸取血清于新的离心管中,-20 ℃保存备用。
1.2 血清生化指标检测
将保存的血清样本取出后,分别购买相应的ELISA试剂盒(上海酶联生物科技有限公司),通过Synergy H1/H1MFD多功能酶标仪(BioTek,美国)检测血清中的免疫球蛋白M(IgM)、免疫球蛋白G(IgG)、免疫球蛋白A(IgA)、内毒素(LPS)和白细胞介素6(IL-6)的含量。
1.3 样品总DNA提取和16S rRNA基因测序分析
使用OMEGA Soil DNA Kit(D5625-01,美国)试剂盒提取粪便样品DNA,并通过分光光度计及琼脂糖凝胶电泳方法检测DNA纯度、浓度及质量。对质检合格的样本构建目标区域PCR体系并进行纯化,利用特异性引物338F (5′-ACTCCTACGGGAGGCAGCA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)对细菌16S rRNA基因的V3和V4区进行PCR扩增。扩增产物使用2%琼脂糖凝胶电泳进行检测,再使用AxyPrep DNA凝胶回收试剂盒(Axygen Biosciences,美国)回收目的片段。利用Ouant-iT PicoGreen dsDNA Assay Kit对纯化后的PCR产物在Microplate reader(BioTekFLx800)上进行定量,然后按照每个样品所需的数据量进行混样。测序工作由上海派森诺生物科技股份有限公司协助完成。首先利用Illumina公司的TruSeg Nano DNA LT Library Prep Kit进行建库,然后将质检合格的文库在通过Illumina NovaSeg平台进行2×250bp双端测序。
1.4 微生物多样性、组成和物种差异性分析
使用DADA2[9]方法对测序得到的原始数据(input)进行去引物、质量过滤、去噪(denoise)、拼接和去嵌合体,得到用于后续分析的数据。以100%相似度聚类,产生的每个去重的序列称为ASVs(amplicon sequence variants, ASVs)。采用QIIME2(version 2019.4)软件[10]的classify-sklearn算法(https://github.com/QIIME2/q2-feature-classifier)和Silva[11]数据库(Release132, http://www.arb-silva.de)的默认参数及预先训练好的Naive Bayes分类器对每个ASVs的特征序列进行物种分类注释。基于ASVs表分析结果,使用QIIME2(version 2 019.4)软件、R语言中的ggplot2作图软件包统计个样品在97%相似度水平下的Chao1、Observed specides、Shannon、Simpson和Coverage指数。通过分析物种稀疏曲线判断测序深度的合理性。使用R语言软件对皖南黑猪粪便菌群在门和属水平进行物种组成及PCoA分析。使用Python LEfSe包、R语言中的ggtree软件包等进行LEfSe(LDA effect size)分析,获得皖南黑猪不同发育阶段产生显著影响的微生物菌属。
1.5 猪肠道菌群与血清指标的关联分析
使用R软件GGally包对血清免疫指标与肠道差异菌属进行关联分析。通过计算环境因子与所选菌属之间的Spearman等级相关系数,将获得的数值通过ComplexHeatmap包进行热图可视化。
1.6 数据的统计分析
统计分析试验数据先经Excel统计,使用IBM SPSS Statistics(v26.0)软件对不同日龄间血清免疫指标进行单因素方差分析。数据用“平均值±标准差”表示,P<0.05表示差异显著,P>0.05表示差异不显著。
2 结 果
2.1 猪不同生长阶段血清免疫指标分析
血清检测结果发现,血清中某些免疫指标随着日龄的增加而发生显著变化,如图1所示,血清中LPS与IL-6在哺乳期浓度相对较高,在育肥期浓度相对最低。仔猪哺乳期LPS浓度极显著高于保育期和育肥期(P<0.01);血清中IL-6浓度则是随着仔猪日龄的增加而出现逐渐降低的趋势,其中哺乳期IL-6浓度极显著高于育肥期(P<0.01),保育期IL-6浓度显著高于育肥期(P<0.05)。此外,在仔猪生长过程中,血清中IgA、IgG浓度则是呈现先升高后降低的趋势,两者均在保育阶段达到高峰期,其中IgG在哺乳期浓度较低,极显著低于保育期(P<0.01)。血清中的IgM浓度则随着仔猪的生长呈现逐渐上升的趋势,各阶段IgM浓度差异不显著。综上分析,皖南黑猪在生长发育过程中,机体的免疫水平会随着日龄等因素的改变而发生相应变化。
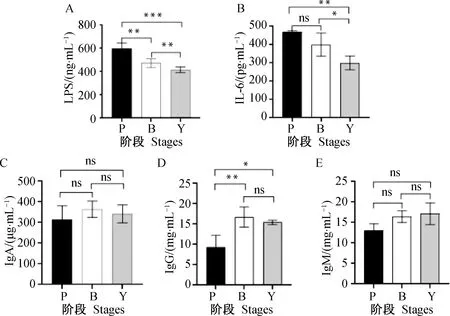
A. LPS含量;B. IL-6含量;C. IgA含量;D. IgG含量;E. IgM含量。ns. 差异不显著(P>0.05);*.差异显著(P<0.05);**、***. 差异极显著(P<0.01、P<0.001)。P、B、Y分别代表哺乳期、保育期和育肥期。下同A. LPS content; B. IL-6 content; C. IgA content; D. IgG content; E. IgM content. ns. No significant difference (P>0.05); *(P<0.05), ** and ***(P<0.01) indicate significant difference among different stages. P, B and Y represent the lactation period, nursery period and fattening period, respectively. The same as below 图1 不同阶段皖南黑猪各项血清免疫指标柱状图Fig.1 Histogram of serum indices for Wannan Black pig at different stages
2.2 16S rRNA测序质量评估
基于ASVs(amplicon sequence variants)水平进行稀释曲线分析,通过Shannon稀释曲线如(图2A)和Chao1稀释曲线如(图2B)结果表明,稀释曲线趋向平缓并最终达到平台期,说明此次测序深度达到研究标准,测序结果能充分反映当前样本所包含的多样性,样品测序深度能覆盖肠道中的大部分菌种,结果可用于后续数据分析。
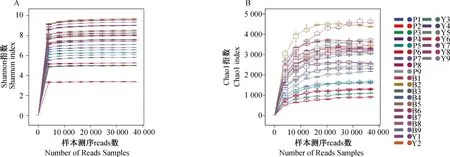
图2 27个样品Shannon稀释曲线图(A)和Chao1 稀释曲线图(B)Fig.2 Shannon dilution curve (A) and Chao1 dilution curve (B) for 27 samples
2.3 菌群聚类分析
本研究共采集3个不同生长阶段共27头皖南黑猪粪便样本,通过分析各样品ASVs的共有情况,从而鉴定出不同日龄皖南黑猪的主要微生物菌群。如图3所示,三组共有的ASVs有781个。哺乳期、保育期及育肥期特有的ASVs分别为7 221个、14 101个及12 311个。
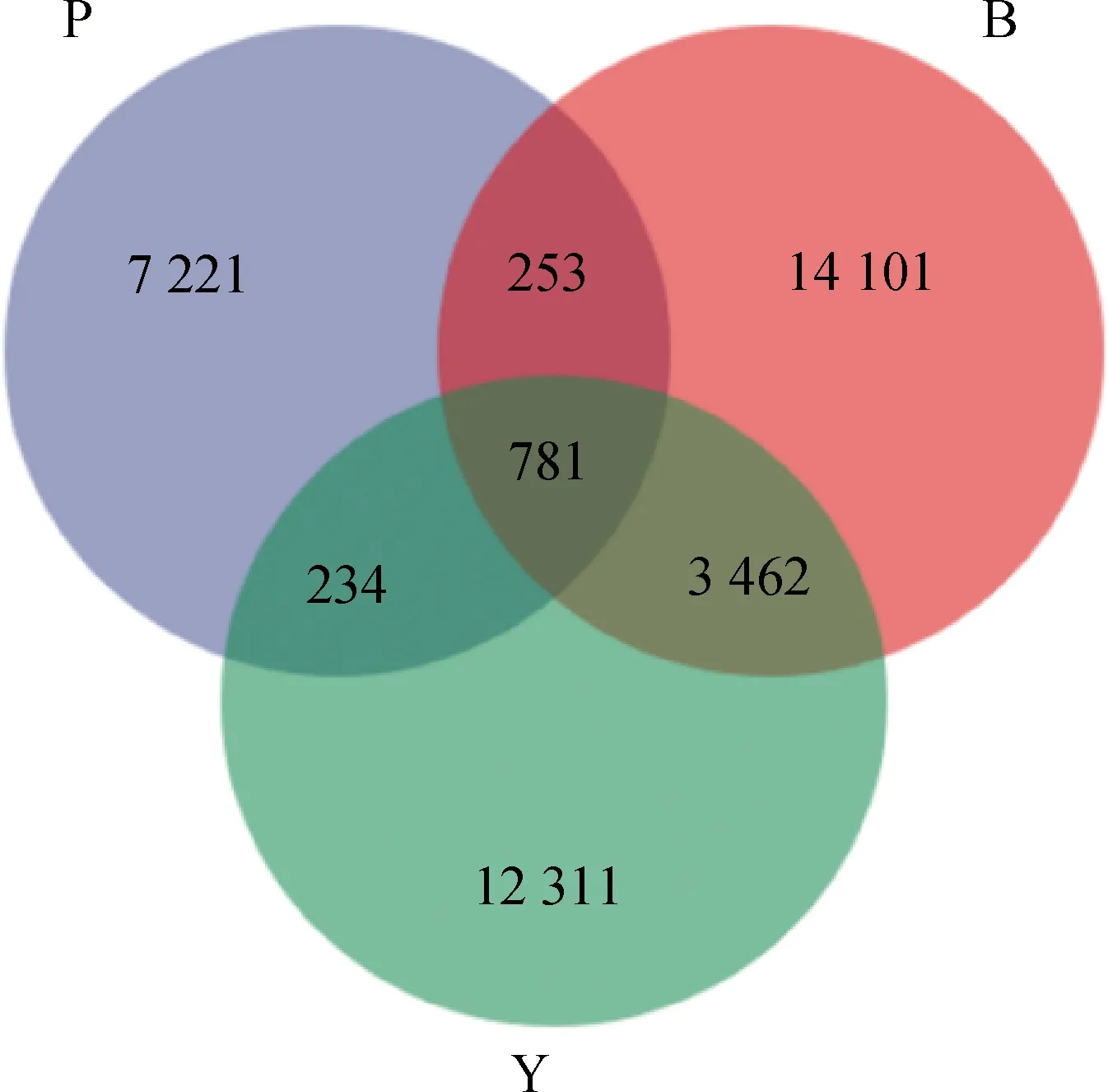
图3 ASVs韦恩图Fig.3 ASVs Venn diagram
2.4 不同日龄皖南黑猪肠道菌群组成分析
根据分类学结果如(图4)所示,在门水平上共检测到22个核心菌门,其中哺乳期、保育期和育肥期分别鉴别到15、19和18个核心门水平菌。通过不同阶段猪肠道微生物菌群在门水平中的分布情况,发现哺乳期肠道中的优势菌门为Firmicutes、Bacteroidetes、Actinobacteria和Fusobacter,其中Actinobacteria和Fusobacter是哺乳期的特有菌门。通过对不同日龄间在门水平上的聚类情况进行分析(图5),发现保育期和育肥期猪肠道菌群结构存在交叉现象,说明保育期和育肥期的肠道菌群在门水平上其组成及丰度相似度较高。保育期和育肥期的优势菌门均为Firmicutes、Bacteroidetes和Spirochaetes,其中Spirochaetes在哺乳期结束后大量定植。

图4 不同阶段肠道菌群门水平柱状分布图Fig.4 Horizontal columnar distribution of intestinal flora at phylum level during different stages

图5 不同阶段间肠道菌群门水平层次聚类分析图Fig.5 Cluster analysis diagram of intestinal flora at phylum level during different stages
在门水平菌群丰富度方面,各阶段肠道菌群均以Firmicutes和Bacteroidetes为优势菌门,其中在哺乳期平均丰度值分别为65.3%、10.5%,在保育期平均丰度值分别为84.4%、10.9%,在育肥期平均丰度值分别为87.4%、8.5%。此外,Proteobacteria在哺乳期平均丰度值为4.41%,显著高于其他生长阶段(保育期:0.62%,育肥期:0.20%)。由此可以看出,Firmicutes的丰度值随着猪日龄增长而逐渐升高,而Proteobacteria丰度值则随着猪日龄增长而显著下降。
在属水平上共检测到51个核心菌属,其中哺乳期、保育期和育肥期分别鉴别到44、49和49个核心属水平菌,其中筛选出前20的显著菌属进行展示。如图6所示,哺乳期的优势菌属为Lactobacillus、Shigella和Faecalibacterium。通过对不同日龄间在属水平上的聚类情况进行分析,结果如图7,发现保育期和育肥期的菌群在属水平上其组成及丰度仍相近,保育期和育肥期的优势菌属均以Lactobacillus、Oscillospira和Treponema为主。

图6 不同阶段肠道菌群属水平柱状分布图Fig.6 Horizontal columnar distribution of intestinal flora at genus level during different stages
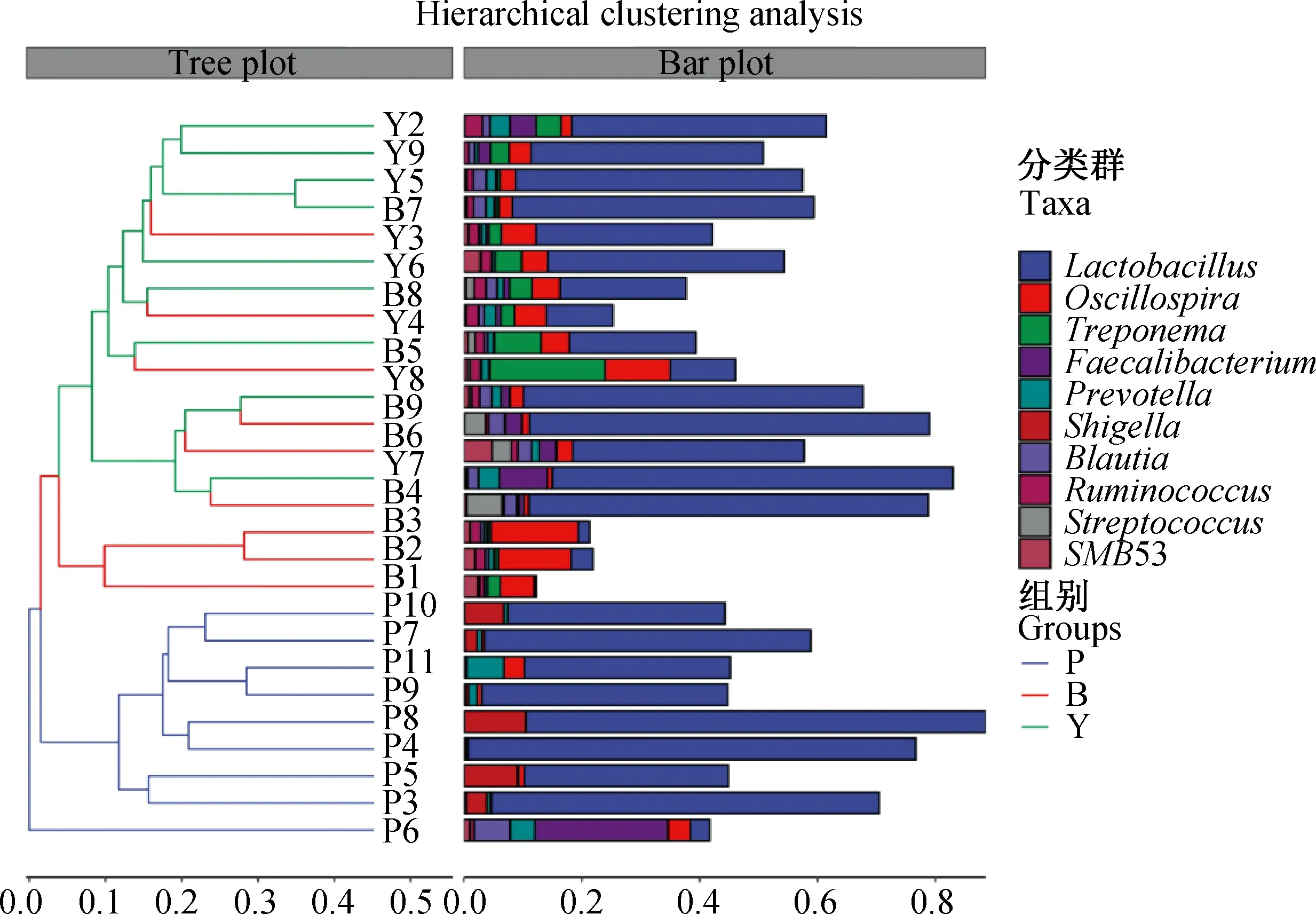
图7 不同阶段间肠道菌群属水平层次聚类分析图Fig.7 Cluster analysis diagram of intestinal flora at genus level during different stages
在属水平菌群丰富度方面,各阶段肠道菌群均以Lactobacillus为优势菌属,Lactobacillus在哺乳期丰度为47.38%,在保育猪丰度为25.92%,在育肥猪丰度为43.47%。此外,在哺乳猪肠道中相对丰度>2%的菌属有Lactobacillus、Shigella、Faecalibacterium和Bacteroides,在保育猪肠道中相对丰度>2%的菌属有Lactobacillus、Oscillospira和Treponema,在育肥猪肠道中相对丰度>2%的菌属有Lactobacillus、Oscillospira、Treponema和Faecalibacterium。
根据不同日龄肠道菌群在属水平上的组成差异,结果发现哺乳期猪肠道中的Lactobacillus和Faecalibacterium含量高于保育期和育肥期,保育猪肠道中的Oscillospira和Streptococcus含量高于哺乳期和育肥期,育肥猪肠道中的Prevotella和Blautia含量略高于哺乳期和保育期。此外,Shigella和Bacteroides在哺乳期出现,属于哺乳期的次要优势菌属。Treponema、Ruminococcaceae-Ruminococcus、Streptococcus、Coprococcus、SMB53、Dorea和芽殖菌属(Gemmiger)在仔猪断奶后开始大量定植。
2.5 皖南黑猪肠道微生物多样性分析
通过Alpha多样性分析结果如(图8),在哺乳期、保育期和育肥期三个不同生长阶段,其覆盖率Coverage指数分别在98.88%、98.21%和98.05%,说明本次测序覆盖了样品中所包含98%以上的物种。在Chao1指数方面,哺乳期相较最低,保育期和育肥期肠道菌群物种数最为相近,均与哺乳期存在极显著差异(P<0.01)。在Observed specides丰富度指数方面,哺乳期与保育期存在极显著差异(P<0.001),与育肥期存在极显著差异(P<0.01)。在Shannon和Simpson多样性方面,保育期菌群多样性指数最高,其次为育肥期。通过Shannon指数发现,哺乳期与保育期存在极显著差异(P<0.001),与育肥期存在极显著差异(P<0.01)。在Simpson指数方面,哺乳期与保育期存在显著差异性(P<0.05)。综上得出,保育期和育肥期菌群丰度及多样性方面最为接近,而哺乳期与之相比相对较低。
根据PCoA结果显示如(图9A),肠道菌群在三个生长阶段发生了显著变化。哺乳期肠道菌群明显单独聚为一类,其各样本间距离较小,整体分布较为集中,说明在哺乳期各样本间肠道菌群的组内差距不大。保育期及育肥期各样本间距离较远且分布较疏散,说明保育期各样本间肠道菌群的组内存在较大差异。但可看出保育期及育肥期肠道菌群组成相似且聚在一起,而与哺乳期肠道菌群没有交叠,说明它们与哺乳期肠道菌群差距较大。

图9 肠道菌群的PCoA分析图(A)和NMDS分析图(B)Fig.9 PCoA analysis diagram (A) and NMDS analysis diagram (B) of intestinal flora
通过NMDS分析结果如(图9B),哺乳期样本间微生物群落的差异最小,随着日龄的增加,同样可看出,保育期和育肥期肠道菌群组成有交叠,说明组间差异小,而与哺乳期组间差异较大。
2.6 不同日龄皖南黑猪肠道菌群差异性分析
为准确分析皖南黑猪不同日龄肠道的特定微生物分类群,本研究利用LEfSe分析法来反映样本组之间特异性细菌类群的富集情况。结果表明,不同日龄间共存在100个组间差异核心菌群,其中45个在哺乳期中富集,34个在保育期中富集,21个在育肥期中富集。通过分支图(图10)可以看出哺乳期的差异项明显多于保育期及育肥期。根据LDA分析结果如(图11),哺乳期丰度差异显著的菌群主要有放线菌(Actinobacteria)、红椿菌目(Coriobacteriales)、红椿菌科(Coriobacteriaceae)、红蝽菌纲(Coriobacteriia)、梭菌属科(Fusobacteriaceae)、梭杆菌属(Fusobacteria)、梭菌属目(Fusobacteriales)、Proteobacteria、肠杆菌科(Enterobacteriaceae)、Shigella、Faecalibacterium、拟杆菌科(Bacteroidaceae)、Bacteroides等45个特异性菌群;保育期丰度差异显著的菌群主要有Clostridia、Clostridiales、瘤胃球菌科(Ruminococcaceae)、Oscillospira、克里斯滕森菌科(Christensenellaceae)、梭菌科(Clostridiaceae)、螺旋体门(Spirochaetes)、螺旋体目(Spirochaetales)、螺旋体科(Spirochaetaceae)、Treponema、链球菌科(Streptococcaceae)、Streptococcus等34个特异性菌群;与育肥期丰度差异相关的菌群主要有Firmicutes、Ruminococcaceae-Ruminococcus、毛颤菌科(Lachnospiraceae)、隐球菌(Anaerofustis)、Coprococcus等21个特异性菌群。
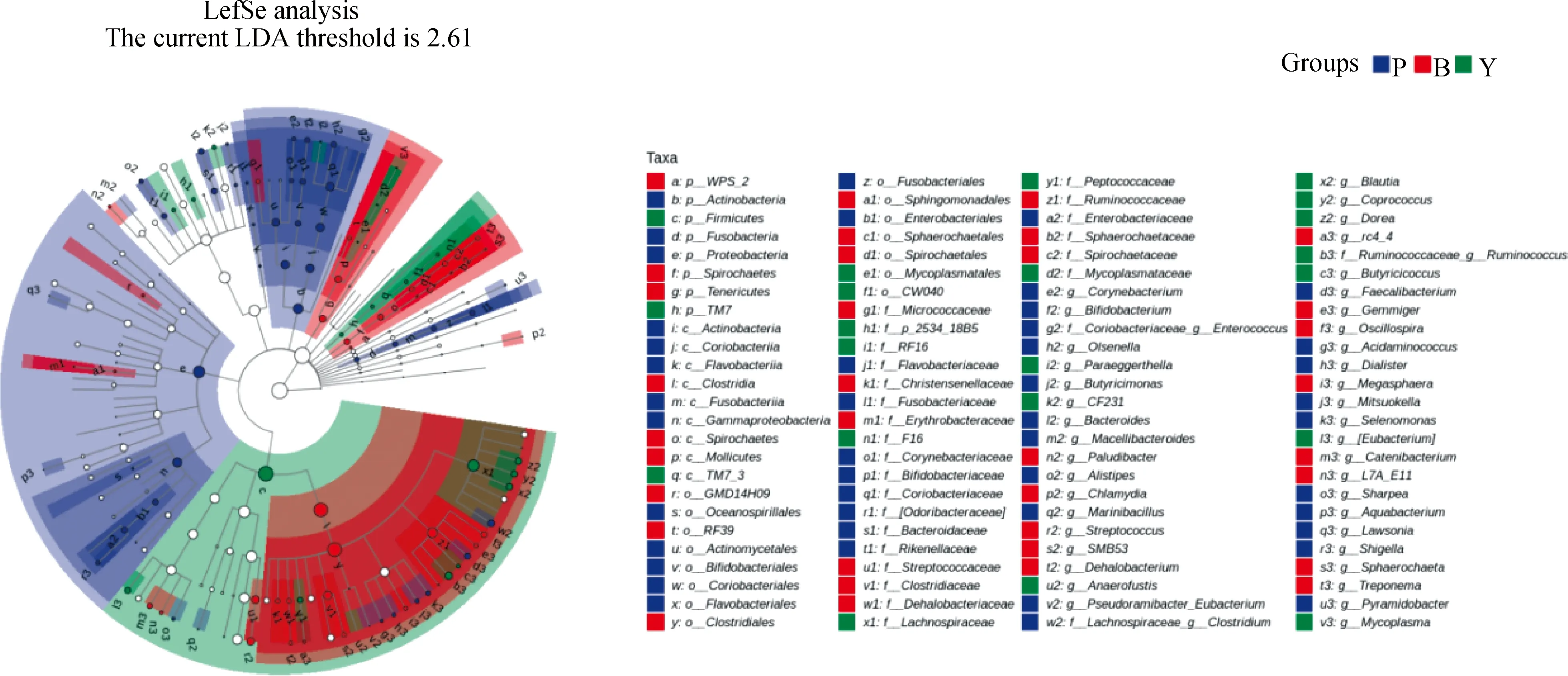
图10 不同阶段肠道菌群物种差异进化分支图Fig.10 Different evolutionary clades of intestinal flora species at different stages

图11 不同阶段差异物种LDA值分布柱状图Fig.11 Histogram of LDA value distribution of different species at different stages
2.7 肠道菌群与血清指标的关联分析
本研究基于高通量测序技术及多变量统计学方法找出与宿主免疫力密切相关的肠道菌群,通过对丰度前30的肠道菌属与血清指标进行相关性分析发现,血清中的LPS、IL-6、IgA、IgG、IgM浓度均与猪肠道菌群存在相关性。
通过对不同生长阶段肠道菌群与血清免疫细胞的相关性热图分析(图12)发现,与LPS浓度密切相关的菌种有7个,其中Shigella与LPS浓度呈极显著正相关(P<0.01),Bifidobacterium和Campylobacteri与LPS浓度呈显著正相关(P<0.05),Prevotella、Ruminococcus和Eubacterium与LPS浓度呈极显著负相关(P<0.01),Dorea与LPS浓度呈显著负相关(P<0.05)。与IL-6浓度密切相关的菌种有5个,其中Shigella与IL-6浓度呈极显著正相关(P<0.01),Bacteroides与IL-6浓度呈显著正相关(P<0.05),Prevotella和Catenibacterium与IL-6浓度呈极显著负相关(P<0.01),Faecalibacterium与IL-6浓度呈显著负相关(P<0.05)。

*表示显著性差异(P<0.05);**表示极显著差异(P<0.01)* and ** indicate significant difference among different stages (*P<0.05; **P<0.01 )图12 肠道菌群与血清指标相关性热图Fig.12 Heat map of correlation between intestinal flora and serum indices
此外,通过对肠道菌群与血清免疫蛋白相关性分析发现,与IgA密切相关的菌种有7个,其中Dorea、Butyricicoccus和Coprococcus与IgA浓度呈显著正相关(P<0.05)。Butyricimonas与IgA浓度呈极显著负相关(P<0.01),Megasphaera、三角藻属(Mitsuokella)和Bacteroides与IgA浓度呈显著负相关(P<0.05)。与IgG浓度密切相关的菌种有16个,其中Dorea与IgG浓度呈极显著正相关(P<0.01),Ruminococcus、Butyricicoccus、Treponema、Streptococcus、Eubacterium和Coprococcus与IgG浓度呈显著正相关(P<0.05),另枝菌属(Alistipes)和Butyricimonas与IgG浓度呈极显著负相关(P<0.01),Olsenella、Megasphaera、Bifidobacterium、夏普氏菌属(Sharpea)、毛螺菌科_梭菌属(Lachnospiraceae_Clostridium)、Mitsuokella和Bacteroides与IgG浓度呈显著负相关(P<0.05)。与IgM浓度密切相关的菌种有11个,其中Catenibacterium和Faecalibacterium与IgM浓度呈极显著正相关(P<0.01),Prevotella、Blautia、Ruminococcaceae_uminococcus、Gemmiger和Oribacterium与IgM浓度呈显著正相关(P<0.05),Bifidobacterium、Sharpea、Bacteroides和Mitsuokella与IgM浓度呈显著负相关(P<0.05)。
3 讨 论
肠道微生物影响宿主的生长、新陈代谢和免疫功能[12-13]。粪便微生物可以反映肠道微生物的组成,且越来越多研究者通过新鲜粪便的微生物组成来研究肠道微生物区系[14]。本研究通过Illumina NovaSeq测序平台对皖南黑猪不同生长阶段的肠道微生物测序分析发现其多样性十分丰富,并通过物种差异分析揭示了不同阶段的优势菌群,将本研究结果与前人肠道微生物相关研究进行了深入比较分析。Firmicutes和Bacteroidetes是皖南黑猪的主要优势菌门,与前人猪肠道微生物的相关研究结论是一致的[15-17],Lim等[18]揭示猪肠道菌群多样性的演变是与年龄成正相关,郭晓红等[6]揭示了仔猪的肠道菌群也是随着年龄变化的。皖南黑猪不同日龄的肠道菌群相互关联,物种间的演变也是共同进化,这与前人的研究结果类似[7,19]。以上都说明了本研究结果是可靠的,可以为肠道微生物的研究及我国地方猪的优良特性挖掘提供参考。
随着仔猪的生长发育,不同日龄肠道微生物的丰度也会随之发生变化,这与猪不同生长阶段的生理特性是对应的[20]。本研究中,Firmicutes的丰度随着猪日龄的增长而逐渐升高,而Proteobacteria的丰度则随着猪日龄增长出现显著下降。有关文献报道,Firmicutes与脂肪沉积存在相关性,而Proteobacteria与蛋白质发酵存在关联[21-23]。由此推测,可能是皖南黑猪哺乳期高蛋白的摄入造就了肠道中高丰度的Proteobacteria,而断奶后饲料成分及机体生长发育的影响则加速了Firmicutes的定植。Firmicutes能有效吸收食物中的热量,进而加快脂肪沉积,育肥期肠道内Firmicutes的出现可能与机体生长性能有关[24]。Lactobacillus是皖南黑猪的主要优势菌属。有研究报道,Lactobacillus在调节机体免疫系统,增强肠道功能代谢以及维持肠道微生物菌群平衡方面存在一定的潜力[25]。本研究发现,当仔猪断奶后肠道内的Lactobacillus出现些微下降,但随着保育期饲养结束后,肠道中的Lactobacillus又出现些许升高,这可能由于从哺乳期到育肥期的生长过渡期间,仔猪的采食方式由原先的吮吸母乳转变为较难消化吸收的固态颗粒饲料,而肠道菌群在此阶段还未建立完善所致[26]。
本研究中,特异性菌群主要有Actinobacteria、Coriobacteriaceae、Fusobacteriaceae、Fusobacteria、Proteobacteria、Enterobacteriaceae和Shigella。有研究提示,当肠道中Actinobacteria丰度越高,则越有利于脂肪的沉积[27]。Mccormack等[5]研究也发现,猪肠道中的Actinobacteria丰度与饲料利用率高低存在关联。早先研究报道,Fusobacteria是宿主体内的共生菌,能够维持结肠上皮组织的动态平衡[28]。而哺乳期Enterobacteriaceae的出现可能是母乳中Enterococcus的菌株从母体转移到子体所致[29]。此外,有文献报道,高丰度的Proteobacteria会使肠道菌群出现失调现象,进而引发猪肠道菌群的炎症[30]。而Shigella与Proteobacteria作为肠道致病菌,容易引起仔猪腹泻不利于仔猪健康生长[31]。有报道发现,Clostridia、Clostridiales都是和宿主免疫相关的菌群[32-33]。而本研究发现,Oscillospira、Christensenellaceae作为益生菌在保育期出现,这可能与该阶段猪自身免疫功能开始增强,肠道内环境逐渐趋向均衡有关。张冬杰等[34]研究发现,饲粮中粗纤维的含量将直接引起Treponema的变化,本研究中保育阶段肠道内出现的Treponema则很有可能与饲料中粗纤维含量有关[35]。育肥期出现了较多的益生菌,如Ruminococcus、Lachnospiraceae和Coprococcus,而这些有益菌在维持肠道健康方面发挥重要作用[36]。
研究报道,猪体内最大的黏膜免疫器官是肠道黏膜,而肠道黏膜细胞内分泌最多的免疫球蛋白多以IgA、IgG和IgM为主[37]。本研究发现,Dorea、Butyricicoccus和Coprococcus与血清中的IgA、IgG浓度均存在显著相关性。据研究报道,Coprococcus可以协助短链脂肪酸的产生,进而间接地起到抗炎、保护肠屏障功能等作用[38]。此外,Ruminococcaceae-Ruminococcus、Treponema、Streptococcus和Eubacterium也与IgG浓度存在显著相关性,Catenibacterium、Faecalibacterium、Prevotella和Blautia与IgM浓度存在显著相关性。研究表明,Ruminococcus、Treponema、Prevotella、Eubacterium和Blautia都是短链脂肪酸产生菌,其能够直接或间接地起到抗炎、保护肠道屏障功能和免疫等作用[39]。本研究结果显示,与血清中的IgA、IgG、IgM浓度存在显著正相关的菌群多达17个,皖南黑猪不同生长阶段血清中的IgA、IgG、IgM 浓度在机体中的水平不尽相同,保育期和育肥期整体水平波动不大,而哺乳期相对略低,说明仔猪断奶后肠道菌群在抗炎症及机体抵抗力方面都相应的有所提升,这也在一定程度上验证了猪肠道菌群可以影响宿主的生长性状及健康状况。
4 结 论
本研究以中国优良地方猪皖南黑猪为研究对象,利用16S rDNA测序方法,探讨了哺乳期、保育期及育肥期皖南黑猪肠道微生物的变化。皖南黑猪粪便菌群以拟杆菌门和厚壁菌门为主,且随日龄增长呈逐渐增高的趋势,在保育期达到最高值,随后在育肥期趋向稳定,此外,皖南黑猪粪便中的有益菌在断奶后开始增多。血清中免疫生化指标LPS、IL-6、IgA、IgG、IgM浓度均与猪肠道菌群存在相关性,其中LPS和IL-6浓度在哺乳期最高,IgA、IgG浓度在保育期达到峰值,IgM浓度在育肥期最高。差异菌群(属水平)和免疫因子之间的相互作用可能也是影响皖南黑猪生长发育的重要因素之一。本研究揭示的皖南黑猪的肠道微生物菌群及不同阶段的优势菌群,可为深入理解猪不同阶段的生理特性、挖掘地方猪的优良特性及生产管理提供一定的理论参考。

