高强度间歇运动改善定量负荷运动心率效果的全基因组关联分析及预测模型构建
杨晓琳 李燕春 包大鹏 梅涛 周多奇 乌云格日勒 聂晶 夏小慧 张之豪顾壮壮 何子红
1 北京体育大学(北京 100084)
2 国家体育总局体育科学研究所(北京 100061)
3 安庆师范大学(安庆 246133) 4 内蒙古师范大学(呼和浩特 010022)
5 江西师范大学(南昌 330022) 6 兰州城市学院(兰州 730070)
身体活动不足已成为威胁健康的重要因素[1,2],提高身体活动水平、增加有氧运动是提高心肺耐力预防慢性病的有效方式[3,4]。但标准化运动干预后,不同健康评估指标均存在一定比例的无效受试者[5,6],而目前仍无切实有效的方法提前预测运动效果,根据参与者的健身目的,制定个体化的运动健身方案,提高运动健身的有效性,使其有“方”可依。
心率(heart rate,HR)是运动健身中无创且易得的监控指标。安静心率、运动中心率增加、运动后心率的恢复以及递增负荷运动时间是全因死亡发生的预测因子[7],安静心率的增加与全因死亡率和心血管死亡率风险增加显著相关[8],无心脏疾病的成年人心率与全因死亡率和心血管事件发生风险仍存在显著正相关关系[9]。Adabag 等对完成递增负荷运动的受试者进行为期25年的追踪研究发现,调整心脏危险因素后,提前终止递增负荷测试(指受试者运动心率未达到85%最大心率即停止)与猝死、冠心病死亡以及全因死亡风险的增加显著相关[7]。Duarte 等曾结合运动中心率增加以及运动后心率恢复计算运动心率评分等级,发现运动心率评分等级和全因死亡率显著相关[10]。运动中较高心率(150分/次)的持续时间可以有效预测运动引起的心肌损伤标志物心肌肌钙蛋白的升高[11]。规律运动可以有效降低血浆儿茶酚胺水平[12],提高交感迷走神经系统的调节[12-14],改善心率变异性[14],降低安静心率和定量负荷运动心率,加快运动后心率的恢复[15-18],但运动对心率的影响一定程度上取决于遗传[18-20]。
van de Vegte 等[19]曾提出运动中心率的增加取决于神经系统生长发育相关基因(如CCDC141、TCF4、PAX2、SOX、CAV2)、神经元寿命延长相关基因(如SYT10)、心脏发育及心脏疾病相关基因(如RNF220)以及心脏节律相关基因(如SCN10A、RGS6)。运动训练对定量负荷运动心率影响的遗传度在34%[21],中等强度持续运动(moderate intensity continuous training,MICT)改善运动心率的效果差异主要取决于细胞凋亡与增殖、心脏神经元记忆等生物功能相关的9 个单核苷酸多态性位点(single nucleotide polymorphisms,SNPs),其解释度为35.9%[22]。研究表明,高强度间歇运动(high intensity interval training,HIIT)可以显著改善腰围、体脂率、最大摄氧量(maximal Oxygen uptake,VO2max)、心率和血压[17],与MICT相比,HIIT在降低全因死亡率[23]和提高心肺耐力[24]等方面均更具优势。但长期HIIT降低定量负荷下运动心率效果差异以及遗传因素对运动心率改善效果的影响仍不清楚。
随着运动相关基因检测服务的商业化、便捷化和低成本化,结合遗传背景制定个体化运动健身方案成为促进主动健康的有效途径。本研究通过分析12 周HIIT 改善定量负荷运动心率的效果及个体差异,从全基因组层面筛选运动心率改善效果相关分子标记;计算权重后的多基因预测评分(polygenic predictor score,PPS),建立基于全基因组关联分析(genomewide associationstudy,GWAS)的运动心率效果分子标记预测模型;联合表型和遗传指标,共同构建HIIT改善定量负荷运动心率效果综合预测模型,为大众个体化运动健身方案的制定提供依据。
1 研究方法
1.1 受试者基本情况
研究对象来自国家重点研发计划课题身体活动不足[25]健康成年人样本库,受试者招募及纳入标准同前期报道[26,27],告知受试者实验设计及测试要求,并在运动干预前签订知情同意书,研究方案经北京体育大学运动科学实验伦理委员会审查批准,伦理审查批准编号:2019191H。本文提取课题样本库中第一轮12 周HIIT 干预前后定量负荷运动心率(简称:运动心率)测试数据以及基因解析数据,共计240 人。受试者基本信息如表1,样本筛选及数据质控流程见图1。

图1 样本筛选及基因组数据过滤流程

表1 受试者基本信息
1.2 测试方法与数据质控
1.2.1 定量负荷运动心率测试
要求受试者测试前3天内避免中等到大强度的活动,规律饮食,正常作息。12周干预后的测试时间为最后一次运动训练结束后3天。定量负荷运动心率采用功率自行车、CORTEX 气体代谢仪和Polar 心率带测试[28]。受试者以100 W(男)或75 W(女)的负荷功率持续蹬车5分钟,通过节拍器将蹬车频率控制在60转/分[18]。数据录入时选取定量负荷测试中后3分钟稳定状态的摄氧量和运动心率,取运动心率平均值为定量负荷运动心率结果[29],剔除偏倚程度大于3SD的异常数据。
1.2.2 最大摄氧量测试
最大摄氧量测试方法和HIIT运动干预方案前期已有详细报道[26],采用功率自行车递增负荷运动方案,通过CORTEX气体代谢仪直接测试,测试方案:男性初始负荷50 W,每2分钟递增25 W,女性初始负荷40 W,每2分钟递增20 W,通过节拍器将蹬车频率控制在60转/分。运动中通过polar 心率带采集受试者实时心率,每级负荷记录受试者主观疲劳感觉(RPE),通过最大摄氧量设定训练强度。
1.2.3 HIIT运动干预方案
采用高强度间歇运动方式,每周训练3次,训练12周,高强度跑强度80%~90% VO2max,间歇强度50%~55% VO2max[26](表2)。通过佩戴polar心率带控制受试者心率在目标强度对应心率范围内。
1.2.4 基因组数据质控及基因型填充
通过DNA 提取试剂盒(天根,北京)提取受试者血液白细胞DNA。采用Infinium 芯片(芯片类型:CGA-24v1-0,Illumina公司)进行全基因组的基因分型,共成功分型473 人。提取473 人全基因组数据中的常染色体基因型数据进行数据质控,质控条件[30,31]:剔除基因型数据缺失率>3%的位点(52874个),剔除检出率低于95%的样本(12人),剔除最小等位基因频率(Minor Allele Frequency,MAF)低于1%的位点(149912个),剔除不符合哈温平衡的位点(P<1×10-6,545 个),剔除异质性检验偏离均值3SD的样本(5人),剔除PCA分析偏离均值3SD 的样本(7 人)。芯片原始分型数据共449 人485,474个位点通过质控。
以千人基因组数据库中的中国人数据(版本:Phase3 Build 37)为基因型填充的参考面板。通过Genotype harmonizer 1.4.20 完成芯片测序链对齐,以SHAPEIT 2 软件进行基因定相,采用IMPUTE 2 完成基因型填充。对填充后的常染色体基因组数据以INFO 0.8和MAF 5%为阈值进行过滤[32-34],提取本文分析的240人基因组SNPs数据,最终240人的5,201,186个SNPs纳入GWAS。
1.3 数据分析与统计方法
1.3.1 运动训练效果数据分析
测量数据以x±s描述,通过IBM SPSS Statistics 23采用配对t检验进行12周前后训练效果的整体检验,显著性水平P<0.05。运动心率训练效果通过Δ运动心率(ΔHR)表示,ΔHR=干预后运动心率-干预前运动心率。计算Cohen’s d 效果量(Effect Size,ES),根据COHEN经典分类以ES<-0.8、-0.8≤ES<-0.5、-0.5≤ES<-0.2、-0.2≤ES<0和ES≥0对训练效果进行分组[35,36]。
1.3.2 全基因组关联分析及效果分子标记预测模型构建
通过PLINKv1.9 软件以遗传加性模型,性别、运动心率初始值、基因组主成分分析中特征值最大的前五个主成分(Principal Component,PC)作为协变量,对12周HIIT 改善运动心率效果数据进行全基因组关联分析。计算GWAS 关联结果的膨胀系数(Genomic Inflation Factor,λ),评价GWAS关联结果的偏倚情况以及是否受到群体分层的影响[31],通过R studio绘制曼哈顿图显示GWAS关联结果,显著性水平阈值定为P<1×10-5[37]。
在筛选出的显著性水平达到阈值的SNPs(P<1×10-5)的10KB区域内选择显著性水平最高的SNPs作为Lead SNPs。通过线性逐步回归,去除LeadSNPs 中的冗余SNPs,选择进入回归模型的SNPs 作为预测因子,计算SNPs对运动心率改善效果差异的解释度。
多基因预测评分:基于全基因组关联分析以及线性逐步回归去除冗余后得到的SNPs,通过公式1 计算每名受试者的PPS[30,37]。双变量相关性检验分析PPS与运动心率改善效果的相关性,非参数Kruskal-Wallis检验比较不同ES 组间的PPS 差异,线性逐步回归分析计算PPS 对运动心率改善效果差异的解释度,显著性水平P<0.05。公式1[30,37]:
其中,n表示有效等位基因的数量,i表示筛选出的lead SNPs的数量,β表示GWAS线性分析得到的beta值。
1.3.3 候选基因功能注释及富集分析
通过FUMA[38]完成SNPs 及基因功能注释,对达到显著性SNPs(P<1×10-5)的250 kb范围内符合r2>0.6且P<0.05的SNPs(候选SNPs)进行基因作图,确定运动心率改善效果候选基因。通过Matascape[39]完成候选基因的功能富集分析,通过R studio 完成富集结果的可视化展示。
1.3.4 基于遗传与表型指标的运动训练效果综合模型构建
将性别、年龄、身高、体重、初始运动心率作为预测因子,运动心率改善效果作为预测变量,通过线性逐步回归分析影响效果的表型指标,构建基于表型指标的运动心率改善效果表型预测模型。将PPS、性别、年龄、身高、体重、初始运动心率作为预测因子,运动心率改善效果作为预测变量,通过线性逐步回归构建基于遗传和表型指标运动心率改善效果综合预测模型。通过VIF<5 且0<容差<1 避免变量间的共线性,预测因子纳入条件为P<0.05,显著性水平为P<0.05。
2 结果
2.1 12周HIIT的定量负荷运动心率改善效果差异
经过12周HIIT干预,受试者定量负荷下的运动心率由144 ± 16 次/分显著下降至137 ± 16 次/分(ES=-0.74,t=-9.054,P<0.001)。运动心率改善效果存在个体差异(图2),27%的受试者定量负荷运动心率未改善(ES≥0)(表3)。
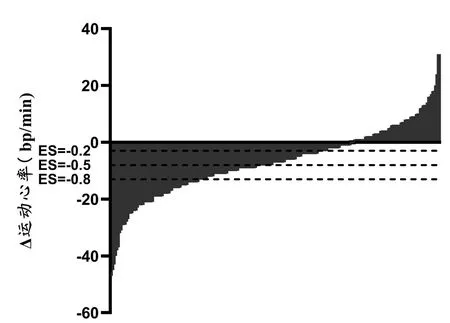
图2 12周HIIT的运动心率改善效果个体差异

表3 12周HIIT后运动心率改善效果
2.2 基于全基因组关联分析的运动心率训练效果分子标记预测模型
2.2.1 运动心率训练效果的全基因组关联分析
全基因组数据与定量负荷运动心率训练效果关联分析结果显示:膨胀系数λ=1.004,基因组数据无人群分层,实际值与期望值不存在严重偏倚(λ<1.1)。12 个Lead SNPs与定量负荷运动心率改善效果显著相关(P<1×10-5,图3),Lead SNPs的具体位点信息及关联结果见表4,不同基因型之间的运动心率改善效果见图4。

图3 运动心率改善效果全基因组关联分析曼哈顿图
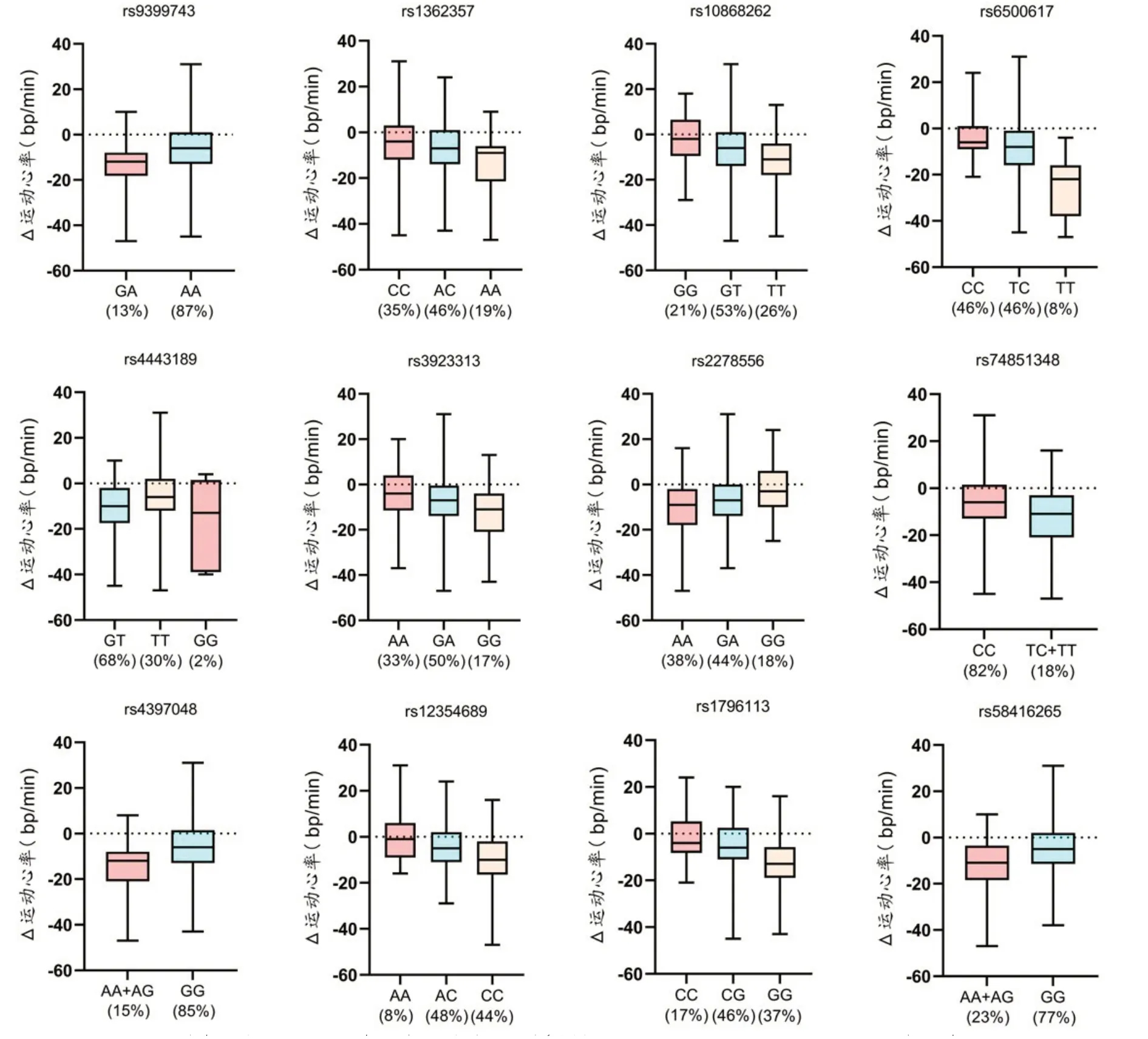
图4 Lead SNPs不同基因型12周HIIT干预运动心率效果比较

表4 定量负荷心率训练效果相关Lead SNPs
2.2.2 运动心率训练效果分子标记预测模型构建
通过线性逐步回归对GWAS 筛选的12 个Lead SNPs 进一步分析,剔除2 个冗余SNPs,10 个SNPs 进入运动心率训练效果预测分子标记模型,模型解释度37.7%(表5),单个SNP的解释度1.2%~8.1%。
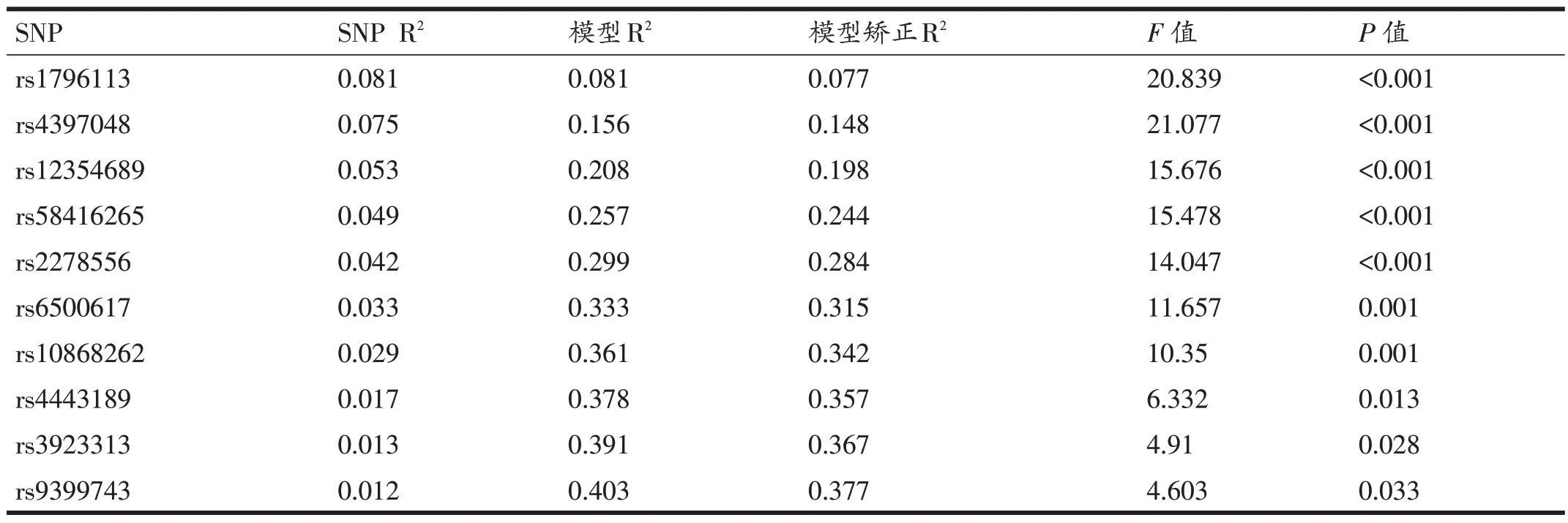
表5 基于GWAS的运动心率训练效果分子标记预测模型
2.2.3 基于GWAS的PPS与运动心率训练效果预测
基于GWAS以及线性逐步回归去除冗余后得到的10个SNPs,通过公式1计算每名受试者的PPS。如图5所示,PPS可以有效区分不同ES效果组,当PPS得分高于11.45 分(95%CI:8.719~14.190),HIIT 对运动心率降低完全无效(ES≥0);当PPS 得分低于-0.527 分(95%CI:-3.808~2.755),运动心率改善效果较好(ES4:-0.8≤ES<-0.5);当PPS 得分低于-7.728 分(95%CI:-11.520~-3.938),HIIT 改善运动心率效果最好(ES5:ES<-0.8)。

图5 PPS得分与HIIT改善运动心率效果
2.3 GWAS候选基因的生物功能分析
通过SNPs及基因功能分析,共获得运动心率改善效果相关基因92个,基因富集分析结果显示,KEGG数据库中,基因主要富集在cAMP 信号通路(KEGG:hsa04024;富集基因数量:4 个;P=4.72×10-3)和核质转运通路(KEGG:hsa03013;富集基因数量:3个;P=4.43×10-3);GO数据库中的生物功能主要富集在有机阴离子转运、糖蛋白生物合成、有机酸转运、糖基化过程、羧酸转运等生物过程(图6)。
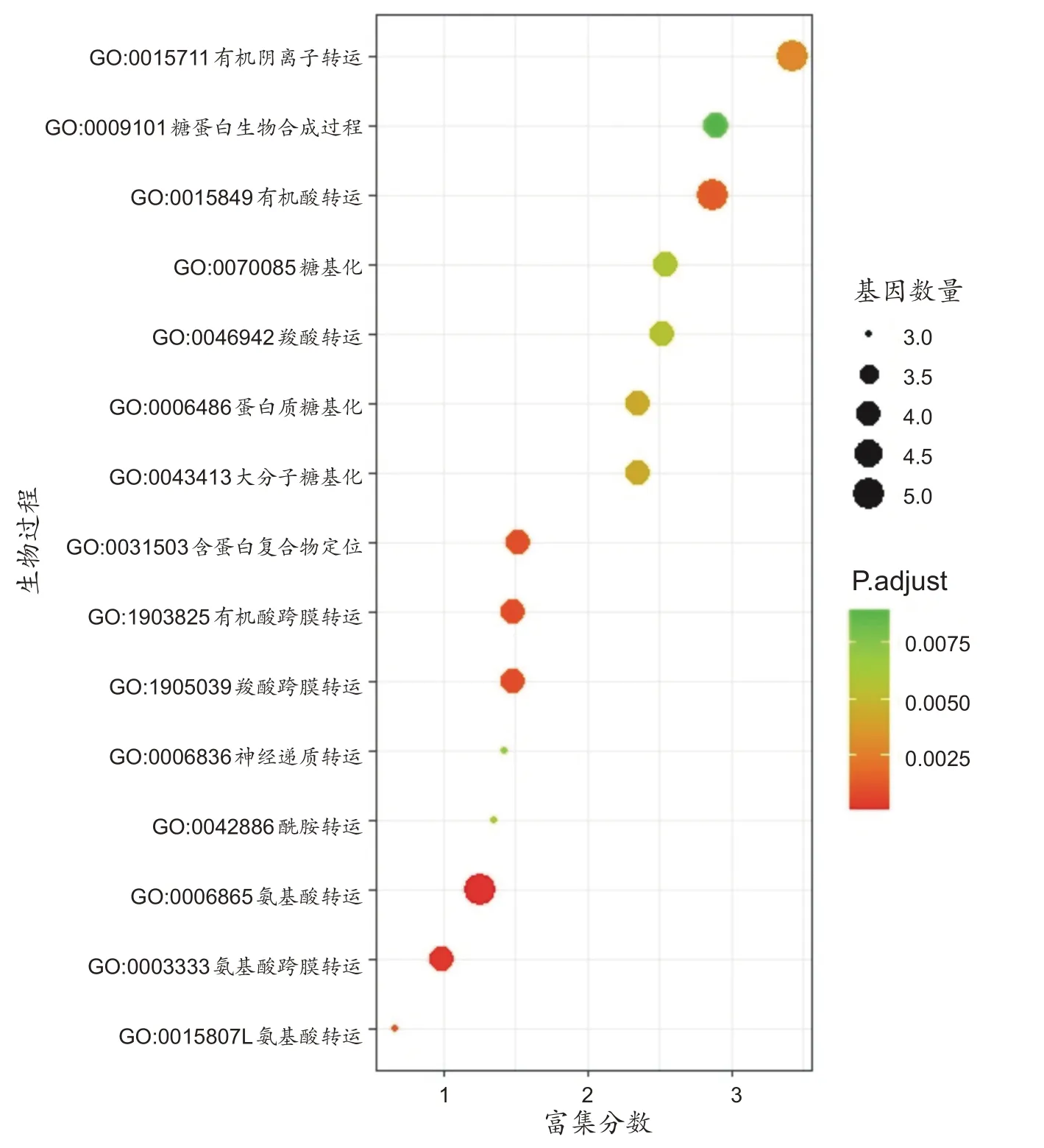
图6 GWAS相关基因GO富集分析图
2.4 运动心率改善效果综合预测模型构建
通过线性逐步回归构建运动心率效果综合预测模型,结果显示预测因子中加入遗传评分(PPS)后,模型矫正R2从24.5%提高至62.5%(表6)。基于表型与遗传指标构建的综合模型2中,PPS、初始运动心率、性别和年龄是HIIT改善运动心率效果的预测因子。
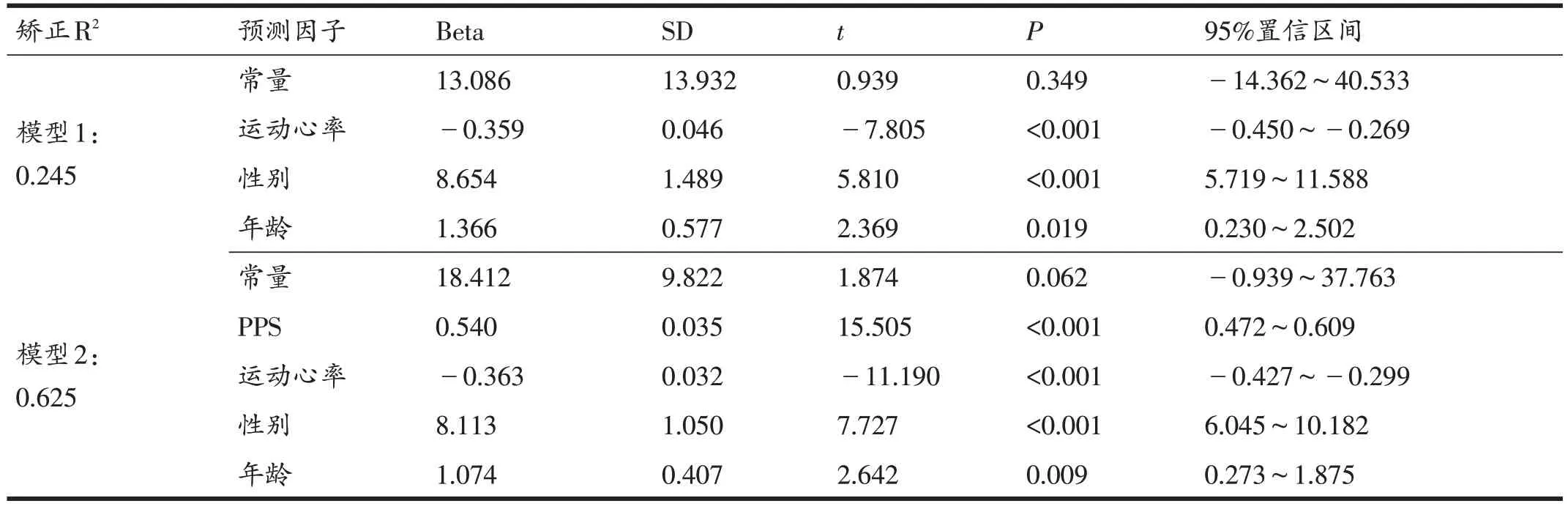
表6 12周HIIT改善运动心率效果回归模型
3 分析讨论
3.1 运动心率改善效果个体差异
标准化运动训练后,受试者的运动效果存在个体差异,多数研究发现个体差异存在于VO2max、胰岛素和葡萄糖代谢、血脂改善、脂肪含量等众多方面[6,24]。本研究发现,经过12 周HIIT 干预,受试者定量负荷下的运动心率均值由144 次/分显著下降至137 次/分,但不同受试者的运动心率改善效果存在个体差异。Rankinen等[22]也曾报道成年人完成20周的MICT后,定量负荷运动心率平均降低11 次/分,但效果个体差异较大(-42 次/分~12 次/分)。本研究选择改善心肺耐力效果更高的HIIT方案进行干预,发现经过12周HIIT的标准化训练,27%的受试者运动心率无改善(ES≥0),另有10%的受试者仅有微小效果(-0.2≤ES<0),无论间歇或者持续的运动,运动心率改善效果均存在一定个体差异。
运动中表现出交感神经兴奋,儿茶酚胺水平增加,运动心率的增加。规律的耐力运动可以有效降低血浆儿茶酚胺水平[12],提高交感迷走神经系统的调节作用[12-14],降低定量负荷下运动心率,改善心率变异性[14],且存在基因变异的交互作用[40]。而急性运动或长期规律运动对心率变化的遗传度在0.12~0.65之间[19],遗传差异可以在一定程度上解释运动训练引起的定量负荷运动心率的变化。
3.2 运动心率改善效果的遗传因素分析
运动心率改善效果分子标记预测模型包括10 个SNPs,单个SNP 的解释度在1.2%~8.1%。其中6 号染色体的rs9399743 位点是显著性最强的位点(P=1.65×10-6),该SNP 位于GRIK2基因(Glutamate ionotropic receptor kainate type subunit 2gene)附近。GRIK2基因主要在脑组织中表达,其编码的蛋白质谷氨酸受体是哺乳动物大脑中主要的兴奋性神经递质受体,具有配体激活离子通道的功能,该基因与细胞内钙信号、CREB通路等相关,但该位点与心脏以及心率的关系仍不清楚。本研究中GA 型受试者(分布频率13%)的平均运动心率训练效果比AA型(分布频率87%)多降低8次/分。
HIIT 改善运动心率效果差异解释度最高的SNP rs1796113 位于7 号染色体C1GALT1基因(Core 1 synthase,glycoprotein-N-acetylgalactosamine 3-beta-galactosyltransferase 1 gene)附近,可以解释8.1%的效果差异(P=7.98×10-6)。C1GALT1基因主要参与蛋白质代谢、粘蛋白O-连接的糖基化等通路。基于GWAS的meta 分析显示C1GALT1基因多态性与肺功能(FEV1/FVC)显著相关[41]。本研究中37%的受试者为rs1796113 的GG 纯合型,其运动心率比CG 型(分布频率46%)和CC型(分布频率17%)分别多降低7次/分和10 次/分,GG 型受试者的运动心率降低效果最好。eQTL 数据库中也显示rs1796113 存在eQTL 效应,GG型C1GALT1基因在脑组织中多个部位以及骨骼肌中的基因表达均高于CG和CC型。
位于10 号染色体的rs12354689 可以解释运动心率变化差异的5.3%(P=6.14×10-6),该SNP 位于ADAM12基因(ADAM metallopeptidase domain 12 gene)内含子区域,基因编码的蛋白质具有蛋白水解活性,通过控制各种膜结构域亚基从细胞表面的脱落而影响细胞靶点,与心血管疾病如动脉粥样硬化、高血压、动脉瘤、冠状动脉疾病、心肌梗塞、心力衰竭等多种心血管疾病有关[42]。ADAM-10,12,15 和17 的过表达会引起心肌肥厚和扩张性心肌病[43]。在小鼠模型中发现ADAM12基因的敲除可显著增强局灶粘连和纤维化相关信号通路,导致心脏纤维化增加[44]。
SNP rs2278556 位于3 号染色体的ATP2B2基因(ATPase plasma membrane Ca2+transporting 2 gene)内含子区域,该基因编码ATP 酶质膜Ca2+转运蛋白2,参与心脏信号传导、肌肉收缩、离子稳态维持[45]、钙离子转运[46]等多种生物功能。本研究中发现其与HIIT改善运动心率显著相关(P=3.91×10-6),可以解释4.2%的效果差异。其中AA 型受试者(分布频率38%)的平均运动心率降低效果最好,比GA型(分布频率44%)多降低4 次/分,比GG 型(分布频率18%)多降低8 次/分。rs2278556 曾报道与孤独症谱系障碍症相关[47],但其与运动心率相关机制仍不清楚。
基因富集分析结果表明,HIIT 改善运动心率相关基因主要富集在cAMP 信号通路和核质转运通路。cAMP已被证明能触发糖原分解相关的能量供应,调节Ca2+离子稳态[48],通过调节细胞信号和炎症因子的释放在免疫应答中发挥重要作用[49]。而核质转运通路在维持细胞内环境稳态中发挥重要作用,其功能失调与衰老和神经退行性疾病相关[50],但目前具体调节机制仍不清楚。本研究中GWAS 相关基因的GO 生物功能主要富集在离子转运、糖蛋白生物合成、有机酸转运、糖基化过程、羧酸转运等生物过程,提示规律训练可能从cAMP、核质转运、离子通道功能以及细胞稳态调节等方面影响了运动心率的改善效果。
3.3 基于GWAS的多基因预测评分与运动心率改善效果预测模型构建
身体活动不足和久坐行为是可改变的心血管疾病和全因死亡率的风险因素[4,51-53]。提高身体活动水平、增加有氧运动是提高心肺耐力预防慢病的有效方式[3,4]。但仍有一定比例人群无法达到足够的身体活动,身体活动不足和久坐行为依然广泛存在[54-57],缺乏时间、惰性、运动意愿不强等是常见的身体活动不足的原因[57,58]。多数研究已经证实进行相同运动方案的锻炼,不同的健康评估指标均存在一定比例的锻炼无效者[5,6],但目前仍无切实有效的方法提前辨别运动后的个体效果,帮助运动中的无效果者改善效果,提高其运动的主观意愿。
多基因风险评分在冠状动脉疾病、2型糖尿病等疾病早期发病风险预测中已有广泛研究[59-61],且目前已建立癌症发病风险预测数据库来推进癌症多基因风险评分的研究,多基因风险评分是基因组学研究的重要途径[62]。基因预测评分结合临床上多基因风险评估模型,通过GWAS中的效应值(beta)叠加计算有效等位基因的综合得分PPS,已用于计算运动提高最大摄氧量效果的预测[37]。Rankinen 等[22]曾基于9 个SNPs 建立预测20周MICT后心率改善效果的PPS模型,当PPS得分不超过9 分时,定量负荷运动心率无明显改善,而当PPS达到16 分时,定量负荷运动心率至少可以减少20 次/分。本研究结合GWAS中的效应值(beta),计算PPS得分发现,当PPS得分低于-0.527分时,运动心率降低效果可达中等效应量(-0.8≤ES<-0.5);当PPS 得分低于-7.728 分时,运动心率降低效果最好(ES<-0.8);而当PPS得分高于11.45时,HIIT对运动心率的改善完全无效(ES≥0),建议这部分受试者通过其他运动方式或不同运动方案,以达到改善定量负荷运动心率的目的。
本研究基于遗传因素构建的运动心率改善效果分子标记预测模型解释度可达37.7%,略高于MICT 干预后运动心率改善效果的遗传因素解释度35.9%[22]。由PPS得分、干预前的运动心率、性别和年龄构建的12周HIIT 改善运动心率效果综合预测模型可以在62.5%的程度上解释运动心率改善的效果差异,模型解释度远高于仅通过表型指标构建的效果预测模型(矫正R2=24.5%)。在运动干预之前可以通过受试者的年龄、性别、初始运动心率以及PPS得分,通过本研究构建的综合模型共同预测受试者12周HIIT干预效果,为制定大众个体化运动健身方案提供依据。
4 研究不足与展望
本研究是基于健康在校大学生人群组织的12 周HIIT运动干预,未在其他独立人群中进行结果验证,具有一定局限性。但本文首次从全基因组的角度发现了与中国人HIIT 改善定量负荷运动心率效果相关的SNPs(P<1×10-5),且通过多基因评分预测运动锻炼的效果,从多基因的视角探讨HIIT 改善运动心率的效果差异及机制。今后将通过扩大样本量、扩大受试人群年龄范围或进行基于GWAS的meta分析进一步验证本文的研究结果。
5 结论
经过12周HIIT干预,定量负荷下的运动心率显著下降,但效果存在个体差异。GWAS 发现12 个Lead SNPs 与定量负荷运动心率改善效果显著相关(P<1×10-5),其中10个SNPs可以预测运动心率改善效果,单个SNP 的解释度在1.2%~8.1%。10 个SNPs 构建的PPS得分可以有效预测运动心率改善效果,当PPS得分低于-7.728分(95%CI:-11.520~-3.938),HIIT改善运动心率效果最好(ES<-0.8),当PPS 得分高于11.45分,HIIT对运动心率改善完全无效(ΔHR≥0)。PPS、初始运动心率、性别和年龄是HIIT 改善运动心率效果的预测因子,可在62.5%的程度上解释HIIT 改善运动心率效果差异。

