左束支起搏联合左心室心外膜起搏在心脏再同步化治疗的初步应用
张斌 乔建忠 汪杰 潘令新 王园 熊恩来
心脏再同步化治疗(cardiac resynchronization therapy,CRT)是严重心力衰竭患者的重要器械治疗手段之一,传统CRT主要为双心室起搏,即经冠状静脉窦行左心室心外膜起搏(left ventricular epicardial pacing,LVEP)联合右心室间隔部心内膜起搏,但临床证实有效的反应率为70%,仍有约1/3对CRT无反应[1]。起搏后QRS波的宽度是预测心脏同步的重要参数之一,但LVEP后心电图往往难以预料。尽管希望通过左心室心外膜电极导线工艺的进步或电极植入位置的优化提高CRT反应,但目前仍不十分理想[2]。左束支起搏(left bundle branch pacing,LBBP)通过起搏心脏传导束上的左束支主干或分支,起搏成功后能够夺获左束支,获得右束支阻滞图形。国内原创研究已经证实,LBBP安全有效,并能够实现电-机械同步[3],甚至在左心功能改善方面优于传统CRT[4],但将LBBP与LVEP联合优化CRT的研究较少。本研究将传统CRT中右心室间隔部起搏改为LBBP,将LBBP与LVEP融合,组成LBBP优化CRT,探讨可行性与安全性,并评估电同步性及临床心功能改善的效果。
1 对象与方法
1.1 研究对象
纳入2021年1月至2022年3月在铜陵市人民医院心内科住院的符合传统CRT植入标准的心力衰竭患者11例。纳入标准:窦性心律、QRS宽度≥130 ms、左束支或室内阻滞、左心室射血分数(left ventricular ejection fraction,LVEF)≤35%的症状性心力衰竭患者[5],同时存在植入式心脏转复除颤器(implantable cardioverter defibrillator,ICD)指征则为CRT及埋藏式心脏再同步化治疗除颤器(cardiac resynchronization therapy defibrillator,CRT-D)适应证。排除标准:非窦性节律、急性冠状动脉综合征或急性心肌炎、纽约心脏病协会(New York Heart Association,NYHA)心功能分级Ⅰ~Ⅱ级、严重肝肾功能不全或血液系统疾病、肿瘤、精神疾患、预期生存期不超过1年的患者。所有患者均签署知情同意书并通过铜陵市人民医院伦理委员会审批。
1.2 手术过程
行CRT的患者局部麻醉下依次植入左束支电极、左心室心外膜电极及心房电极;CRT-D的患者依次植入ICD电极、左束支电极、左心室心外膜电极及心房电极。
LBBP电极选择右前斜位30°,按照指南推荐方法植入C315鞘(美敦力 SelectSite)与3830电极(美敦力 SelectSecure)[6]。参数要求需同时满足以下标准:(1)起搏体表心电图呈右束支阻滞波形伴或不伴心腔内出现左束支电位;(2)左心室达峰值时间(left ventricular activation time,LVAT)即刺激信号到V5~V6导联QRS最高点时间<90 ms,且增加刺激输出,LVAT保持恒定;(3)起搏参数要求:阈值<1.0 V/0.4 ms、阴极端阻抗500~1000 Ω,阳极端阻抗不超过500 Ω,感知>5 m V 且导线固定可靠;L V E P 电极植入通过Amplaze造影导管、输送鞘进行,选择侧静脉、侧后静脉或后静脉为理想静脉,心大静脉为次选[7]。LVEP起搏参数要求:阈值≤1.0 V/0.4 ms、阻抗<1 000 Ω、感知≥5 mV且无膈肌刺激。
符合CRT-D的患者ICD电极使用弯钢丝技术放置至右心室低中位间隔,因本研究排除心房颤动患者,患者均最后按常规方法放置右心房电极。LVEP电极接脉冲发生器左心室接口,LBBP电极接右心室接口;CRT-D中ICD电极接除颤接口。患者均拟行LBBP联合LVEP,如左束支电极植入失败,改为右心室间隔部起搏;如左心室心外膜电极植入失败,则将左束支电极连接左心室接口,植入右心室间隔部起搏电极接右心室接口(图1)。根据起搏后最窄QRS波决定双心室起搏间期,左心室电极激动提前10~40 ms,记录术前、LVEP、LBBP及联合起搏的图形及宽度。
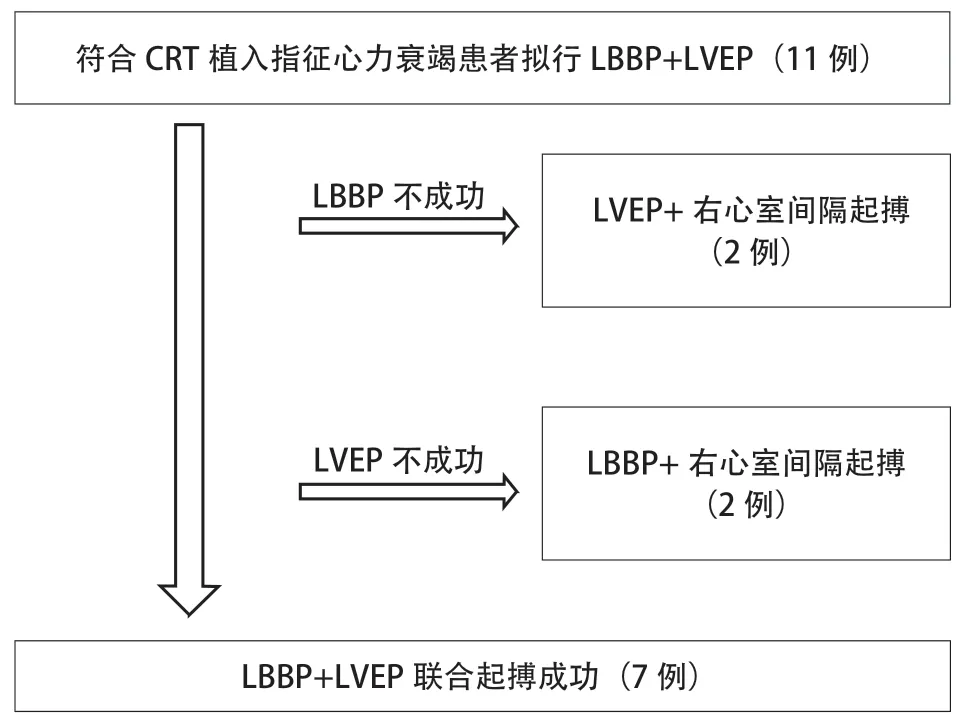
图1 研究流程图Figure 1 Flow chart of study
1.3 观察指标及随访
收集患者一般资料包括年龄、性别、基础疾病、心力衰竭药物治疗方案等,记录术中起搏参数、影像学及心腔内电图表现,其中起搏后QRS波宽度测量为起搏刺激信号至QRS波终末部分。术后1、3个月进行随访,记录临床表现、X线胸片及超声心动图(主要观察LVEF及LVEDd)变化情况。
1.4 统计学分析
所有数据均采用SPSS 25.0软件进行统计分析。计量资料以均数±标准差(±s)表示,分类变量以[例(比)]表示。由于样本量较小,采取非参数检验,术前术后比较采用配对样本的Wilcoxon检验。以P<0.05为差异有统计学意义。
2 结果
2.1 基线资料及手术成功率
11例患者拟行LBBP联合LVEP,男3例,女8例,平均年龄为(68.7±9.5)岁,其中扩张型心肌病7例,缺血性心肌病2例(病例5、病例11),心脏瓣膜病1例(病例4),心肌致密化不全1例(病例6),术前NYHA心功能分级Ⅲ~Ⅳ级。术前心电图表现为左束支阻滞者9例(9/11),室内阻滞者2例(2/11,病例4、病例11)。行CRT者5例(5/11),CRT-D植入者6例(6/11)。所有患者在依次进行LBBP联合LVEP过程中,有2例(病例4、病例9)LBBP植入不成功(主要原因为C315鞘管无法支撑到左束支区域、起搏感知低下)与2例(病例7、病例10)LVEP电极植入不成功(主要原因为无合适靶静脉、靶静脉成角导致电极无法到位);剩余7例患者LBBP联合LVEP成功(图2、表1)。
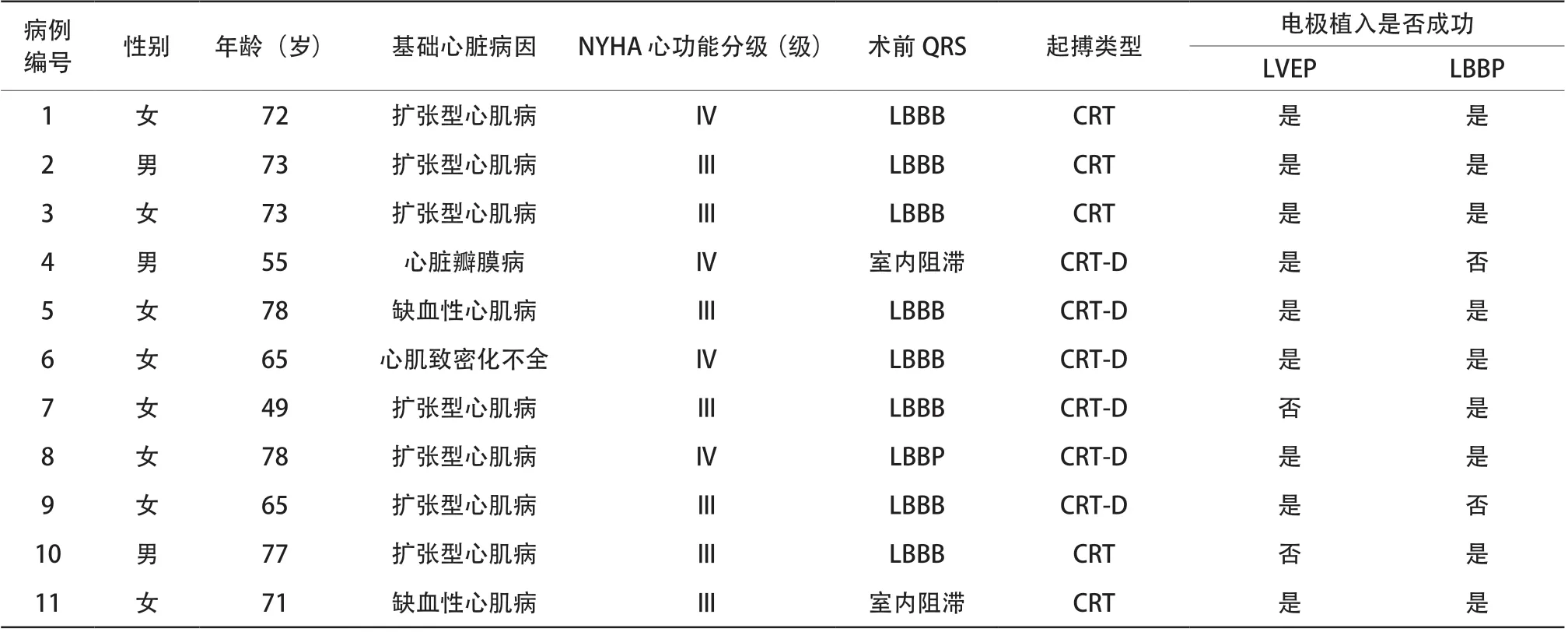
表1 11 例患者基线资料Table 1 Baseline characteristics of patients
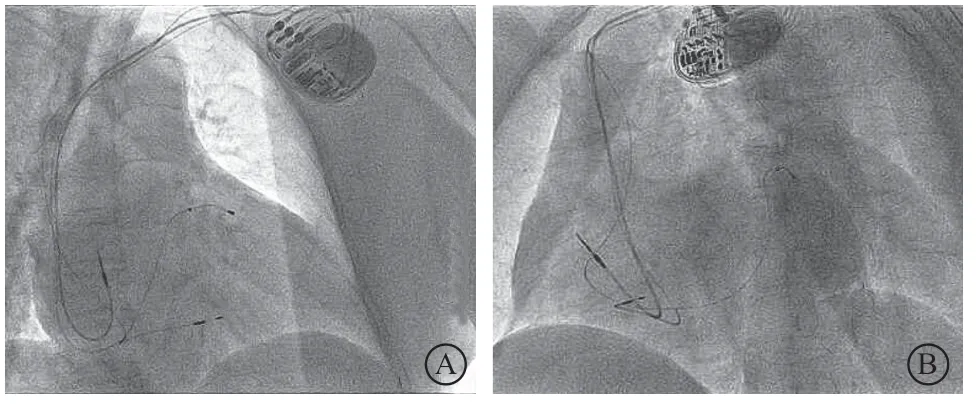
图2 LBBP 联合LVEP 成功X 线影像 A.右前斜位30°;B.左前斜位45°Figure 2 Successful X-ray images of LBBP combined with LVEP
所有患者术前利尿剂、血管紧张素转换酶抑制剂(angiotensin converting enzyme inhibitor,ACEI)/血管紧张素Ⅱ受体拮抗剂(angiotensinⅡ receptor blocker,ARB)/血管紧张素受体脑啡肽酶抑制剂(angiotensin receptor-neprilysin inhibitor,ARNI)、β受体阻滞剂、醛固酮受体拮抗剂(螺内酯)使用比例分别为11/11、8/11、7/11、9/11;术后5例(5/11)利尿剂减量,5例(5/11)ACEI/ARB/ARNI及7例(7/11)β受体阻滞剂加量(表2)。
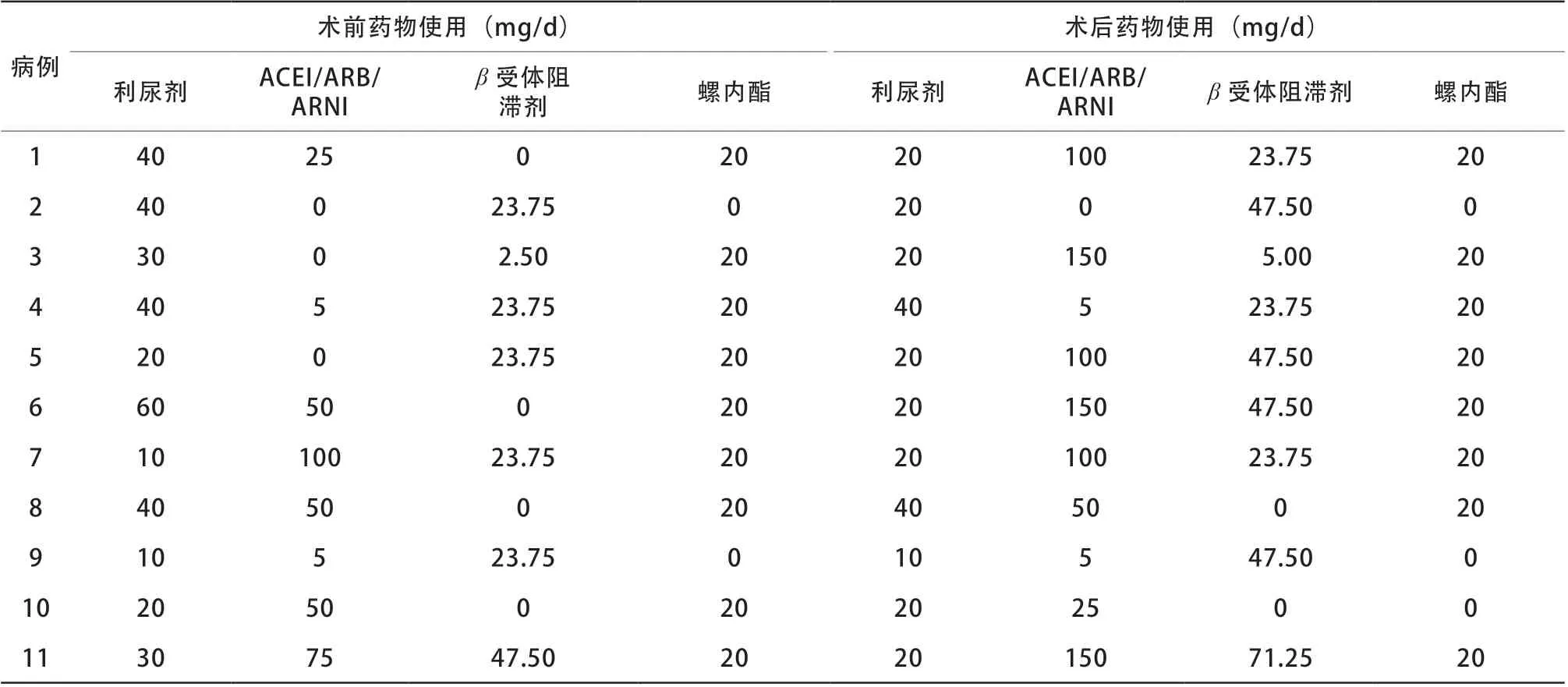
表2 11 例患者心脏科药物使用情况Table 2 Cardiovascular drugs used in 11 patients
2.2 起搏前后心电图比较及心功能情况比较
11例患者中病例1、2、3、5、6、8、11共7例患者LBBP与LVEP联合起搏成功,其中术前、术中LVEP、术中LBBP及联合起搏图形见图3。术前、LVEP、LBBP及联合起搏后心电图平均QRS宽度分别为163.6 ms、151.4 ms、125.7 ms、129.3 ms,其中联合起搏QRS宽度分别低于术前(P<0.001)及LVEP(P=0.001),差异均有统计学意义,但与LBBP比较差异无统计学意义(P>0.05);LBBP后Q R S 宽度低于L V E P,差异有统计学意义(P<0.001,表3)。
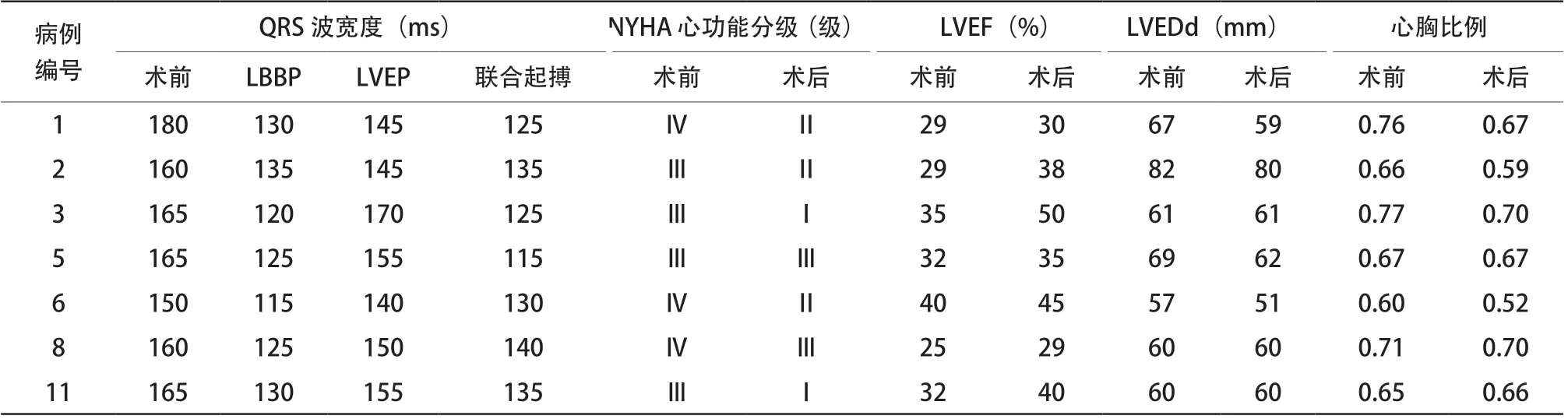
表3 LBBP+LVEP 联成功患者起搏后QRS 宽度及心功能比较Table 3 Comparison of QRS width and cardiac function in patients with LBBP + LVEP

图3 不同起搏方式胸前导联QRS 波的比较Figure 3 Comparison of QRS waves in thoracic leads of different pacing modes
随访3个月后,联合起搏的7例患者均无死亡,其中2例由于心力衰竭再入院,药物治疗好转出院。比较术前及术后3个月心功能参数,LVEF由术前31.7%上升至38.1%,差异有统计学意义(P=0.018),NYHA心功能分级、LVEDd及心胸比例均有所下降,但差异均无统计学意义(均P>0.05,表3、图4~5)。
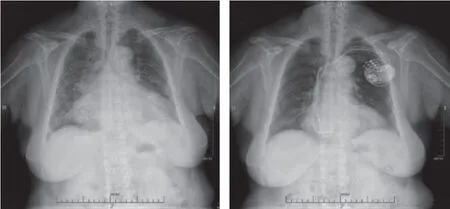
图4 病例1 患者左束支起搏优化CRT 术前术后X 线胸片比较 A.术前;B.术后3 个月Figure 4 Comparison of chest radiographs before and after optimization CRT in case 1
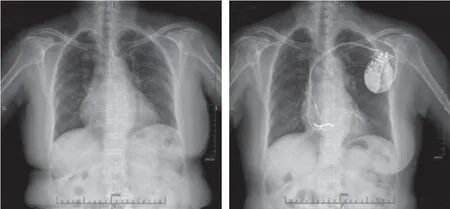
图5 病例6 患者左束支起搏优化CRT-D 术前术后X 线胸片比较 A.术前;B.术后3 个月Figure 5 Comparison of chest radiographs before and after optimization CRT-D in case 6
2.3 并发症发生情况
11例患者平均手术时间为(175.7±30.5)min。在围术期及随访过程中,起搏电极参数稳定,未出现电极穿孔或脱位、心脏压塞、阈值升高、感染等情况,病例7在行左心室心外膜电极植入过程中,反复尝试进入靶血管,出现冠状静脉夹层后终止手术;病例8术后出现囊袋血肿,予以加压包扎后逐渐吸收。
3 讨论
CRT是严重心力衰竭患者重要治疗手段之一,传统CRT为LVEP联合右心室心内膜起搏,能够改善心脏失同步,但具有以下不足:左心室电极难以标准化;术后QRS波难以预测,术后疗效无法掌控;术后无反应性高(30%)等[8],其中直观地体现为传统CRT术后患者起搏QRS波多变,且多数QRS波仍较宽大。
希浦系统起搏为激动正常传导系统,使心肌产生激动,但希氏束起搏由于阈值高、不适用于阻滞平面在希氏束以下、操作难度大等局限性[9],目前逐步被LBBP所替代,LBBP通过起搏左束支主干或分支,虽起搏后表现为右束支传导阻滞,但左心室心电活动接近生理,还可以通过调整房室延迟或起搏方式,使得起搏QRS接近正常[10]。
研究证实希氏束或LBBP能够改善心脏功能[11-12],主要表现在心电同步上,但心电同步性的改善能否直接提高机械同步性、改善远期心功能仍存在争议[13]。而且,在CRT患者中,部分QRS增宽非真性左束支阻滞,可能同时存在室内阻滞,而单纯LBBP不能完全改善室内阻滞患者左心室收缩的同步性,需要联合LVEP才能获得较理想的QRS波和临床效果[14]。本研究中联合起搏的QRS宽度低于术前及LVEP,提示联合起搏后心电同步性改善,并优于LVEP,与前述研究类似[15]。联合LBBP及LVEP 3个月后,LVEF由31.7%上升至38.1%,而研究显示左束支起搏优化CRT后随访半年、1年,LVEF分别能够升高18%、20%[16]。本研究中部分患者X线胸片能够观察到术后3个月心影明显缩小,证实LBBP联合LVEP能够改善心脏重构,但NYHA心功能分级、LVEDd及心胸比例较术前下降,差异均无统计学意义。目前研究显示左束支起搏较传统CRT在心功能改善方面相似甚至更有优势,但这些研究样本量均较少[17-18]。本研究中联合起搏后QRS宽度与LBBP比较差异无统计学意义,提示联合起搏在心电同步性方面不劣于单纯LBBP,而有研究证实LBBP需要联合LVEP起搏达到最窄的QRS波宽度[12]。本研究中,部分患者在术后心力衰竭药物的治疗方面,利尿剂需求量减低,改善预后的ACEI/ARB/ARNI、β受体阻滞剂使用比重增加,可能原因:晚期心力衰竭患者由于心脏泵功能下降,常表现为低血压/低灌注,难以使用ACEI/AR B/AR NI或β受体阻滞剂等改善预后的药物,而术后部分患者LVEF改善,泵功能好转,能够在一定程度更加有利于心力衰竭标准药物治疗,从而改善患者预后。
本研究中LBBP有2例不成功,其中左束支起搏失败1例(病例4),为右心房、右心室明显扩大,现有C315鞘管长度不足以支撑;1例(病例9例)为起搏感知低下。CRT适应证患者心脏常明显增大或转位,室壁厚度改变,故这些患者在行LBBP时较心脏结构正常的患者更加困难,且即使成功,起搏后心电图电轴常左偏,考虑多为起搏左束支分支,而非左束支主干,可见目前广泛使用的LBBP植入工具,在部分心脏明显扩大的患者中可能需要进一步改进。围术期及随访过程中,未出现电极脱位、组织损伤、间隔穿孔等并发症,患者均能够良好耐受手术,所以LBBP联合LVEP在技术上是安全及可行的。
综上所述,本研究将LBBP与传统CRT联合,与其他研究将二者头对头比较不同,可能提供新的思路。本研究证实LBBP联合LVEP在技术上是安全可行的,但是否必要仍需要更多的临床研究证实。本研究存在一定的缺陷,如样本量少、随访时间较短、对心功能的评价较为粗放等,需要在后续的研究中逐步完善。
利益冲突所有作者均声明不存在利益冲突

