葡萄籽提取物原花青素通过LncRNA NBR2/miR-650调节EMT抑制肝癌细胞Hep3B增殖、迁移和侵袭的分子机制
雷洁琼 田迎霞 李正果 王兴东
(甘肃省医学科学研究院肿瘤医院 1介入治疗科,甘肃 兰州 730050;2特需科)
肝癌是成年人中最常见的原发性肝癌,其恶性度高且预后差。在肝癌的许多治疗选择中,完整的肿瘤切除术是最好的治疗策略之一〔1〕。对于不能手术的肝癌患者,化学疗法是用于治疗肝癌的选择之一,但药物功效仍然有限〔2〕。因此,迫切需要开发化学疗法或化学预防方法来管理肝癌。葡萄籽提取物原花青素是由儿茶素和(或)表儿茶素聚合而成的二聚体、三聚体、四聚体和低聚物/聚合物的混合物〔3〕。迄今为止,葡萄籽提取物原花青素被证明在肝癌〔4〕、食管癌〔5〕、胰腺癌〔6〕、肺癌〔7〕等癌症中显示出一定的抗肿瘤活性,然而,葡萄籽提取物原花青素在肝癌中发挥的分子机制却鲜为人知。长链非编码RNA(LncRNA)是参与许多生物学功能过程的重要因素,包括恶性肿瘤的发展和进展,如肝癌〔8〕。LncRNA NBR2位于众所周知的肿瘤抑制基因乳腺癌易感基因(BRCA)1附近,在不同器官中广泛表达。研究表明,LncRNA NBR2通过激活单磷酸腺苷激活的蛋白激酶和使哺乳动物雷帕霉素靶蛋白(mTOR)信号通路失活,介导姜黄素抑制大肠癌增殖的功能〔9〕。LncRNA NBR2在肝癌细胞中低表达,具有抑制肝癌生长和转移的作用〔10〕。LncRNA NBR2在骨肉瘤组织中的表达下调,LncRNA NBR2过表达可以通过抑制上皮间充质转化(EMT)过程来抑制骨肉瘤细胞的增殖、侵袭和迁移〔11〕。但是,没有关于LncRNA NBR2是否介导葡萄籽提取物原花青素在肝癌恶性肿瘤中的作用和机制的信息。因此,本研究使用葡萄籽提取物原花青素处理肝癌细胞Hep3B,进行体外测定,并分析涉及的分子机制。
1 材料与方法
1.1材料 葡萄籽提取物原花青素(原花青素含量>95%)购自天津尖峰,肝癌细胞Hep3B购自美国ATCC细胞库,si-NC、si-LncRNA NBR2、anti-miR-NC、anti-miR-650、miR-NC、miR-650购自上海GenePharma,细胞计数试剂盒(CCK)-8购自日本DojindoLaboratories,RNAiso Plus、PrimeScript RT、SYBR Master Mix试剂盒购自日本TaKaRa。
1.2细胞培养与分组 整个实验过程肝癌细胞Hep3B使用RPMI1640培养基,在37 ℃的培养箱中,95%空气和5% CO2的潮湿环境下,在RPMI1640培养基中添加了10%胎牛血清(FBS),100 U/ml青霉素和100 μg/ml链霉素。将肝癌细胞Hep3B分为NC组、低、中、高剂量组、si-NC组、si-LncRNA NBR2组、si-NC+高剂量组、si-LncRNA NBR2+高剂量组、anti-miR-NC+si-LncRNA NBR2+高剂量组、anti-miR-650+si-LncRNA NBR2+高剂量组。NC组未使用任何处理,低、中、高剂量组分别使用含25、50、100 μg/ml葡萄籽提取物原花青素的培养基处理48 h。将肝癌细胞Hep3B以每孔2×105个细胞接种在12孔板中。密度达到80%时,根据Invitrogen制造商的操作手册,使用Lipofectamine2000试剂盒进行si-NC、si-LncRNA NBR2、anti-miR-NC、anti-miR-650瞬时转染。6 h后根据分组,更换培养基为包含或不包含高剂量(100 μg/ml)葡萄籽提取物原花青素的培养基,继续培养48 h备用。
1.3Western印迹检测蛋白表达 Western印迹中使用的一抗包括抗细胞周期蛋白(Cyclin)D1、基质金属蛋白酶(MMP)2、MMP9、E-钙黏蛋白(E-cadherin)、N-钙黏蛋白(N-cadherin)、波形蛋白(Vimentin)、β-肌动蛋白(actin)。首先将肝癌细胞Hep3B在放射免疫沉淀测定(RIPA)缓冲液中裂解。使用二喹啉甲酸(BCA)方法对蛋白质进行定量,然后将其加载到1×十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)上进行分离。然后将蛋白质转移到聚氟乙烯膜上,依次将其与一抗孵育(抗β-actin的稀释度为1∶2 000,其他抗体的稀释度为1∶1 000)。清洗膜后,使用辣根过氧化物酶(HRP)标记的二抗(山羊抗兔IgG,1∶5 000)在室温下孵育2 h。之后,添加增强的电化学发光(ECL),并使用凝胶成像分析系统以β-actin作为内部参考来检测每个条带的光密度值。
1.4CCK-8分析细胞增殖 肝癌细胞Hep3B经1.2中处理后,接种到96孔板中,每孔5×104个细胞。将肝癌细胞Hep3B培养48 h,10 μl CCK-8试剂被添加至孔中并反应2 h,用酶标仪读取每个孔450 nm处吸光度A值,表示肝癌细胞增殖能力。
1.5Transwell法分析细胞迁移与侵袭 使用基质胶(侵袭)或不含基质胶(迁移)的Transwell室检测细胞侵袭与迁移能力。收集2.5×105个肝癌细胞Hep3B,重悬于200 μl无血清培养基中,并添加到Transwell上部隔室中。将500 μl含10% FBS的培养基添加到下部隔室中,24 h后取出小室,用棉签擦拭小室上表面的细胞,固定和染色发生侵袭或迁移的肝癌细胞Hep3B,显微镜下统计侵袭或迁移细胞数量。
1.6定量RT-PCR(qRT-PCR)检测LncRNA NBR2、miR-650的表达 通过RNAiso Plus试剂从肝癌细胞Hep3B中提取总RNA,并使用PrimeScript RT试剂盒将其反转录为cDNA。在Bio-Rad CFX96系统中使用SYBR Master Mix和特定引物进行qRT-PCR。用2-ΔΔCt法分析LncRNA NBR2与β-actin的相对水平及miR-650与U6的相对水平。NBR2正向引物5′-GAGGTCTCCAGTTTCGGTAA-3′;反向5′-GAACCAAGGTGAAGGACCAA-3′。β-actin正向引物5′-GACAGGATGCAGAAGGAGATTACT-3′;反向5′-TGATCCACATCTGCTGGAAGGT-3′。miR-650正向引物5′-AGAGGAGGCAGCGCTCT-3′;反向5′-CAGTGCGTGTCGTGGAGT-3′。U6正向5′-CTCGCTTCGGCAGCACA-3′;反向5′-AACGCTTCACGAATTTGC GT-3′。
1.7双荧光素酶活性检测 在starbase软件中预测LncRNA NBR2和miR-650的靶向结合区域。构建含有miR-650结合位点的LncRNA NBR2-野生型(WT)及突变型(MUT)报告基因载体WT(LncRNA NBR2)及MUT(LncRNA NBR2),在肝癌细胞Hep3B细胞中转染miR-NC或miR-650和WT(LncRNA NBR2)或MUT(LncRNA NBR2),在双荧光素酶报告基因检测系统中进行转染48 h后的荧光素酶活性检测。
1.8统计学分析 每个独立实验均重复3次。采用SPSS22.0软件进行单因素方差分析、SNK-q检验、t检验。
2 结 果
2.1葡萄籽提取物原花青素对肝癌细胞Hep3B细胞增殖、迁移和侵袭的抑制作用 见图1、表1。低、中、高剂量组Hep3B细胞中CyclinD1、MMP2、MMP9蛋白表达量、增殖能力、迁移和侵袭数量均显著低于NC组(P<0.05)。
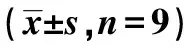
表1 葡萄籽提取物原花青素对肝癌细胞Hep3B细胞增殖、迁移和侵袭的抑制作用
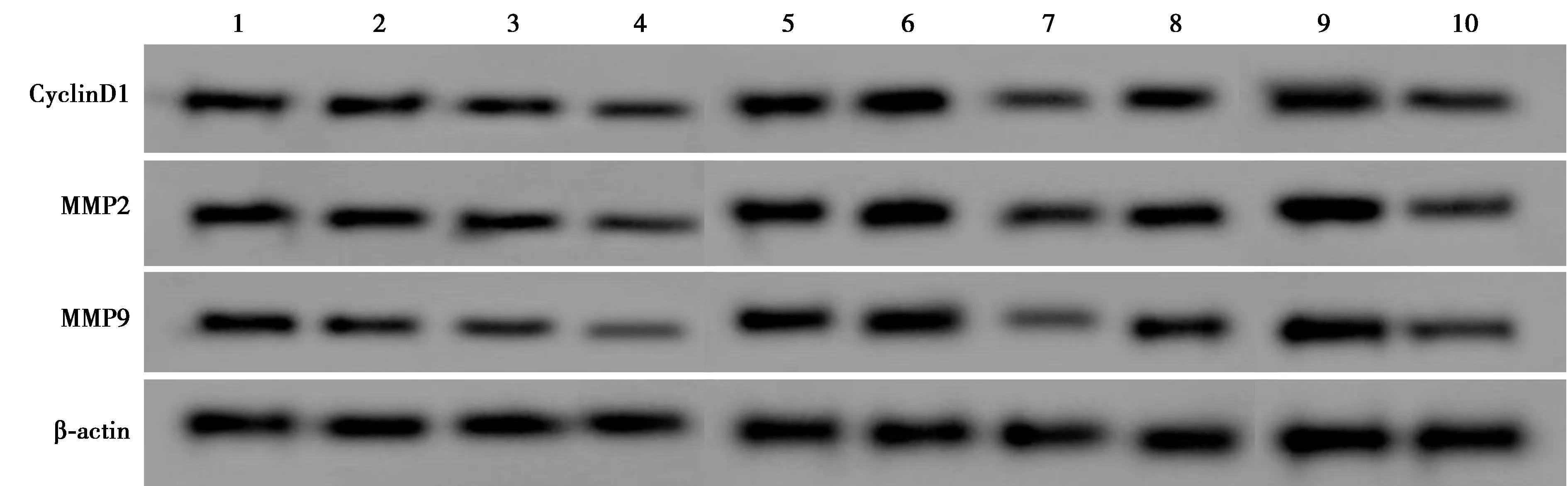
1~10:NC组、低剂量组、中剂量组、高剂量组、si-NC组、si-LncRNA NBR2组、si-NC+高剂量组、si-LncRNA NBR2+高剂量组、anti-miR-NC+si-LncRNA NBR2+高剂量组、anti-miR-650+si-LncRNA NBR2+高剂量组
2.2葡萄籽提取物原花青素处理后LncRNA NBR2上调,miR-650下调表达 见表2,低、中、高剂量组葡萄籽提取物原花青素作用的肝癌细胞Hep3B细胞中LncRNA NBR2表达量分别约为NC组的1.35、1.79、2.37倍,miR-650表达量分别约为NC组的0.89、0.67、0.48倍,低、中、高剂量组与NC组之间的差异有统计学意义(P<0.05)。
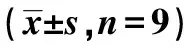
表2 LncRNA NBR2低表达减弱葡萄籽提取物原花青素对肝癌细胞Hep3B细胞增殖、迁移和侵袭的抑制影响
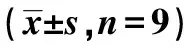
表3 miR-NC或miR-650与报告质粒共转染肝癌细胞Hep3B细胞后双荧光素酶活性检测
2.3LncRNA NBR2低表达减弱葡萄籽提取物原花青素对肝癌细胞Hep3B细胞增殖、迁移和侵袭的抑制影响 见图1、表2。si-LncRNA NBR2组Hep3B细胞中LncRNA NBR2表达量约为si-NC组的0.46倍,CyclinD1、MMP2、MMP9蛋白表达量依次约为si-NC组的1.59、1.52、1.44倍,并且细胞增殖能力、迁移和侵袭数量均比si-NC组高,差异均有统计学意义(P<0.05)。si-LncRNA NBR2+高剂量组Hep3B细胞中LncRNA NBR2表达量约为si-NC+高剂量组的0.56倍,但CyclinD1、MMP2、MMP9蛋白表达量和增殖能力、迁移和侵袭数量均高于si-NC+高剂量组,差异均有统计学意义(P<0.05)。
2.4LncRNA NBR2靶向调控miR-650的表达 starbase对LncRNA NBR2和miR-650结合的预测结果见图2。WT(LncRNA NBR2)荧光素酶活性在miR-NC组与miR-650组之间差异有统计学意义(P<0.05),MUT(LncRNA NBR2)荧光素酶活性在miR-NC组与miR-650组之间差异无统计学意义(P>0.05)。见表3。si-NC组、si-LncRNA NBR2组、pcDNA-NC组、pcDNA-LncRNA NBR2组Hep3B细胞miR-650表达量依次为1.00±0.10、1.88±0.12、1.02±0.09、0.46±0.03,si-NC组与si-LncRNA NBR2组之间、pcDNA-NC组与pcDNA-LncRNA NBR2组之间差异均有统计学意义(P<0.05)。

图2 通过starbase对LncRNA NBR2和miR-650结合进行预测示意
2.5anti-miR-650可以逆转LncRNA NBR2低表达影响葡萄籽提取物原花青素对肝癌细胞Hep3B细胞增殖、迁移和侵袭的作用 见图1、表4。anti-miR-650+si-LncRNA NBR2+高剂量组Hep3B细胞CyclinD1、MMP2、MMP9蛋白、LncRNA NBR2表达量及增殖能力、迁移和侵袭数量均低于anti-miR-NC+si-LncRNA NBR2+高剂量组,差异有统计学意义(P<0.05)。
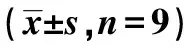
表4 anti-miR-650可以逆转LncRNA NBR2低表达影响葡萄籽提取物原花青素对肝癌细胞Hep3B细胞增殖、迁移和侵袭的作用
2.6EMT通路相关蛋白的表达 见表5、图3。高剂量组或anti-miR-650+si-LncRNA NBR2+高剂量组肝癌细胞Hep3B细胞中E-Cadherin蛋白表达量高于NC组或anti-miR-NC+si-LncRNA NBR2+高剂量组,N-Cadherin、Vimentin蛋白表达量低于NC组或anti-miR-NC+si-LncRNA NBR2+高剂量组,高剂量组与NC组之间、anti-miR-650+si-LncRNA NBR2+高剂量组和anti-miR-NC+si-LncRNA NBR2+高剂量组之间差异有统计学意义(P<0.05),而si-LncRNA NBR2+高剂量组E-Cadherin蛋白表达量低于si-NC+高剂量组,N-Cadherin、Vimentin蛋白表达量高于si-NC+高剂量组,差异有统计学意义(P<0.05)。
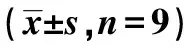
表5 Western印迹检测E-Cadherin、N-Cadherin、Vimentin蛋白的表达
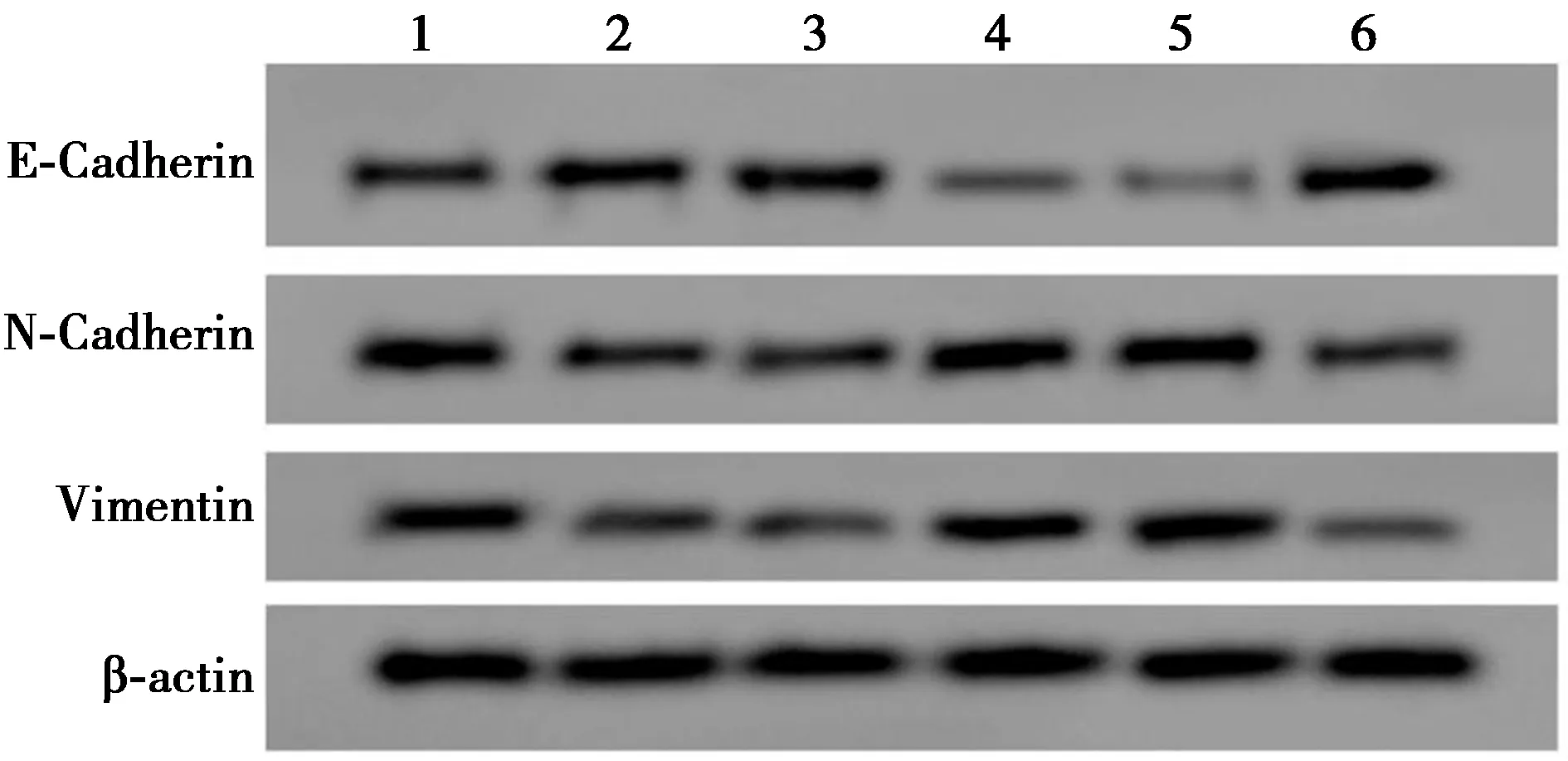
1~6:NC组、高剂量组、si-NC+高剂量组、si-LncRNA NBR2+高剂量组、anti-miR-NC+si-LncRNA NBR2+高剂量组、anti-miR-650+si-LncRNA NBR2+高剂量组
3 讨 论
葡萄籽提取物原花青素拥有抗氧化〔12〕、抗炎〔13〕、降血糖〔14〕、保护心肌〔15〕、抗肿瘤等多种生物学功能〔16〕。最近,葡萄籽提取物原花青素已被证明可以通过调节细胞增殖、周期、凋亡等过程抑制各种癌症的进展〔4~7〕,如葡萄籽中的原花青素被发现以浓度和时间依赖方式抑制骨肉瘤细胞增殖〔17〕。葡萄籽提取物原花青素F2能够减慢胶质瘤细胞生长和血管生成发挥抗肿瘤活性〔18〕。亲脂性葡萄籽原花青素导致前列腺癌PC3细胞增殖受阻,这可以通过减少CyclinD1和CDK4的表达并增加肿瘤抑制因子p21和p27的表达来证实〔19〕。最新研究显示,葡萄籽原花青素抑制肝癌细胞HepG2的生存能力,诱导细胞凋亡和G2/M期细胞周期停滞,并调节细胞周期蛋白B1、MMP水平〔4〕。本研究中,葡萄籽提取物原花青素同样表现出抗肝癌细胞Hep3B增殖的作用。此外,葡萄籽提取物原花青素还可抑制细胞的迁移和侵袭。作为研究较多的MMP,MMP-2和MMP-9以其在癌细胞侵袭和肿瘤转移中的关键作用而备受关注。MMP-2和MMP-9的下调证实了葡萄籽提取物原花青素的肝癌细胞Hep3B迁移、侵袭抑制活性。总之,这些结果表明,葡萄籽提取物原花青素对肝癌具有抑制作用。
LncRNA NBR2已被证明是一种肝癌发生发展的抑制因子〔10〕。根据报道,LncRNA NBR2通过靶向下调miRNA-21抑制大肠癌细胞的迁移和侵袭〔20〕。本研究中,LncRNA NBR2低表达使肝癌细胞Hep3B增殖、侵袭和迁移显著增强,与相关蛋白CyclinD1、MMP2、MMP9蛋白表达的上调相一致,而这些蛋白水平进一步证明了LncRNA NBR2低表达可以促进肝癌细胞Hep3B增殖和转移。这些数据表明,LncRNA NBR2在肝癌中用作抑癌基因,并抑制肝癌细胞Hep3B的增殖,侵袭和迁移,与前人研究〔10〕相符。此外,葡萄籽提取物原花青素可显著增加肝癌细胞Hep3B中LncRNA NBR2的表达。当LncRNA NBR2低表达时,葡萄籽提取物原花青素对肝癌细胞Hep3B的抑制作用被减弱。这些结果表明葡萄籽提取物原花青素通过调节LncRNA NBR2的水平来调节肝癌进程。
本研究生物信息学分析后,miR-650被确定为LncRNA NBR2的靶标。在先前的研究中,miR-650在肝癌中高度上调〔21〕,miR-650表达增加与肝癌患者的不良临床特征密切相关,并且miR-650起促进肝癌细胞迁移、侵袭和上皮间质转化的作用〔22〕。可见miR-650是肝癌的致癌因子,加速肝癌进展。本研究发现,LncRNA NBR2低表达减弱葡萄籽提取物原花青素对肝癌细胞Hep3B细胞增殖、迁移和侵袭的作用可被anti-miR-650所逆转。结合双荧光素酶活性检测和qRT-PCR实验中LncRNA NBR2对miR-650的靶向负调控作用,证明葡萄籽提取物原花青素影响肝癌进程与上调LncRNA NBR2靶向下调miR-650有关。
肿瘤的恶性转化的重要特征之一是细胞的侵袭和转移。EMT是上皮细胞转化为间充质表型细胞的过程,其在癌症转移和多纤维化疾病中起着重要的作用〔23〕。在EMT期间,上皮细胞标志分子E-cadherin被下调,而间质细胞标志物(例如N-cadherin和Vimentin)表达的增加,可能导致细胞侵袭和迁移特性的增强〔24〕。获得间质细胞样特性后,肿瘤细胞可从原发组织扩散开,这是癌症转移的关键步骤〔25〕。因此本研究检查了EMT过程标志蛋白的水平,发现葡萄籽提取物原花青素通过上调E-cadherin、下调N-cadherin和Vimentin水平对肝癌细胞Hep3B的EMT进程起抑制作用。我们进一步研究了LncRNA NBR2/miR-650可能的下游信号通路。正如先前的研究表明,LncRNA NBR2的过表达抑制了骨肉瘤细胞的N-cadherin和VimentinmRNA表达,并增加了肿瘤组织中E-cadherin的mRNA表达〔11〕,此外,N-cadherin和Vimentin在LncRNA NBR2过表达的非小细胞肺癌细胞中被下调,E-cadherin被上调〔23〕,可见LncRNA NBR2可以抑制EMT进展。另外,LncRNA NBR2低表达减弱了葡萄籽提取物原花青素抑制肝癌细胞Hep3B EMT的作用,而这些作用又被anti-miR-650所逆转,这些表明葡萄籽提取物原花青素可以通过LncRNA NBR2调节miR-650有效抑制EMT进程,从而抑制肝癌的发展。
综上,葡萄籽提取物原花青素通过LncRNA NBR2/miR-650途径调节EMT发挥对肝癌进展的抑制作用,这些数据为葡萄籽提取物原花青素抑制肿瘤提供了进一步的证据,并可能为肝癌治疗提供新的见解。未来仍需要进一步的研究来说明葡萄籽提取物原花青素在体内肿瘤模型中的作用。

