蝎毒注射液对AD模型大鼠空间认知障碍改善作用及对海马IGF-1/PI3K/Akt信号通路的影响
范红波 黄欣媛
(1湖北职业技术学院医学基础部,湖北 孝感 432000;2湖北工程学院生命科学技术学院)
阿尔茨海默病(AD)是老年人常见的以渐进性记忆和认知衰退为特征的神经退行性疾病,其发病机制与大脑皮质和海马中β-淀粉样蛋白(Aβ)沉积形成老年斑密切相关〔1〕。AD病因复杂,中药诊治在AD治疗中得到重视。蝎毒是传统中医药材,有镇痛、抗炎、抗肿瘤等药理作用,治疗神经系统疾病已有多年历史。国内已有商品化的蝎毒蛋白药物制品——蝎毒注射液(SVI),目前该药在临床上仅用于镇痛。有研究表明,蝎毒蛋白中的耐热组分——蝎毒耐热蛋白(SVHRP)能够改善AD模型大鼠学习记忆障碍〔2,3〕,研究也发现SVI能够增加AD大鼠皮质及海马脑源性神经营养因子(BDNF)的表达,改善学习记忆能力〔4〕。胰岛素样生长因子(IGF)-1和BDNF在神经保护和营养作用方面有密切联系,IGF-1能促进BDNF分泌,提高BDNF活性,起到更好神经保护的作用〔5〕。IGF-1主要通过磷脂酰肌醇-3激酶(PI3K)/蛋白激酶B(Akt)信号通路向胞内传递信号,促进神经元及胶质细胞增生及分化,其异常表达与AD关系密切〔6〕。本研究考察SVI对AD模型大鼠海马中IGF-1/PI3K/Akt信号通路的影响,研究SVI改善AD大鼠认知功能的分子机制。
1 材料与方法
1.1主要试剂 SVI购自通化卫京药业股份有限公司(批号:20150802,蝎毒蛋白含量为10 μg/ml),Aβ25~35为Sigma公司产品,IGF-1、PI3K、Akt、p-Akt(Ser473)和β-肌动蛋白(actin)一抗均为Abcam公司产品,辣根过氧化物酶(HRP)标记二抗购自武汉博士德生物工程有限公司,Trizol试剂和逆转录试剂盒为Invitrogen公司产品,二喹啉甲酸(BCA)蛋白定量检测试剂、增强化学发光(ECL)试剂及聚合酶链反应(PCR)引物均为上海生工生物公司产品。
1.2实验动物分组 6~7周龄SPF级健康雄性SD大鼠,体质量(230±20)g,购于湖北省实验动物中心。在温度20~23 ℃、相对湿度(50±5)%环境下,自由饮食和饮水适应性饲养7 d,编号后按照随机数字表分为5组:假手术对照组,AD模型组及SVI低、中、高剂量干预组,每组12只。
1.3AD模型制作与SVI干预 参照文献〔7〕报道的方法制备AD模型大鼠,即采用脑立体定位仪在大鼠双侧海马区定位(前囟后3.3 mm,旁开1.8 mm,颅骨表面下3.5 mm)注射5 μg/μl的Aβ25~35溶液2 μl,10 min内缓慢注射完,留针5 min。假手术对照组注射2 μl无菌生理盐水。于AD造模完成后24 h开始腹腔注射SVI,每日1次,连续10 d。SVI低、中、高剂量组SVI注射量分别为5、10、20 μg/kg。选用SVI中剂量组为后续实验SVI干预组。
1.4Morris水迷宫实验检测大鼠的认知能力 于SVI干预治疗完毕次日开始对5组进行定位航行实验,持续5 d。将水迷宫圆形水池分为4个象限,逃生平台置于其中一个象限内。每只大鼠固定时间训练2次/d,记录其入水后120 s内找到水下逃生平台所用的时间,即逃避潜伏期,检测大鼠学习和记忆能力。第6天撤去逃生平台,进行空间探索实验,记录各组入水后120 s内穿过原平台区域的次数及在原平台所在象限游泳的时间,检测大鼠对平台空间位置的记忆保持能力。
1.5免疫组织化学法测定海马中IGF-1表达 水迷宫实验结束后,对假手术对照组、AD模型组和SVI干预组进行海马组织取材。每只大鼠腹部注射10%水合氯醛(4 ml/kg)进行麻醉,脱颈椎处死后立即取全脑,置于冰皿上剥离两侧海马组织,其他组织置于-80 ℃冰箱保存。每组随机选取3只进行免疫组化实验。将海马组织置于4%多聚甲醛中浸泡固定24 h,30%蔗糖溶液脱水,石蜡包埋,恒冷箱切片机连续切5 μm厚度的薄片。磷酸盐缓冲液(PBS)冲洗3次,5 min/次,加入羊抗大鼠IGF-1一抗(1∶500),4 ℃湿盒中孵育过夜。PBS冲洗3次,加入HRP标记的二抗(1∶2 000),37 ℃湿盒中孵育1 h,PBS漂洗3次,二氨基联苯胺(DAB)显色试剂避光反应30 min,PBS冲洗,二甲苯透明,中性树胶封片,显微镜下观察并拍片,IGF-1免疫阳性反应的细胞呈棕褐色。每只大鼠选取5张照片,每张取海马CA1区中段3个视野,运用ImageJ 1.52v图像分析软件测定阳性细胞的平均光密度。
1.6RT-PCR法检测海马中IGF-1、PI3K和Akt的mRNA表达 按1.5方法获取大鼠海马组织,用Trizol试剂提取总RNA,超微量分光光度计测定RNA浓度和纯度,利用反转录试剂盒反转录成cDNA,再以之为模板,实时定量PCR扩增反应检测IGF-1、PI3K和Akt的mRNA表达量变化,内参为β-actin。基因特异性引物分别为:IGF-1上游引物:5′-GCACTCTGCTTGCTCACCTTTA-3′,下游:5′-TCCG-AATGCTGGAGCCATA-3′,扩增片段长148 bp。PI3K上游引物:5′-AGCTGGTCTTCGTTTCCTGA-3′,下游:5′-GAAACTTTTTCCCACCACGA-3′,扩增片段长165 bp。Akt上游引物:5′-TCCTGCACCTGGAGCT CTGTTA-3′,下游:5′-CTCAGGGCAGCAGGACATGTAG-3′,扩增片段长199 bp。β-actin上游引物:5′-GAGACCTACAAGACCCCAGCC-3′,下游:5′-TCGGCGCATCGGTACCGCTCA-3′,扩增片段长183 bp。PCR条件为95 ℃预变性5 min;95 ℃变性20 s,56 ℃退火30 s,72 ℃延伸30 s,39个循环;72 ℃延伸8 min。用2-ΔΔCt法分析目的基因较内参基因β-actin相对表达水平。
1.7Western印迹法检测海马中PI3K、Akt、p-Akt(Ser473)蛋白表达 按1.5方法获取各组海马组织剪碎后加入含苯甲基磺酰氟(PMSF)的RIPA裂解液,冰浴中匀浆提取总蛋白,BCA法定量测定蛋白浓度,根据浓度确定上样量,进行12%分离胶的十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳(PAGE),条带转移到聚偏氟乙烯(PVDF)膜上,5%脱脂奶粉4 ℃封闭过夜,根据分子量大小剪膜后各加入相应的IGF-1(1∶2 000)、PI3K(1∶2 000)、Akt(1∶1 500)、p-Akt(1∶2 000)、β-actin(1∶2 000)一抗,室温下摇动孵育2 h,等渗缓冲盐溶液(TBST)清洗,加入HRP标记二抗(1∶2 000),室温摇动孵育2 h,TBST清洗,ECL试剂盒显色,化学发光成像仪检测记录结果。ImageJ v1.52图像软件分析条带的灰度。蛋白相对表达水平用目的蛋白条带与内参β-actin条带灰度的比值来表示。
1.8统计学分析 采用GraphPad Prism8软件,各组数据之间的差异性采用单因素方差分析,组间均数比较采用t检验。
2 结 果
2.1Morris水迷宫实验结果 与假手术对照组比较,AD模型组逃避潜伏期延长,平台穿越次数显著减少(P<0.01)。SVI低、中、高剂量组,第1~5天逃避潜伏期均显著少于AD模型组,平台穿越次数和目标象限停留时间显著多于AD模型组(P<0.01)。见表1。
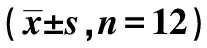
表1 各组学习记忆能力比较
2.2免疫组织化学检测IGF-1含量 AD模型组平均光密度值(22.52±4.89)明显低于假手术对照组(45.46±5.92);SVI干预组(38.96±5.58)明显高于AD模型组(均P<0.05),但与假手术对照组比较,差异无统计学意义(P>0.05)。见图1。
图1 免疫组化分析各组海马中IGF-1表达(DAB染色,×400)
2.3IGF-1、PI3K与Akt mRNA和蛋白表达 AD模型组和SVI干预组IGF-1和PI3K mRNA相对表达水平均显著低于假手术对照组,SVI干预组IGF-1、PI3K和Akt mRNA相对表达水平明显高于AD模型组(P<0.05);与假手术对照组相比,AD模型组和SVI干预组PI3K、Akt与p-Akt(Ser473)蛋白表达量均显著下降(P<0.05)。与AD模型组比较,SVI干预组PI3K、p-Akt(Ser473)、p-Akt/Akt蛋白表达水平显著增加(P<0.05)。见图2、表2。
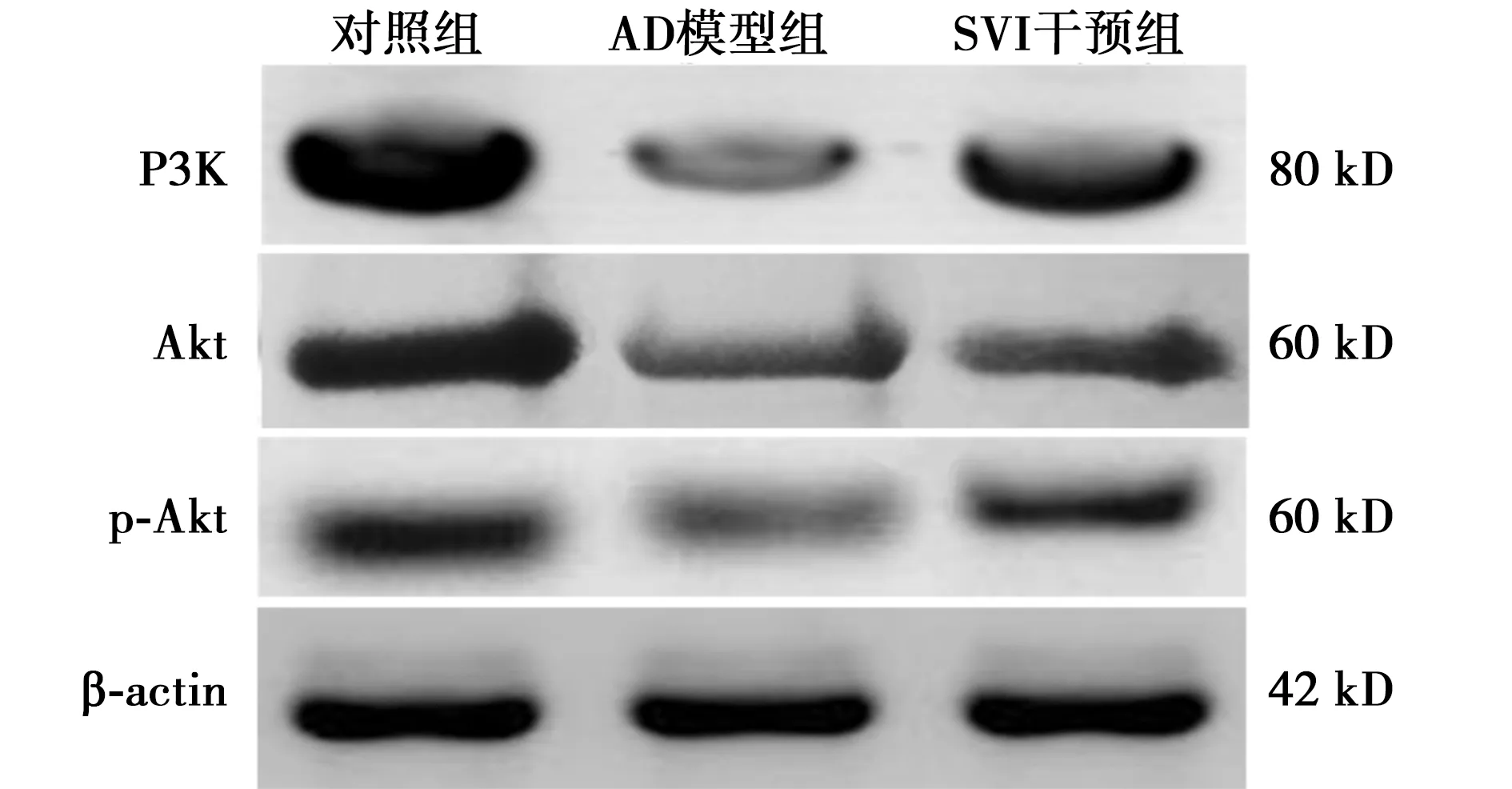
图2 各组海马组织中PI3K/Akt信号通路相关蛋白表达
表2 各组海马组织内IGF-1、PI3K和Akt mRNA及蛋白表达水平比较
3 讨 论
AD在65岁以上老年人中发病率高达1%~2%,85岁以上3.35%〔1〕,因而阐明AD发病机制对其预防和治疗具有重要意义〔2〕。SVHRP还可通过抑制小胶质细胞介导的炎性反应或抑制神经元型一氧化氮合酶活性,或上调海马组织BDNF表达水平,分别对帕金森症、癫痫等疾病发挥改善作用〔2,3,8,9〕,但具体作用机制尚未十分明确。蝎毒对神经系统疾病展现出潜在的治疗价值,需阐明其作用机制,为临床应用提供理论依据。
本研究Morris水迷宫实验与于胜波等〔2,10〕研究结果类似。该研究发现SVHRP可抑制Aβ引起的突触密度降低和突触退变,削弱Aβ对AD模型大鼠学习记忆能力的损害。Zhang等〔11〕也报道了SVHRP对表达人Aβ1~42的转基因秀丽隐杆线虫的毒性缓解和神经保护作用,提示蝎毒有成为治疗AD药物的潜力。
在中枢神经系统中,IGF-1是一种多肽类神经营养因子,广泛表达于神经元及胶质细胞,具有神经保护作用。IGF-1及其下游信号通路是预防或治疗认知功能减退的潜在靶点〔12〕。在大脑中,IGF-1与其受体结合后,主要通过激活PI3K/Akt信号途径来参与调控神经细胞的生长代谢、突触可塑性和神经组织修复,其异常表达与AD密切相关〔6,13,14〕。PI3K/Akt信号途径被激活后,至少可通过以下途径阻止AD的恶化:使下游的糖原合成酶激酶(GSK)-3β被磷酸化,活性降低,减少tau蛋白过度磷酸化〔12〕;同时激活丝裂原活化蛋白激酶(MAPK)/细胞外调节蛋白激酶(ERK)1/2信号通路,降低细胞中β-淀粉样前体蛋白裂解酶(BACE)-1的表达,从而减少Aβ的生成和沉积〔15〕。AD患者和AD模型大鼠大脑中IGF-1水平降低,提升内、外源IGF-1水平能改善AD模型鼠的认知功能,IGF-1已成为治疗AD的神经保护剂〔12,14,16〕。本研究结果说明,IGF-1/PI3K/Akt信号通路被抑制,与有关研究结果一致〔17〕。而给予AD大鼠SVI治疗后,说明SVI能活化IGF-1/PI3K/Akt信号通路,有助于AD治疗。

