阿霉素联合维替泊芬通过调节YAP蛋白对人口腔鳞癌HSC-4细胞增殖和周期的作用
崔颀 江瑾 周娟 王芳
(青岛大学 1附属青岛市口腔医院牙周科,山东 青岛 266001;2附属青岛市中心医院口腔科;3附属青岛市口腔医院药剂科)
口腔鳞状细胞癌是人口腔颌面部最易好发的恶性肿瘤之一〔1〕。口腔鳞癌是一种多因素疾病,涉及多种细胞信号通路。研究表明Hippo/Yes相关蛋白(YAP)在口腔鳞癌、肝癌、胆囊癌等多种肿瘤细胞的增殖、生长和分化相关机制中发挥着重要作用〔2~4〕。阿霉素(ADM)可以抑制口腔鳞状细胞癌细胞增殖、迁移和侵袭〔5〕。维替泊芬(VEP)是一种YAP靶向抑制剂,可破坏YAP-TEAD的相互作用。研究证明,VEP依赖于YAP信号具有抗肿瘤疗效〔6〕。本研究旨在探讨ADM联合VEP通过YAP蛋白对口腔鳞癌细胞HSC-4增殖和周期的调节作用。
1 材料与方法
1.1材料与试剂 HSC-4细胞购于中国科学院上海细胞库;VEP、ADM购于上海阿拉丁生化科技股份有限公司;胎牛血清购于美国Gibco公司;双抗购于浙江天航生物科技股份有限公司;DMEM高糖培养基、胰蛋白酶购于赛默飞世尔生物化学有限公司;四甲基偶氮唑蓝(MTT)、二甲基亚砜(DMSO)购于美国Sigma公司;细胞周期试剂盒购于南京凯基生物科技发展有限公司;RNA提取试剂盒、反转录试剂盒和RT-qPCR试剂盒购于日本Takara公司;二喹啉甲酸(BCA)蛋白定量检测试剂盒购于北京索莱宝科技有限公司;RIPA裂解液购于上海碧云天生物技术有限公司;所有抗体购于美国Cell Signaling Technology公司。
1.2细胞培养 将人口腔鳞癌细胞HSC-4培养在含10%胎牛血清和青霉素-链霉素双抗的DMEM高糖培养基中,置于37 ℃、5%CO2的培养箱中。每隔2~3 d传代1次,取生长对数期细胞用于后续实验。
1.3MTT检测细胞存活率 胰酶消化细胞,制备单细胞悬液,细胞以5×103个/孔接种于96孔培养板中。设置空白组、对照组、ADM组、VEP组。培养24 h后,加入不同浓度ADM(4.0、2.0、1.0、0.5 μg/ml、VEP(4.0、2.0、1.0、0.5 μg/ml),继续培养24、48、72 h。培养结束前,每孔加入20 μl的MTT溶液〔5 mg/ml溶于磷酸盐缓冲液(PBS)〕,继续置于37 ℃恒温箱中孵育4 h。吸去上清液后,每孔加入150 μl DMSO随后震荡10 min溶解蓝色结晶。用酶标仪在490 nm波长下测量其吸光度值。
1.4细胞分组 后续实验随机分为对照组、ADM组(1.0 μg/ml)、VEP组(2.0 μg/ml)、ADM(1.0 μg/ml)+VEP(2.0 μg/ml)组。
1.5流式细胞仪检测细胞周期 各组细胞培养48 h,收集细胞,PBS洗涤,离心弃上清,重悬细胞加入预冷的70%乙醇,4 ℃固定过夜,PBS洗涤,加入核糖核酸酶(RNase)A,37 ℃孵育30 min,加入碘化丙啶(PI)染色液,避光染色15 min,上机检测,用流式细胞仪和 DNA 细胞周期分析软件对细胞周期进行分析。
1.6实时荧光定量聚合酶链反应(RT-qPCR)检测YAP mRNA表达水平 各组细胞培养48 h,收集细胞,加入Trizol裂解细胞,提取细胞总RNA,反转录合成cDNA,按照荧光定量试剂盒使用说明进行PCR扩增,相对表达量采用2-△△Ct法计算。YAP以β-actin为内参,YAP上游引物:5′-TAGCCCTGCGTAGCCAGTTA-3′,下游:5′-TCATGCTTAGTCCACTGTCTGT-3′;β-actin上游引物:5′-TCCTGGATGTTGTGTGTATCGAGAG-3′,下游:5′-ACTTGCGCGTCACAGGACAG-3′。
1.7Western印迹检测cyclinB1、cdc2、YAP蛋白表达 各组细胞培养48 h,收集细胞,加入RIPA裂解液裂解细胞,提取细胞总蛋白,BCA蛋白定量试剂盒测试蛋白浓度,加入上样缓冲液,100 ℃煮沸5 min。将30 μg蛋白上样进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,切胶、转到聚偏氟乙烯(PVDF)膜。PVDF膜用5%脱脂牛奶封闭1 h,TBST洗涤3次,加入一抗4 ℃孵育过夜: 细胞周期蛋白(cyclin)B1(1∶1 000)、细胞分裂周期蛋白(cdc)2(1∶1 000)、YAP(1∶1 000)和β-actin(1∶2 000),TBST洗膜3次,加入二抗孵育1 h,TBST洗涤3次,ECL发光,凝胶成像系统曝光。蛋白相对表达水平=目的条带灰度值/β-actin条带灰度值。
1.8统计学分析 采用SPSS20.0软件进行t检验、方差分析。
2 结 果
2.1各组HSC-4细胞增殖 ADM作用24、48、72 h后,HSC-4细胞存活率随着药物浓度的增高而降低,呈现ADM浓度依赖性和时间依赖性(P<0.05)。1.0 μg/ml ADM作用3个时间点后,HSC-4细胞存活率在作用48 h时为70%左右,但是72 h细胞存活率在50%左右,而且72 h培养基营养可能不够,不适于后期的实验,因此选择1.0 μg/ml ADM作用48 h进行后续实验。见表1。随着VEP浓度的增高而降低,呈现VEP浓度依赖性和时间依赖性(P<0.05)。选择2.0 μg/ml VEP作用48 h进行后续实验。见表2。MTT结果显示,与对照组比较,ADM组、VEP组和ADM+VEP组可以明显抑制HSC-4细胞增殖(P<0.01)。ADM+VEP组细胞存活率明显低于ADM组和VEP组(P<0.01)。见表3。
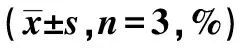
表1 不同浓度ADM对细胞增殖活性的影响
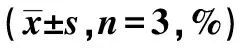
表2 不同浓度VEP对细胞增殖活性的影响
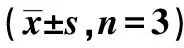
表3 ADM和VEP对细胞增殖活性、周期中各期细胞所占比例、cyclinB1、cdc2、YAP mRNA及蛋白的影响
2.2各组HSC-4细胞周期 与对照组比较,ADM组、VEP组和ADM+VEP组可以使HSC-4细胞的G2/M期细胞比例明显增多(P<0.05)。ADM+VEP组G2/M期细胞比例分别明显高于ADM组、维替泊芬组。见表3、图1。
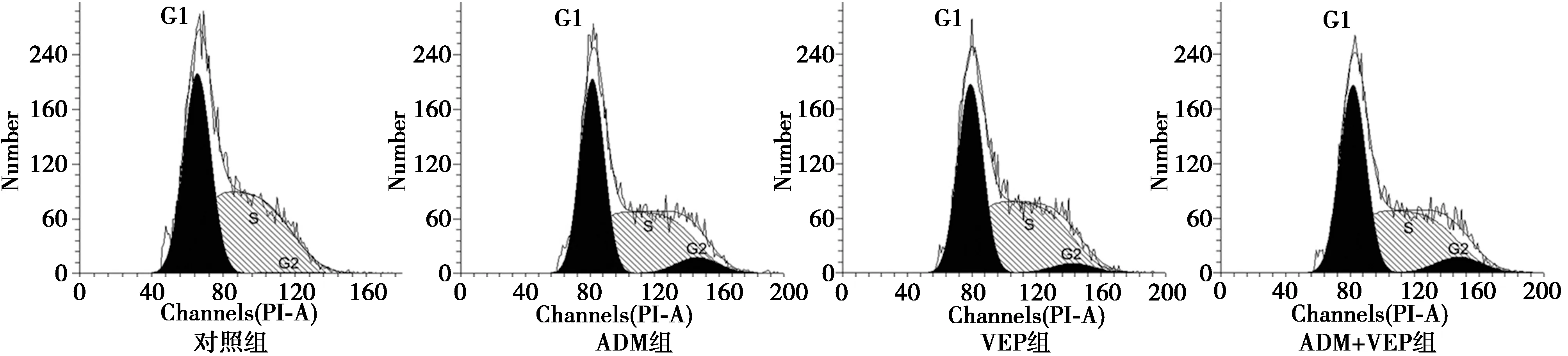
图1 4组HSC-4细胞周期
2.3各组HSC-4细胞YAP mRNA表达 与对照组比较,ADM组、VEP组和ADM+VEP组可以使HSC-4细胞的YAP mRNA表达水平明显下降(P<0.05,P<0.01)。ADM+VEP组YAP mRNA明显低于ADM组和VEP组(P<0.05)。见表3。
2.4各组HSC-4细胞蛋白表达水平 与对照组比较,ADM组、VEP组和ADM+VEP组可以使HSC-4细胞的cyclinB1、cdc2、YAP蛋白表达水平明显下降(P<0.05)。ADM+VEP组三种蛋白相对表达量明显低于ADM组和VEP组(P<0.05)。见表3、图2。
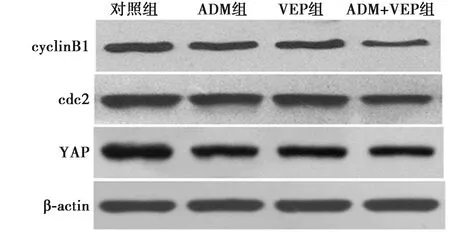
图2 HSC-4细胞cyclinB1、cdc2、YAP 蛋白表达
3 讨 论
口腔鳞状细胞癌是世界上第6大常见癌症〔7〕。由于口腔鳞癌是一种严重复杂的疾病,因此使用单一方法进行治疗通常效果不佳。在临床上,通常采用两种药物进行合用,旨在扩大治疗作用,减少副作用,同时还要降低甚至避免药物相互作用的风险〔8〕。ADM是临床上常用的抗癌药物之一,广泛应用于胶质瘤、乳腺癌、头颈部鳞癌、胃癌等肿瘤的治疗,具有抗瘤谱广、疗效好的特点〔9,10〕。Ling等〔11〕研究表明,ADM诱导白血病P388细胞的细胞毒性是细胞周期依赖的,至少部分是通过干扰p34cdc2/cyclinB1复合物的调控,从而导致G2/M期阻滞。Tyagi等〔12〕研究显示,ADM能有效抑制前列腺癌LNCaP细胞的生长,通过抑制cdc25C、cdc2/p34、cyclinB1蛋白表达和cdc2/p34激酶活性使细胞周期阻滞在G2/M期。众所周知,YAP靶向抑制剂VEP是一种用于光动力疗法的光敏剂,可用于消除与黄斑变性等病症相关的眼内异常血管。近期研究显示,VEP作为非光敏剂具有显著的抗肿瘤作用〔13〕。Liu等〔14〕研究结果说明,维替泊芬显著抑制头颈部鳞状细胞癌细胞SCC-4和SCC-25增殖、迁移和侵袭,并将细胞周期阻滞在G2期。
Hippo-YAP 信号通路已被证实在多种恶性肿瘤的发生、发展过程中作用显著〔15〕。YAP作为Hippo通路的核心效应蛋白,可以促进多种肿瘤细胞的增殖、侵袭和转移〔16〕。Huo等〔17〕研究表明,ADM通过抑制YAP表达可诱导肝癌细胞凋亡。Ma等〔18〕研究证实,YAP的下调增加了癌细胞对低剂量ADM治疗的敏感性,导致癌细胞凋亡。Wei等〔19〕研究表明,VEP通过破坏YAP-TEAD复合物抑制胰腺导管腺癌的细胞存活和血管生成。Morice等〔20〕研究证实,VEP通过降低YAP的表达、YAP/转录增强相关结构域(TEAD)转录活性来抑制骨肉瘤的肿瘤生长。
综上,ADM联合VEP通过诱导细胞周期停滞于G2/M期抑制口腔鳞癌HSC-4细胞增殖,这种抑制效应与cyclinB1、cdc2及YAP表达下调有关。

