基于JAK-STAT信号通路探讨首乌益智胶囊对血管性认知障碍神经保护机制
宁家辉 王蕾 衣红杰 韩雪 孙旭
(山东中医药大学 1中医学院,山东 济南 250014;2第二附属医院神经内科)
血管性认知障碍(VCI)是一类严重危害人类健康的重大疾病〔1〕。VCI的病理机制十分复杂,主要包括缺血、缺氧诱导的细胞应激事件、炎性反应及继发的神经元损伤和凋亡〔2〕。若长时间不能恢复细胞内环境稳态,终将导致神经元大量丢失,加重认知障碍进展与恶化。
p-Janus蛋白酪氨酸激酶(JAK)-信号转导与转录激活因子(STAT)信号通路是近年来新发现的一条细胞内信号转导途径,与细胞增殖、分化、凋亡等过程密切相关〔3〕。其主要作用于基因表达的调控,是多种细胞因子的下游调控途径〔4〕。JAK-STAT通路蛋白广泛存在于海马及大脑皮层,参与海马缺血损伤修复、神经细胞增殖等多种细胞活动〔5〕。同时,JAK-STAT通路的激活是多种神经营养因子发挥神经保护作用的基础。研究显示,JAK-STAT通路可促进突触可塑性,在海马神经突触的N-甲基-D-天冬氨酸(NMDA)依赖突触长时程增强机制中发挥促进作用〔6〕。有研究显示首乌益智胶囊具有促神经细胞增殖、抑制神经细胞凋亡等多种神经保护作用〔7,8〕,可改善VCI患者学习、记忆能力,临床功效显著。本实验采用大脑中动脉缺血再灌注(MCAO)法建立VCI大鼠模型,探讨首乌益智胶囊对VCI大鼠的治疗效果及其神经保护机制,为完善首乌益智胶囊的作用机制提供实验依据。
1 材料与方法
1.1动物 SPF级SD大鼠50只,体质量(350±20)g,雌雄各半。大鼠均饲养在(25±1)℃无菌环境中,12 h光照/12 h黑暗周期,自由进食和饮水。
1.2分组及给药 取40只大鼠随机分为假手术组、VCI模型组、首乌益智胶囊组及尼莫地平组,每组10只。采用MCAO法对除假手术组外的大鼠进行造模,将首乌益智胶囊(山东中医药研究院,批号:鲁药制字 Z20110015)制成40 mg/ml的悬浊液,给首乌益智胶囊组进行灌胃(1 ml/100 g),1次/d。将尼莫地平片(尼膜同,拜耳医药保健有限公司,批号:国药准字 H20003010)制成30 mg/ml悬浊液,给尼莫地平组进行灌胃(1 ml/100 g),1次/d。模型组及假手术组给予等量生理盐水灌胃,共14 d。14 d后,各组进行水迷宫实验,21 d处死大鼠,进行组织学观察。
1.3VCI大鼠模型的制作 MCAO法建立VCI大鼠模型。5%水合氯醛4 ml/kg腹腔注射麻醉后,固定大鼠颈前正中切口,分离暴露左侧颈总动脉、颈内外动脉。将尼龙缝合线于颈总动脉至颈内动脉分叉处导入,沿颈内动脉向大鼠颅内推进,穿过大脑中动脉起始端,直至大脑前动脉近端。结扎颈内动脉,缝合切口,留取1 cm拴线尾端。缺血90 min后外拉拴线至颈内动脉,缝合切口。假手术组在不结扎、栓塞的情况下进行相同手术。
1.4Morris水迷宫测试 于暗室中央放置圆形水池,距水面2 cm,不可见处固定平台,实验前对大鼠进行4 d适应性训练。正式测试时,将大鼠于距原平台最远处放下,120 s内记录大鼠找到平台时间(逃逸潜伏时间)。24 h后,撤去平台,于相同位置放下大鼠,120 s内记录大鼠过平台次数。
1.5透射电镜观察 干预14 d,每组随机取5只大鼠,5%水合氯醛间断腹腔注射法麻醉,4%多聚甲醛灌注,迅速断头剥离脑组织,在冰盒上沿冠状位分离出海马组织(1 mm3)数块,进行固定、蔗糖溶液脱水、20 μm超薄切片,每只大鼠取5张玻片醋酸铀-硝酸铅双重染色,日立-H765透射电镜观察大鼠脑组织海马神经元超微结构。
1.6Western印迹检测p-JAK2、p-STAT3及JAK2、STAT3 蛋白表达 每组取剩余5只大鼠,5%水合氯醛间断腹腔注射法麻醉,分离海马组织后置于液氮中保存,检测时,将冰冻组织转入匀浆缓冲液,加入蛋白酶抑制剂,离心后取上清液,二喹啉甲酸(BCA)蛋白分析试剂盒测定总蛋白浓度,经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)后,转移至聚偏氟乙烯膜上,p-JAK2、p-STAT3及JAK2、STAT3一抗孵育一夜,洗涤3次,二抗孵育2 h,检测蛋白表达。
1.7统计学方法 采用SPSS26.0软件进行双因素方差分析。
2 结 果
2.1各组Morris水迷宫测试 与假手术组比较,模型组、尼莫地平组及首乌益智胶囊组逃避潜伏期明显延长,过站台次数明显减少(P<0.01)。与模型组比较,尼莫地平及首乌益智胶囊组逃避潜伏期明显缩短,过站台次数明显增加(P<0.05,P<0.01)。与尼莫地平组比较,首乌益智胶囊组逃避潜伏期明显缩短,过站台次数明显增加(P<0.01)。首乌益智胶囊可以保护MCAO大鼠免受缺血缺氧造成的认知损害,改善大鼠的认知能力。见表1。

表1 各组Morris 水迷宫测试及海马组织JAK2、p-JAK2、STAT3、p-STAT3蛋白表达
2.2各组JAK-STAT信号通路相关蛋白表达比较 与假手术组比较,模型组、尼莫地平组及首乌益智胶囊组海马JAK2、p-JAK2、STAT3、p-STAT3蛋白表达均显著升高(P<0.01)。与模型组比较,首乌益智胶囊组JAK2蛋白表达显著升高,尼莫地平组及首乌益智胶囊组p-JAK2、STAT3、p-STAT3蛋白表达显著升高(P<0.05,P<0.01)。与尼莫地平组比较,首乌益智胶囊组JAK2、p-JAK2、STAT3、p-STAT3蛋白表达显著升高(P<0.05)。首乌益智胶囊可以通过JAK-STAT信号通路发挥神经保护作用。见表1。
2.3各组海马神经元结构观察 透射电镜观察发现,假手术组海马神经元结构完整,胞质内线粒体、内质网等细胞器结构完整,细胞核结构清晰,染色质均匀分布。模型组海马神经元结构不规整,细胞核表面较粗糙,核内结构紊乱不齐,染色质轻度凝聚,胞质内线粒体部分肿胀变性,尼氏体、内质网数量减少,胞质内可见部分空泡。尼莫地平组海马神经元结构尚规整,细胞核表面部分粗糙,核内结构尚完整可见,少量线粒体肿胀,内质网结构尚清晰,有轻度扩张。首乌益智胶囊组海马神经元细胞核结构清晰,核膜光滑,双层核膜可辨,胞质中线粒体、内质网、微管等细胞器结构完整且清晰可见,尼氏小体清晰,首乌益智胶囊可保护VCI大鼠损伤的神经元,维持神经元结构的完整性。见图1。
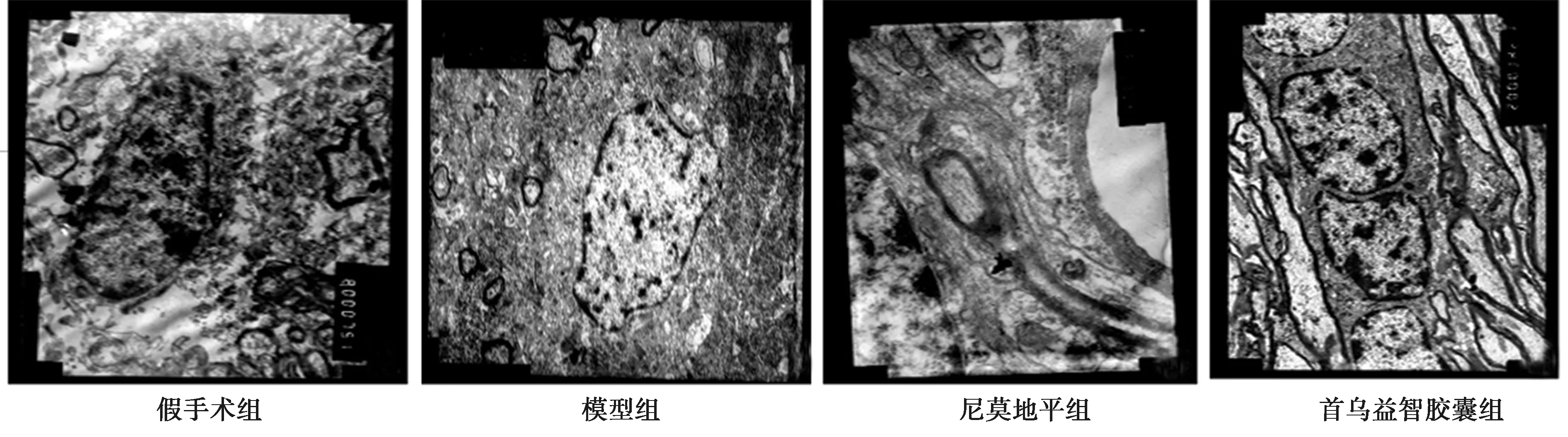
图1 各组海马神经元超微结构(×4 000)
3 讨 论
当下,VCI病理机制尚不明确,基于不同发病机制,各类造模方法层出不穷。MCAO是目前常用的VCI模型之一,通过模拟海马等关键部位梗死使大鼠出现认知障碍。相较其他造模方案,MCAO可更好地模拟神经元变性与凋亡、炎性反应、氧化应激等严重脑组织损伤〔9,10〕。首乌益智胶囊由制首乌、益智仁、黄芪、天麻、丹参、地龙、远志、川芎等组成,采用补肾填精益气、祛瘀化痰通窍之法,使肾精得充,瘀血得祛,血脉通畅〔7〕。本研究结果表明,首乌益智胶囊可显著改善MCAO大鼠的记忆、学习能力。研究发现,大鼠海马组织与空间记忆、学习能力息息相关,而缺血再灌注损伤造成的海马神经元凋亡是认知能力损伤的主要因素〔11〕。本研究结果表明,首乌益智胶囊可保护受损伤的神经元,维持神经元结构完整,抑制神经细胞的坏死与凋亡。
首乌益智胶囊的神经保护作用涉及多种活性成分及反应机制。二苯乙烯苷是何首乌的特异性活性物质,在各类脑器质性病变中起到神经保护作用,可挽救突触并抑制大脑中α-突触核蛋白过表达,从而改善其记忆和运动功能〔9〕。圆柚酮为益智仁主要活性成分,可作用于α-2a 肾上腺素能受体,进而生成脑源性神经营养因子,发挥抗神经细胞凋亡,促进神经再生的效用〔12〕。黄芪、天麻富含多种甾体类、多糖类成分,其与促进神经细胞增殖、抑制炎性反应等具有广泛联系,可促进表皮细胞生长因子(EGF)、血管内皮细胞生长因子受体(VEGFR)2等内皮生长因子表达,促进细胞增殖与代谢,同时使衰老、受损细胞存活〔13〕。丹参、地龙、川芎可有效提高脑血流量,并刺激一氧化氮合酶(NOS)3的生成,促进血管扩张及抑制动脉粥样硬化斑块的形成,从而发挥血管保护及促血液流通作用〔14〕。本研究通过JAK-STAT信号通路证实,首乌益智胶囊对MCAO大鼠具有神经保护作用。
JAK-STAT信号通路是近年研究细胞存活、增殖、分化的重点通路,先前众多研究显示中枢神经系统损伤的修复与JAK-STAT通路的激活有关。JAK2 是JAKs家族中的重要组成部分之一,JAK2蛋白广泛存在于大鼠神经元与少数胶质细胞内,其激活与炎性因子〔肿瘤坏死因子(TNF)-α、白细胞介素(IL)-6等〕和生长因子〔EGF、血小板衍生生长因子(PDGF)等〕密切相关。最初,JAK2通过细胞膜受体结合作用磷酸化。随后,p-JAK2激活细胞质中STAT3,从而导致STAT3的二聚化,p-STAT3易位至细胞核,与特定元素结合,然后转录各种靶基因发挥作用〔15〕。研究显示,STAT3可促进神经干细胞的增殖与分化,抑制炎性反应,同时抑制神经细胞凋亡。研究发现,JAK-STAT信号通路可影响恶性NK细胞的细胞周期停滞与凋亡〔16〕,保护新生神经元。本研究结果证明,首乌益智胶囊通过激活JAK-STAT信号通路发挥促神经元增殖、维持神经元结构完整、抑制神经元凋亡等神经保护作用。
综上,首乌益智胶囊可显著改善脑缺血再灌注损伤后海马神经元凋亡引起的认知障碍,同时激活JAK-STAT信号通路,促进神经元增殖,抑制神经元凋亡,减轻炎性反应,从而发挥神经保护作用。

