鸢尾素通过调控内质网应激抑制脂多糖诱导的THP-1巨噬细胞炎症反应
符宗冬 李鸽 林雪娟 陈丽君,2 张大启,2 李其富,2 廖小平 赵文杰
(1海南医学院第一附属医院神经内科,海南 海口 570102;2海南省热带脑科学研究与转化重点实验室)
炎症与许多老年慢性疾病的发生发展密切相关,如动脉粥样硬化、心脑血管疾病、糖尿病、帕金森病和阿尔茨海默病等〔1〕,而巨噬细胞及其免疫网络在慢性炎症过程中发挥重要作用,深入研究并筛选基于调控巨噬细胞过度活化的分子靶点,对许多慢性疾病的预防与治疗有积极意义。鸢尾素(Irisin)作为一种新近发现的糖基化蛋白,已被证实可改善运动并参与糖脂代谢〔2〕。近年研究发现,糖尿病和慢性肾脏疾病患者血清Irisin水平明显下降,且其水平与炎症因子水平之间存在相关性〔3〕。此外,Irisin还可明显减轻脂多糖(LPS)诱导的炎症〔4〕,然而其分子抗炎机制仍不十分清楚。
本研究通过检测Irisin对LPS诱导的人髓系白血病单核细胞(THP)-1、巨噬细胞分泌的白介素(IL)-6、IL-1β和肿瘤坏死因子(TNF)-α水平、细胞线粒体膜电位(MMP)和活性氧(ROS)水平及其对内质网应激(ERS)和核转录因子(NF)-κB信号通路的影响,探索Irisin是否可通过调控ERS改善巨噬细胞炎症,为其作为分子靶点预防和治疗慢性炎症相关疾病提供理论基础。
1 材料与方法
1.1细胞与试剂 人THP-1单核细胞系购自中国科学院典型培养物保藏委员会细胞库。佛波酯购于美国Sigma-Aldrich公司。TNF-α、IL-1β和IL-6酶联免疫吸附试验(ELISA)试剂盒购于美国 Invitrogen 公司。LPS、MMP试剂盒(JC-1)和ROS试剂盒购于北京索莱宝科技有限公司。内质网应激信号通路蛋白双链RNA激活的蛋白激酶类内质网激酶(PERK)、激活转录因子(ATF)6和肌醇需要酶(IRE)1相关抗体、phospho-NF-κB p65和NF-κB p65抗体均购于美国Cell Signaling Technology,Inc (CST)公司。Irisin购自美国PeproTech公司。衣霉素(TM)购自CST公司。
1.2ELISA检测TNF-α、IL-1β和IL-6水平 采用0.1 μmol/L佛波酯诱导THP-1细胞48 h,使其从单核细胞分化为巨噬细胞。然后,利用无血清培养基培养THP-1巨噬细胞24 h,接着分别用LPS、不同浓度Irisin、LPS+不同浓度Irisin或LPS+Irisin(200 ng/ml)+ TM(10 ng/ml)进行培养。培养24 h后,收集上清。分为正常对照组(不进行任何操作的单一THP-1巨噬细胞)、LPS组(THP-1巨噬细胞炎性模型组,LPS 200 ng/ml)、25 ng/ml Irisin组、50 ng/ml Irisin组、100 ng/ml Irisin组、200 ng/ml Irisin组、LPS+25 ng/ml Irisin组、LPS+50 ng/ml Irisin组、LPS+100 ng/ml Irisin组、LPS+200 ng/ml Irisin组、LPS+200 ng/ml Irisin+10 ng/ml TM组。根据ELISA试剂盒说明书检测各组上清液中TNF-α、IL-1β和IL-6的水平。
1.3MMP检测 按照JC-1说明书测定MMP。操作如下:将JC-1染色工作液加入每个孔中,孵育45 min。之后,用1×JC-1染色缓冲液清洗细胞两次,在荧光显微镜下观察,或用荧光酶标仪测量荧光值。
1.4ROS检测 根据ROS试剂盒说明检测细胞内ROS水平。将THP-1巨噬细胞与2′,7′-二氯二氢荧光素二乙酸酯(DCFH-DA)在37 ℃孵育45 min。使用荧光酶标仪测量荧光值或荧光显微镜下观察。
1.5Western印迹检测 RIPA缓冲液裂解细胞提取各组蛋白。总蛋白浓度用二喹啉甲酸(BCA)试剂盒检测。蛋白质在10%的聚丙烯酰胺凝胶上进行电泳分离,转到聚偏氟乙烯(PVDF)膜。采用5%(W/V)脱脂奶粉封闭2 h,使用抗PEPK、IRE1α、免疫球蛋白重链结合蛋白(BIP)、NF-κB p65、phospho-NF-κB p65、β-actin和磷酸甘油醛脱氢酶(GAPDH)一抗4 ℃孵育过夜。二抗孵育2 h。使用Amersham Imager 600QC凝胶成像仪获得图像。使用Image J对条带强度进行半定量分析。
1.6统计学分析 采用PRISM软件(GraphPad 5.0,San Diego,CA,USA)进行单因素方差分析(ANOVA)。
2 结 果
2.1Irisin和TM对LPS诱导的THP-1巨噬细胞IL-6、IL-1β和TNF-α分泌的影响 与正常对照组相比,LPS可显著增加THP-1巨噬细胞中IL-6、IL-1β和TNF-α水平(均P<0.05);仅有高浓度Irisin(100 ng/ml和200 ng/ml)处理LPS诱导的THP-1巨噬细胞后,可明显抑制IL-6、IL-1β和TNF-α浓度(P<0.05);单独使用Irisin处理THP-1细胞后IL-6、IL-1β和TNF-α分泌水平组间差异无统计学意义(P>0.05)。考虑到Irisin浓度为200 ng/ml时,IL-6、IL-1β和TNF-α的水平下降最多,所以选择200 ng/ml Irisin作为后续实验的最佳浓度,设为LPS+Irisin组。与LPS+200 ng/ml Irisin组相比,LPS+200 ng/ml Irisin+TM组THP-1巨噬细胞上清液中IL-6、IL-1β和TNF-α水平显著升高(均P<0.05)。见表1。
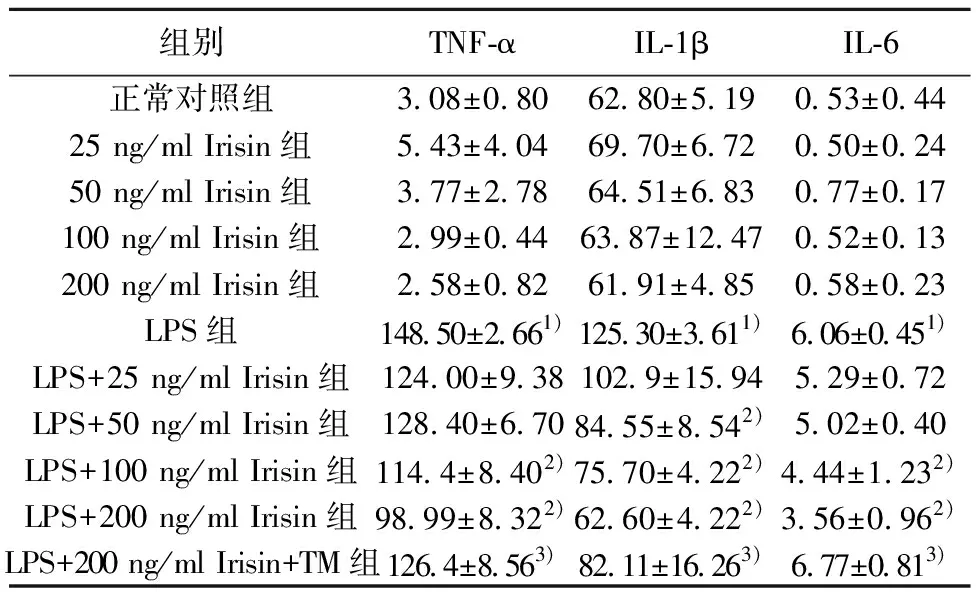
表1 Irisin和TM对LPS诱导的THP-1巨噬细胞TNF-α、IL-1β和IL-6的影响(pg/ml,n=3)
2.2Irisin对LPS诱导的THP-1细胞MMP的影响 与正常对照组相比,LPS组红绿荧光强度明显降低(P<0.05)。而与LPS组相比,LPS+Irisin组红绿荧光强度比值明显升高(P<0.05)。见表2和图1。
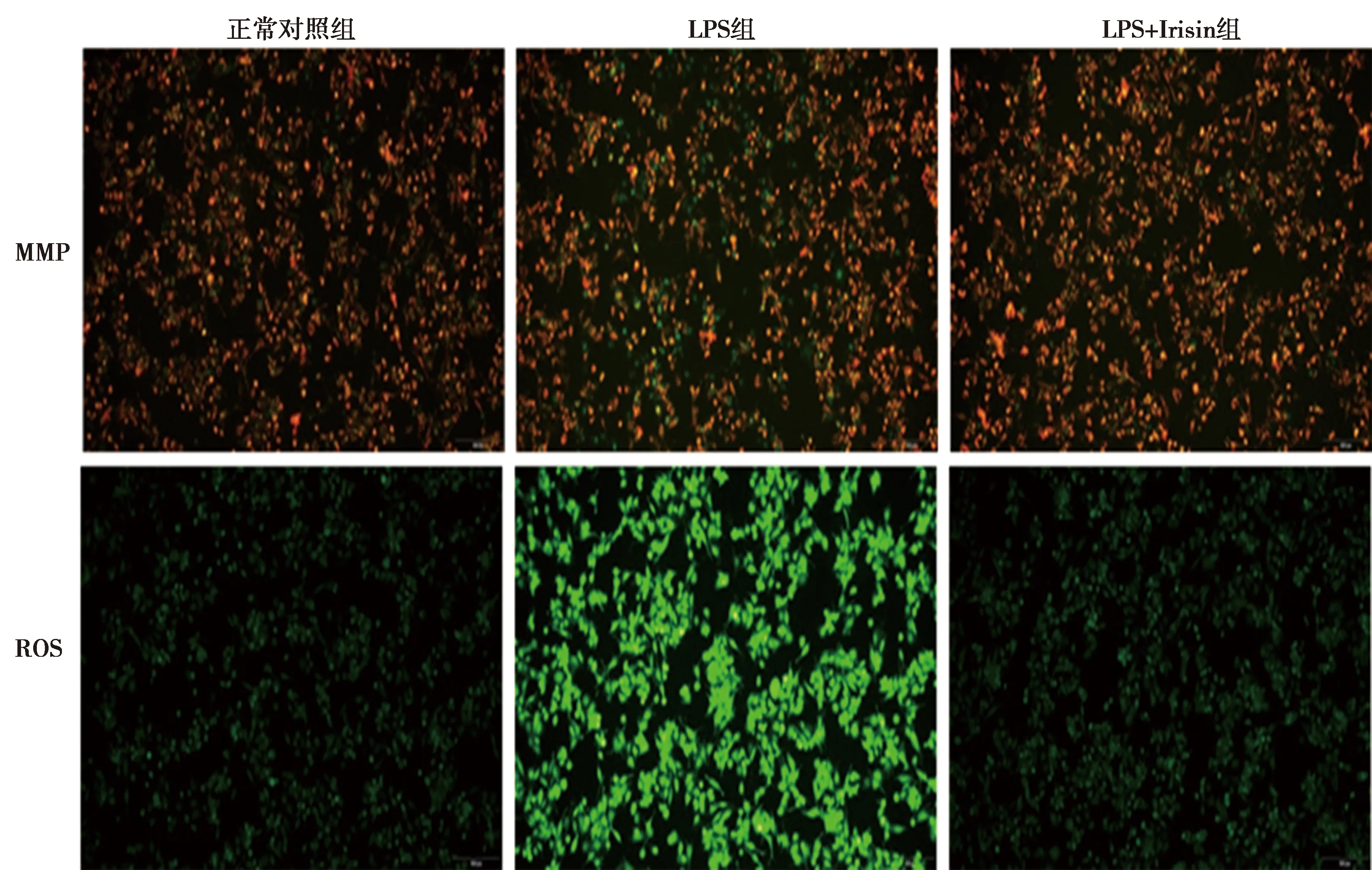
图1 各组THP1巨噬细胞MMP和氧化应激比较(×200)
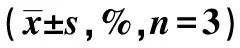
表2 各组THP-1巨噬细胞氧化应激和MMP比较
2.3Irisin对LPS诱导的THP-1细胞ROS的影响 与正常对照组相比,LPS组细胞ROS显著增加(P<0.05)。与LPS组比较,LPS+Irisin组ROS含量下降到正常水平,差异有统计学意义(P<0.05)。见表2和图1。
2.4Irisin对LPS诱导的THP-1巨噬细胞BIP、PERK、IRE1和phospho-NF-κB p65表达的影响 LPS组BIP、PERK和IRE1α表达水平明显高于正常对照组(均P<0.05);LPS+Irisin组BIP、PERK和IRE1α的表达水平明显低于LPS组(均P<0.05);与LPS+Irisin组相比,LPS+Irisin+TM组BIP、PERK和IRE1α表达明显增加(均P<0.05)。进一步发现,与正常对照组相比,LPS组的phospho-NF-κB p65/NF-κB p65比值明显增加(P<0.05);LPS+Irisin组中phospho-NF-κB p65/NF-κB p65比值明显低于LPS组(P<0.05);与LPS+Irisin组相比,LPS+Irisin+TM组中phospho-NF-κB p65/NF-κB p65比值明显增加(P<0.05)。见表3、图2。
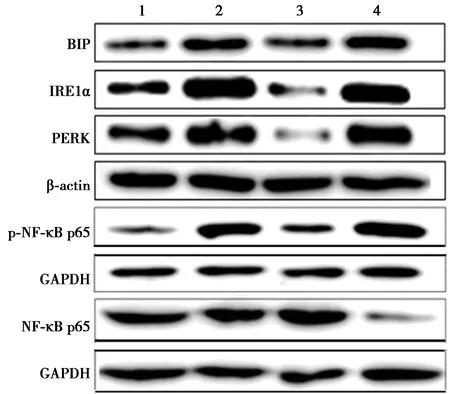
1~4:正常对照组、LPS组、LPS+Irisin组、LPS+Irisin+TM组
表3 各组内质网应激及NF-κB关键蛋白相对表达水平比较
3 讨 论
Irisin于2012年由Boström等〔2〕首次发现,是一种运动诱导的、骨骼肌分泌的糖基化蛋白,前期研究发现其具有改善运动、参与糖脂代谢、保护线粒体和神经元等功能。后续发现Irisin在动脉粥样硬化、糖尿病、脑卒中、肥胖、炎症性肠病和阿尔茨海默病等疾病中发挥明显抑炎作用〔5〕。巨噬细胞在许多慢性炎性相关疾病致病机制中起关键作用。LPS是革兰阴性菌外膜的重要组成部分,是巨噬细胞的主要炎症刺激因子。LPS通过激活许多信号通路,触发人类单核细胞和巨噬细胞产生的某些细胞因子,包括TNF-α和IL-1家族,诱发炎症反应,在各种炎症性疾病的进展中发挥重要作用。LPS诱导的THP-1巨噬细胞是研究炎症的一个经典细胞模型〔6,7〕。为了探索Irisin的可能抑炎机制,本研究采用了LPS诱导的THP-1巨噬细胞体外模型,结果支持Irisin在慢性炎症过程中发挥抗炎作用。
线粒体功能障碍导致能量代谢异常,产生过多的ROS,在引起诱发炎症方面起重要作用〔8〕。本研究发现,Irisin可以改善LPS诱导的氧化应激损伤。这些结果表明,Irisin可能通过改善线粒体功能和氧化应激,在减少巨噬细胞炎症细胞因子的分泌发挥关键作用。通过这种机制,Irisin可以维持机体巨噬细胞内的氧化还原平衡,从而发挥抑炎作用。
ERS是一种保护性的细胞应激反应,多表现为内质网平衡的破坏和各种病理状态下的功能障碍。长期或过度的ERS可能会引起炎症反应或细胞凋亡,在激活巨噬细胞诱导的炎症反应中起重要作用,并参与各种慢性炎性相关性疾病的发展〔9〕。它可导致大量错误折叠和未折叠的蛋白质在内质网腔内积聚,并引起钙平衡的紊乱。未折叠蛋白反应(UPR)途径是ERS中最重要的通路,它可通过分子伴侣葡萄糖调节蛋白(GRP)78/BIP和3种受体蛋白激活,即PERK、ATF6和IRE1 3条信号通路激活炎症反应〔10,11〕。此外,氧化还原平衡失调和线粒体功能障碍在ERS介导的炎症反应中也起着重要作用。本研究发现Irisin可以抑制ERS的过度激活,而且这种作用被ERS激活剂TM所逆转。在正常生理条件下,PERK和IRE1在维持ERS方面起关键作用,而在病理条件下,它们通过与BIP解离而被激活,引起一系列的UPR。UPR通过 PERK、 IRE1、 ATF6 三条信号通路激活炎症反应,进一步激活NF-κB信号通路〔12〕。NF-κB的经典活性形式由 p50/p65 复合物组成,可以形成不同于 rel、激活蛋白(AP)1和类固醇激素受体家族成员的二聚体。NF-κB被认为是炎症过程和自身免疫性疾病的一个重要机制〔13〕。许多重要的抗炎和免疫抑制药物都抑制NF-κB通路,因此本研究检测了NF-κB通路相关蛋白的表达水平,结果发现Irisin可明显抑制NF-κB p65的激活,提示Irisin可能通过阻止ERS和NF-κB通路的激活,从而减少炎症因子的分泌。
综上,Irisin可有效抑制LPS诱导的THP1巨噬细胞TNF-α、IL-6和IL-1β的分泌,改善线粒体功能,维持细胞内的氧化还原平衡。其可能机制是通过抑制ERS和NF-κB信号通路,从而在某些慢性炎症相关疾病中产生抗炎作用,因而Irisin未来有希望成为治疗许多老年慢性炎症相关疾病的潜在药物靶点。

