LMNB1在卵巢癌组织中的表达及其对卵巢癌细胞生物学行为的影响
程健祥 杜文升 魏敏 王光慧
1徐州医科大学研究生院(江苏徐州 221004);2徐州医科大学附属医院妇科(江苏徐州 221002)
卵巢癌是妇科最常见的三大癌症之一,致死率位于妇科恶性肿瘤之首。卵巢癌发病初期没有明显的临床症状,导致大约70%的患者就诊时候为晚期,而且大约70%的卵巢癌患者在治疗3年后会再次复发[1],因此晚期卵巢癌的五年生存率低至30%[2]。即使现在外科技术飞速发展,卵巢癌的治疗和预后仍没有明显改善[3-4]。卵巢癌恶性程度高,侵袭性强而且预后极差,目前其发病原因、分子机制仍然没有明确共识。因此,研究卵巢癌侵袭和转移的机制,寻找到有效的治疗靶点显得尤为重要。
LMNB1 是V 型中间丝蛋白家族的重要成员之一,与LMNA、LMNC、LMNB2 一起组成了核层(NL)的主要成分V 型中间丝蛋白[5]。据报道,LMNB1广泛的参与多种生物活动,如DNA 复制和转录、细胞周期的调节、核迁移和凋亡、细胞的增殖和分化[6]。近年来,关于LMNB1 在肿瘤中的作用越来越引起人们的关注,TANG 等[7]的研究表明LMNB1 在肺癌中作为肿瘤促进因子,并且LMNB1的敲低可以调节细胞增殖和凋亡。王瑞官等[8]通过siRNA 敲低LMNB1 在肝癌HepG2 和Hep3B 细胞中的表达,发现LMNB1 可以显著降低端粒酶活性,细胞增殖和侵袭能力,表明LMNB1 有望成为评价肝癌患者临床预后的指标。据报道,LMNB1 的过表达同样与前列腺癌、宫颈癌、胰腺癌和肝癌的发生发展密切相关[9-11]。然而,LMNB1 在卵巢癌中的作用及临床意义知之甚少,本研究通过实验分析LMNB1 在卵巢癌中的表达及其对卵巢癌SKOV3细胞生物学行为的影响,并通过生物信息学初步探讨LMNB1 在卵巢癌发生发展中的具体机制,以期为卵巢癌的靶向治疗提供新的思路。
1 资料与方法
1.1 临床资料收集2019年9月至2022年12月徐州医科大学附属医院妇科卵巢癌患者手术切术标本68 例,正常卵巢组织27 例。所有卵巢癌患者均经病理科医生明确诊断为卵巢癌,术前均未接受放化疗、排除合并其他恶性肿瘤和免疫系统疾病。正常卵巢组织来源于生殖系统良性疾病患者的手术切除标本。所有患者临床病例资料完整,均签署知情同意书,本研究已经获得徐州医科大学附属医院伦理委员会的批准(XYFY2023-KL106-01)。
1.2 细胞系及实验材料正常卵巢上皮细胞IOSE80,卵巢癌细胞SKOV3、A2780、CAOV3 均购自中国科学院上海细胞库。RPMI-1640 培养基、0.25%胰蛋白酶、胎牛血清购自美国Gibco 公司。LMNB1 兔抗人抗体、MMP-2 兔抗人抗体、MMP-9 兔抗人抗体购自Proteintech 公司。SDS-PAGE 制胶试剂盒购自上海雅酶生物技术有限公司。Matrigel基质胶购自美国BD 公司,Transwell 小室购自美国Corning 公司。Edu 细胞增殖检测试剂盒购自广州锐博生物技术公司。
1.3 数据库信息处理和分析TCGA数据库和GEO数据库下载LMNB1 在卵巢癌上表达情况的相关信息,R 语言处理将患者按照表达量中位数分为高表达组和低表达组,并绘制相关表达差异图。Kaplan-Meier Plotter 分析LMNB1 的表达量和卵巢癌患者预后之间的关系,R 软件中pROC 包用于分析,ggplot 包绘制ROC 曲线。
1.4 免疫组化将所有组织的石蜡切片烘烤后,放入不同浓度梯度的二甲苯和酒精溶液中进行脱蜡和水化,用柠檬酸钠抗原修复液在微波炉中进行抗原修复。PBS 浸泡,滴加3%过氧化氢覆盖组织以去除过氧化氢酶。稀释后的一抗滴于标本玻片上,4oC 孵育过夜。次日,取出湿盒恢复室温,按照超敏二步法试剂盒说明书进行DAB 染色。再经过苏木素染核,盐酸酒精分化、返蓝、脱水封片,即可显微镜下观察。
1.5 Western blot在冰上用RIPA 法提取各组细胞和组织蛋白,BCA 法测量蛋白浓度后,配平制作样品。配制10%的SDS-PAGE 分离胶,上好样品后,分离胶80 V 电泳30 min,浓缩胶120 V 电泳90 min。将提前裁剪好的PVDF 膜甲醇预激30s,110 V 恒流湿转1.5 h。5%脱脂牛奶封闭2 h,TBST清洗后,4oC 过夜孵育一抗。次日,TBST 清洗3 次,孵育二抗2 h,TBST 洗膜3 次后,显影仪进行显影并拍照。
1.6 细胞划痕实验用Marker 笔在6 孔板背后垂直划3 条线,将生长状态良好的各组细胞均匀种植于六孔板中,待细胞生长完全融合后,用移液枪头垂直于细胞平面用力均匀划痕,PBS 冲洗3 遍,洗去划落的细胞。将细胞放回培养箱培养,在0、24、48 h 取出细胞,显微镜观察并拍照。
1.7 Transwell 实验选取各组生长状态良好的细胞,胰酶消化后用不完全培养基重悬细胞,调整好细胞密度吸取200 μL 置于小室上层,在小室下层加入600 μL 完全培养基,培养箱培养48 h 后,取出小室,弃去培养基,PBS 清洗3 次。4%多聚甲醛固定30 min 后弃去固定液,结晶紫染色20 min,PBS 清洗3 遍,棉签轻轻擦去内室细胞,显微镜下观察并拍照。侵袭实验使用Matrigel 基质胶包被小室,其余操作和迁移实验相同。
1.8 EdU 细胞增殖实验选取对数生长期细胞,接种于96 孔板,按照试剂说明书进行EdU 标记、细胞固定化、Apollo 染色、DNA 染色、拍照并统计。
1.9 集落形成实验将处于对数生长期的各组细胞用胰酶消化后,完全培养基重悬,细胞计数板计数,以每孔500 细胞的数目接种于6 孔板中,放在培养箱中培养14 d,肉眼可见克隆后,4%多聚甲醛固定,PBS 清洗,用结晶紫染液进行染色20 min,PBS 洗涤后,晾干,拍照并统计。
1.10 统计学方法所有研究数据均采用SPSS 22.0,GraphPad Prism 8.0 进行统计分析并绘制相应统计图,独立样本t检验比较两组样本间的差异;不满足t检验条件的采用非参数检验。P< 0.05认为差异有统计学意义。
2 结果
2.1 生物信息学分析LMNB1 在卵巢癌上的表达和预后情况通过TCGA 数据库和GEO 数据库分析LMNB1 在卵巢癌和正常卵巢上的表达差异,结果显示LMNB1 在卵巢癌上高表达(P< 0.01)。Kaplan-Meier Plotter 分析LMNB1 的表达和卵巢癌患者预后之间的关系,结果表明LMNB1 的高表达和卵巢癌的不良预后相关(P< 0.05)。R 软件中pROC 包用来分析LMNB1 在卵巢癌中潜在诊断价值,结果显示:ROC 曲线下面积(AUC)为0.981,表明LMNB1 在卵巢癌中具有良好的诊断价值。见图1。
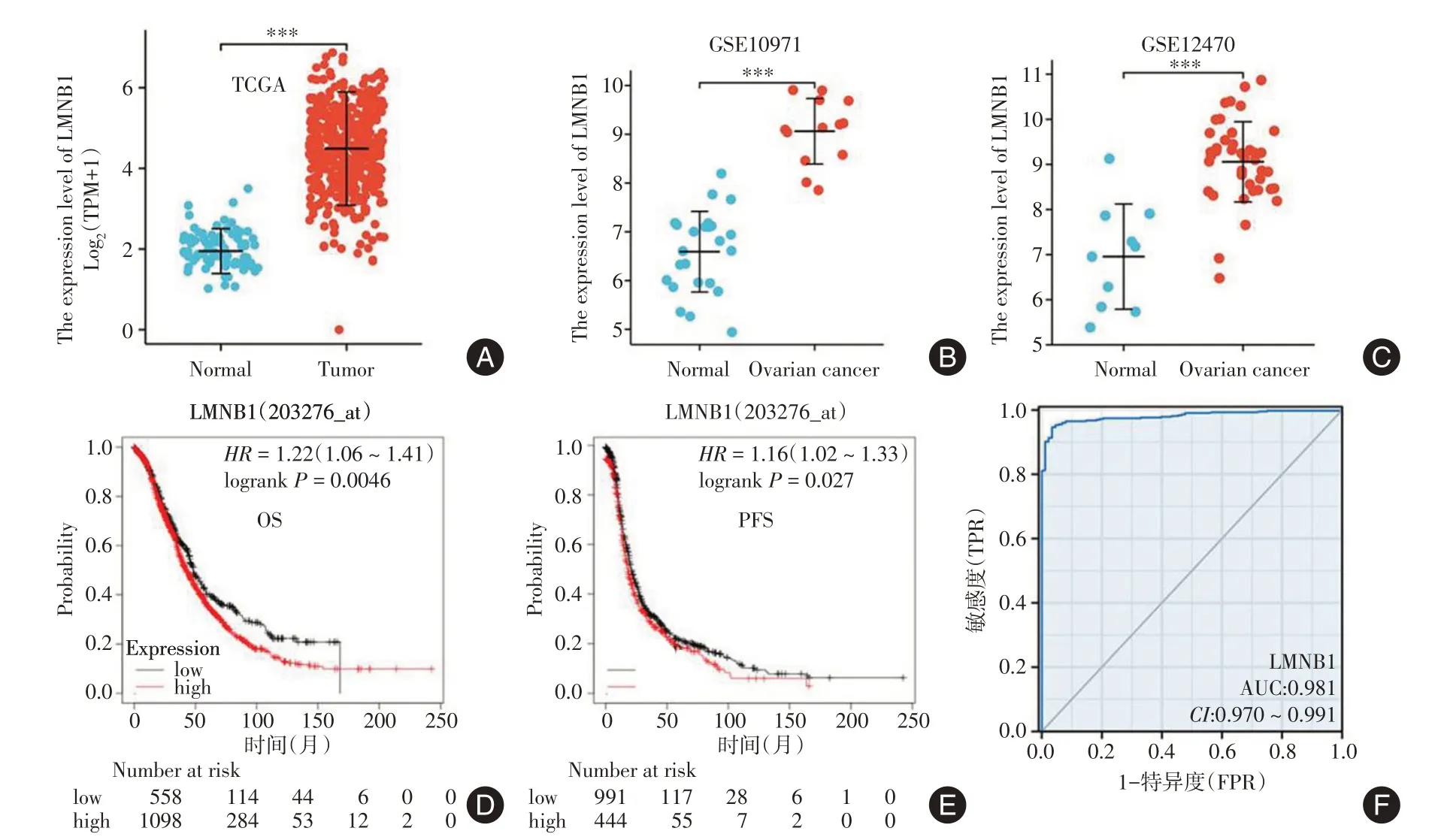
图1 数据库分析LMNB1 在卵巢癌上的表达和预后情况Fig.1 The expression of LMNB1 and its prognostic value in ovarian cancer based on TCGA database
2.2 免疫组化检测LMNB1 蛋白在卵巢癌组织中的表达卵巢癌组织中LMNB1 的阳性表达率为75%(51/68),在正常卵巢组织中的阳性表达率为22%(6/27)。与正常卵巢组织相比,卵巢癌组织的LMNB1 阳性表达率明显升高,差异有统计学意义(P< 0.05)。见图2。
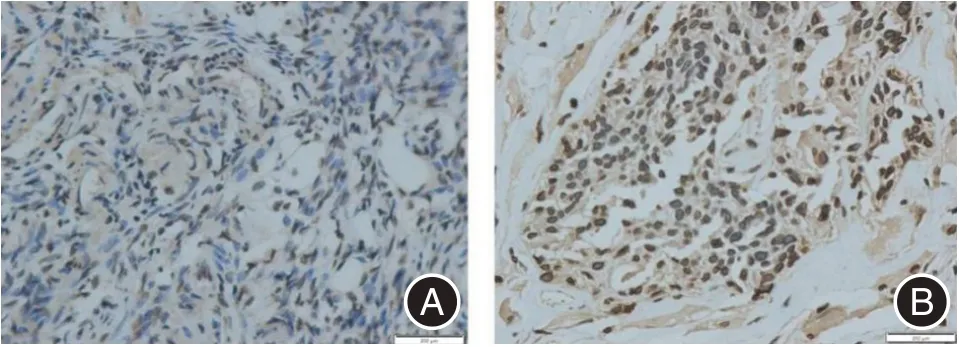
图2 免疫组化检测LMNB1 在卵巢癌组织及在正常卵巢组织中的表达情况(×200)Fig.2 The expression of LMNB1 in ovarian cancer tissues and normal ovarian tissues is detected by immunohistochemistry(×200)
2.3 卵巢癌组织中LMNB1 表达与临床病理因素的关系LMNB1 阳性表达率与患者的年龄、淋巴结转移、病理类型无明显相关性(P> 0.05);而肿瘤的FIGO 分期、组织学分级等与LMNB1 的阳性表达有相关性(P< 0.05)。见表1。
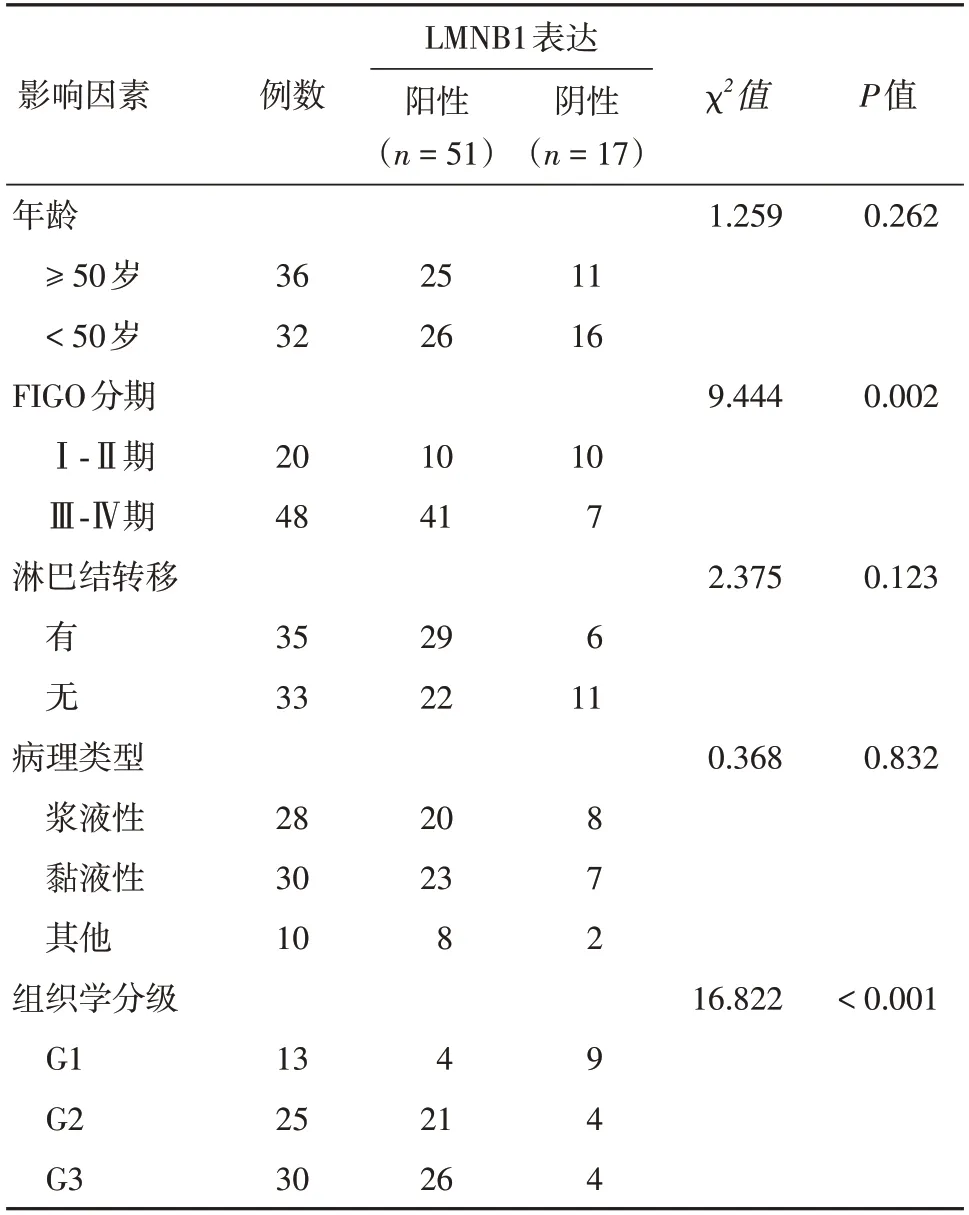
表1 LMNB1 表达与卵巢癌患者临床病理特征的关系Tab.1 Relationship between LMNB1 protein expression and clinicopathological features in 68 cases of ovarian cancer例
2.4 LMNB1 在卵巢癌细胞上的表达情况以及稳转细胞系的构建Western blot 检测LMNB1 在卵巢癌细胞和正常卵巢上皮细胞的表达情况,结果显示:LMNB1 在卵巢癌细胞上的表达明显高于正常卵巢细胞(P< 0.01),其中LMNB1 在SKOV3 细胞系中表达量高,用慢病毒转染进卵巢癌SKOV3细胞,构建稳定敲低LMNB1 的卵巢癌细胞系SKOV3。Western blot 实验检测敲低效果,结果显示sh-LMNB1#2 的慢病毒敲低效果最好,选取2 号慢病毒用于后续实验,并命名为sh-LMNB1 组,对照组为sh-NC。见图3。
2.5 敲低LMNB1 的表达对卵巢癌细胞增殖、迁移和侵袭能力的影响CCK-8 实验结果显示,与sh-NC 组相比,sh-LMNB1 组卵巢癌细胞增殖能力显著下降,差异有统计学意义(P< 0.05)。EdU 细胞增殖实验结果表明,下调LMNB1 的表达后,EdU阳性细胞比例减少,差异有统计学意义(P< 0.05)。细胞集落形成实验结果表明,下调LMNB1 的表达后,卵巢癌细胞SKOV3 的集落形成能力显著下降,差异有统计学意义(P< 0.05)。细胞划痕实验和Transwell 实验结果显示:下调LMNB1 的表达,可以显著抑制卵巢癌SKOV3 细胞的侵袭和迁移能力。Western blot 实验检测LMNB1 对促进侵袭蛋白MMP-2、MMP-9 和抑制侵袭蛋白TIMP-1 的影响,结果显示:下调LMNB1 的表达后,促进侵袭蛋白MMP-2、MMP-9 表达量也随之下降,抑制侵袭蛋白TIMP-1 的表达升高,差异有统计学意义(P< 0.05)。以上结果表明LMNB1 可以促进卵巢癌SKOV3 的增殖、迁移和侵袭能力。见图4。
2.6 生物信息学分析LMNB1 的潜在功能和基因通路通过String 和GeneMania 数据库分析出和LMNB1 共表达的基因,并构建蛋白互作网络,随后对共表达基因进行GO 分析和KEGG 分析以便研究LMNB1 的潜在生物学功能和通路。富集分析结果显示:在生物学过程(BP)主要参与NDA 包装、有丝分裂、核组织等;分子功能(MF)主要包括核小体结合、核纤层蛋白绑定、组蛋白激酶活性等;细胞成分(CC)主要位于核内膜、核被膜等;KEGG 分析信号通路主要在PI3K-AKT、P53、细胞周期、细胞凋亡等信号通路上。见图5。
3 讨论
卵巢癌是妇科最常见的肿瘤之一,同时也是致死率最高的女性生殖系统恶性肿瘤。卵巢癌早期症状不明显,缺乏早期有效的筛查手段,高达70%的卵巢癌患者直至晚期才被发现,而且卵巢癌恶性程度高,导致晚期卵巢癌患者5年生存率低于30%[12-13],严重威胁女性身体健康。因此,急需寻找卵巢癌新的有效的治疗靶点。
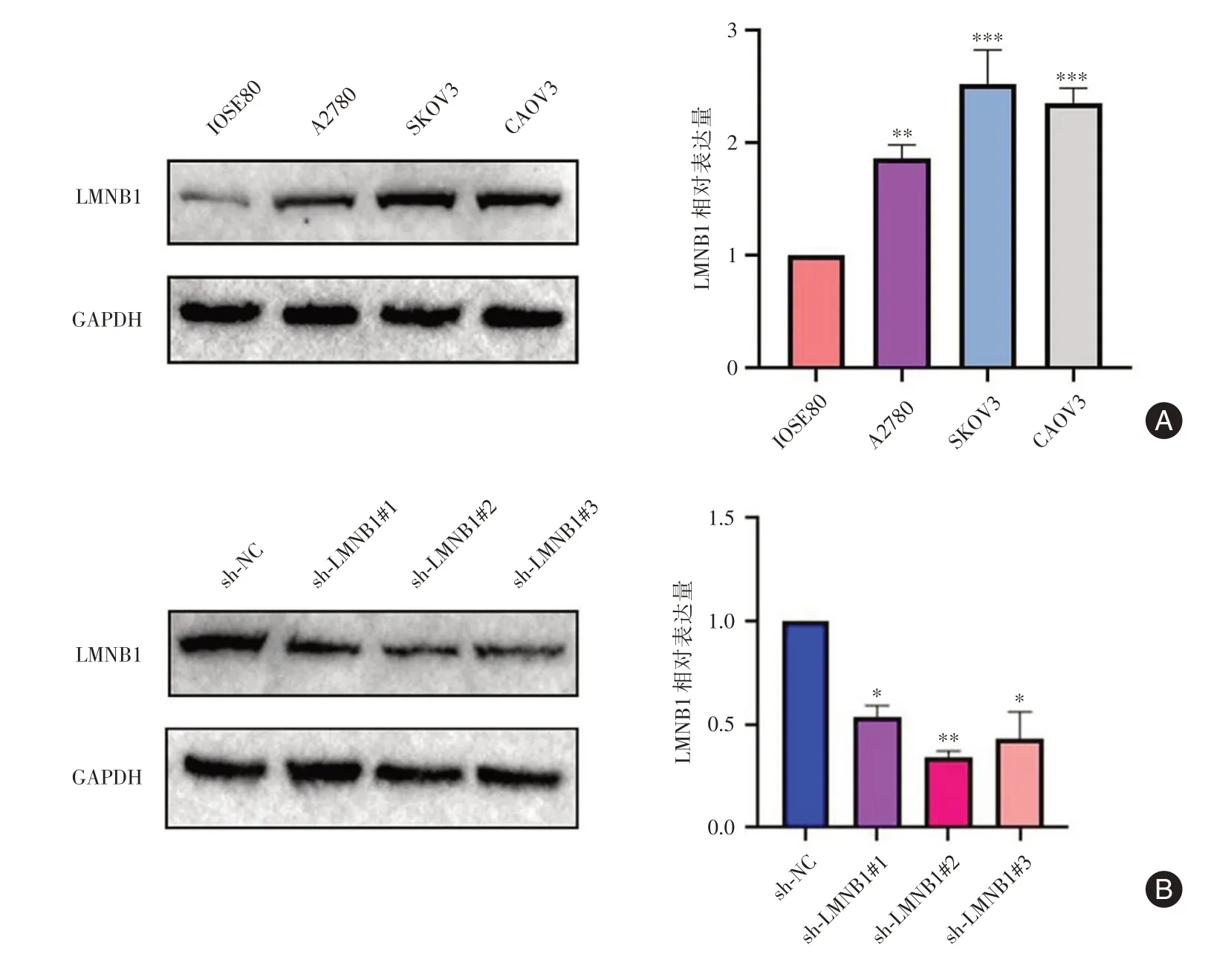
图3 LMNB1 在敲低卵巢癌细胞中的效率验证Fig.3 Efficiency verification of LMNB1 in ovarian cancer cells after knocking down LMNB1
核纤层是紧贴在内核膜的一层高密度纤维蛋白网络,广泛存在于真核细胞中,核纤层由核纤层蛋白(Lamins)组成[5],Lamins 被认为是IF 家族中V型成员。根据Lamins 的编码基因不同,将Lamins分成A 型、B 型和C 型,而B 型又分为Lamin B1 和Lamin B2 两种亚型[14-16]。LMNB1 可以保持细胞核的完整性,调节细胞增殖和衰老、DNA 复制以及DNA 损伤的修复[17]。CHEN 等[18]的研究表明,层粘连蛋白B1 或层粘连蛋白B2 的缺乏会导致迁移神经元的核膜(NM)破裂,伴随着DNA 损伤和细胞死亡。近年来,关于LMNB1 在肿瘤方面的作用引起越来越多的学者注意,据报道LMNB1 在许多肿瘤中异常表达,例如在肺腺癌、前列腺癌和宫颈癌等中高表达,并通过不同的途径促进癌症的进展[15,19]。而LMNB1 在卵巢癌中的作用如何目前尚未见报道,本研究前期通过数据库信息发现LMNB1 在卵巢癌中高表达并且可能预示着卵巢癌患者的不良预后,因此我们拟研究LMNB1 在卵巢癌进展中的机制,以期为卵巢癌的治疗提供一种新的思路。
在本研究中,我们通过免疫组化法检测LMNB1在卵巢癌组织和正常卵巢组织中的表达差异,结果显示:LMNB1在卵巢癌组织中表达水平显著升高(P< 0.05)。随后,我们从细胞层面通过Western blot 实验检测LMNB1 在多种卵巢癌细胞中的表达情况,我们发现LMNB1 在卵巢癌细胞中的表达明显高于正常卵巢细胞,并且在卵巢癌SKOV3 细胞中表达量最高。之后,我们采用慢病毒转染进卵巢癌SKOV3细胞,通过CCK8实验、平板克隆实验、EdU 细胞增殖实验和Transwell 实验检测LMNB1 表达水平的改变对卵巢癌细胞增殖、迁移和侵袭能力的影响。结果表明,随着LMNB1 基因的沉默,卵巢癌细胞增殖、侵袭和迁移等恶性生物学行为能力也随之减弱。
MMP-2 和MMP-9 是MMPs 家族中的一员,MMP-9 可以降解细胞外蛋白质成分,参与细胞外基质蛋白的重组和消除细胞迁移的物理屏障,被认为是促进肿瘤生长和转移的标志物[20-21]。本研究结果显示当LMNB1 表达量下降时,MMP-2 和MMP-9 的表达量随之下降,TIMP1 的表达量升高,表明LMNB1 可能通过激活MMP 的活性促进卵巢癌细胞的侵袭能力。
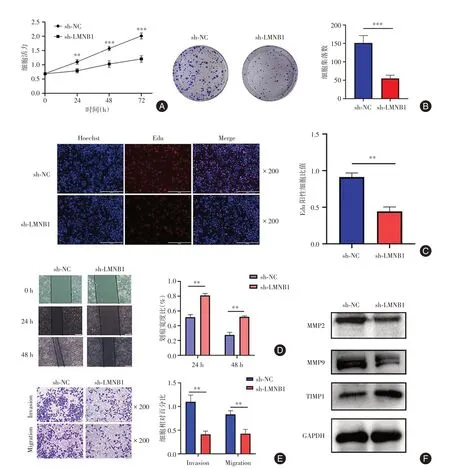
图4 敲低LMNB1 抑制卵巢癌细胞增殖、迁移和侵袭能力Fig.4 LMNB1 Koncking down LMNB1 inhibits proliferation ,migration and invasion ability of ovarian cancer cells
通过以上研究结果表明,LMNB1 在卵巢癌组织中高表达,并且扮演促癌因子的角色,可以促进卵巢癌细胞的恶性生物学行为。为了研究LMNB1潜在的生物学功能和促进卵巢癌进展潜在的分子机制,我们通过生物信息学构建LMNB1 的PPI 网络,同时通过富集分析到LMNB1 很有可能通过P53 信号通路和PI3K-AKT 信号参与卵巢癌细胞周期和细胞凋亡的调节,但其具体调节机制仍需进一步的实验来验证阐明。
综上所述,本研究发现LMNB1 在卵巢癌组织中高表达,并且与卵巢癌患者临床病理特征密切相关,通过细胞学实验,我们发现LMNB1 表达量的下调可以显著抑制卵巢癌SKOV3 细胞增殖、迁移和侵袭能力。并且我们通过生物信息学预测到LMNB1 可能通过P53 信号通路、PI3K-AKT 信号通路参与卵巢癌的进展,但其具体机制仍需进一步实验进行验证和深入研究。
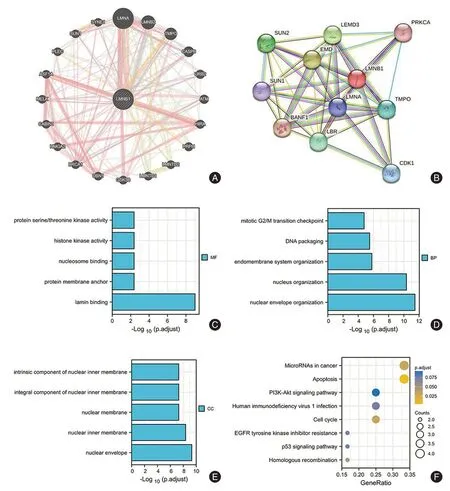
图5 LMNB1 共表达基因功能富集分析Fig.5 The enrichment analysis of LMNB1 co-expression genes
【Author contributions】CHENG Jianxiang performed the experiments and wrote the article.WEI Min and WANG Guanghui performed the experiments.DU Wensheng and WEI Min revised the article.DU Wensheng designed the study and reviewed the article.All authors read and approved the final manuscript as submitted.

