基于Hippo/YAP信号通路探讨穿心莲内酯抗三阴性乳腺癌的作用机制
黄翠霞 张雅倩 杨爱萍 刘芮含秋 路艳
广州中医药大学中西医结合基础研究中心(广州 510006)
乳腺癌是日渐年轻化的恶性肿瘤之一,已成为女性肿瘤相关死亡的主要原因[1]。三阴性乳腺癌(triple-negative breast cancer,TNBC)是具有高转移率、高复发率、预后差、低生存率等特点的乳腺癌亚型。因TNBC 的孕酮受体、雌激素受体和人表皮生长因子受体-2 表达均为阴性,临床上常用的内分泌治疗和靶向治疗均不适用于TNBC 患者[2-3]。因此,探索新的治疗药物及寻找新的治疗靶点是攻破该疾病的关键。研究表明,YAP 蛋白(yesassociatedprotein,YAP)在乳腺癌的增殖、上皮间质转化(epithelial-mesenchymal cell transition,EMT)和干细胞特性等方面扮演着重要角色[4-5]。因此,YAP 可能是乳腺癌防治的潜在靶点。
穿心莲内酯(andrographolide,Andro)是中药穿心莲的主要成分,其可抑制肿瘤细胞的增殖、诱导细胞凋亡,逆转EMT 进程。据报道,Andro 可通过多通路多靶点的途径抑制细胞生长,阻断细胞周期,在乳腺癌、肺癌和结肠癌等肿瘤中具有较强的抗肿瘤活性[6-8],但Andro 基于Hippo/YAP 信号通路抑制TNBC 细胞生长和干细胞特性方面的研究鲜见报道。因此,本研究通过体内外实验,研究Andro 抑制TNBC 细胞的生长和干细胞特性的作用,探索Andro 在Hippo/YAP 信号通路上的作用机制,为乳腺癌的治疗提供新思路。
1 材料与方法
1.1 材料
1.1.1 细胞株和动物乳腺癌细胞MDA-MB-231和4T1(中科院上海细胞库)。7~8周龄,体质量18~23 g,BALB/c 雌性小鼠15 只(广州锐格生物科技有限公司),动物质量合格证号:44827200000914。研究经伦理委员会批准(编号:20210929001)。
1.1.2 药物及试剂Andro(上海陶术生物技术有限公司),批号:5508-58-7。DMEM 培养基、RPMI-1640 培养基、DMEM/F12 培养基、B-27 Supplement(50×)、胎牛血清、青霉素-链霉素、0.25%胰酶(美国Gibco 公司);蛋白marker(北京经科宏达生物技术有限公司);蛋白定量试剂盒、CD24-PE、CD44-FITC 抗体(赛默飞世尔科技公司);显影液(美国Affinity 公司);FITC/PI 凋亡试剂盒(南京凯基生物科技发展有限公司);免疫组化试剂盒(北京博奥森生物技术公司);二抗兔和一抗(YAP、ANKRD1、p-YAP、E-cadherin、Vimentin、N-cadherin、Fibronectin、NESTING、NANOG 和Gapdh)(武汉爱博泰克生物科技有限公司)。
1.2 实验方法
1.2.1 SRB 法检测细胞活性细胞接种在96 孔板24 h后;加入含不同浓度Andro的培养基,分别培养24、48 和72 h;固定1 h 后,SRB 溶液室温染色;再加入10 mmol/L Tris 溶液溶解30 min;最后检测各孔光吸收值,计算各组细胞的活力。
1.2.2 划痕实验检测细胞迁移能力用无菌枪头对细胞进行划痕,将含有不同浓度的Andro 的培养基对细胞进行干预,于不同时间点在倒置显微镜下对细胞划痕位置进行图像拍摄,计算划痕愈合率,划痕愈合率=(0 h划痕宽度-72 h划痕宽度)/0 h划痕宽度×100%。
1.2.3 流式细胞技术检测CD44+/CD24-/low的比例Andro 作用细胞48 h 后,离心、重悬细胞,在避光条件下染色,空白组加入1×PBS 溶液4 μL,Control 单染一组、Control 单染二组分别加入CD44-FITC、CD24-PE 各4 μL,Control 双染组及Andro 组均加入CD44-FITC和CD24-PE 4 μL,冰上避光孵育30 min,洗涤细胞,上机检测。
1.2.4 干细胞成球实验检测乳腺微球的增殖能力以每孔105个细胞接种于极低吸附力6 孔板中,常规培养24 h 后,加入含有不同浓度的Andro的干细胞培养基继续培养10 d,在倒置显微镜下观察干细胞球形态并拍摄图像,计算各浓度的乳腺微球数量。
1.2.5 Western blot 检测相关蛋白表达水平收集细胞的总蛋白并进行定量分析,各浓度取蛋白20 μg 进行SDS-PAGE 电泳;转膜,封闭;加入相应的一抗,于4 ℃冰箱孵育过夜;次日用1×TBST 溶液冲洗后,加入二抗孵育1 h,显影,用ImageJ 软件对相应蛋白条带进行灰度分析。
1.2.6 移植瘤实验观察Andro 对乳腺肿瘤的影响构建4T1 TNBC 模型,并将造模成功小鼠随机分为对照组、低剂量组及高剂量组,每组5 只小鼠,每组分别予1×PBS 溶液、Andro 5 mg/kg、Andro 10 mg/kg各10 μL,连续经腹腔注射的方式给药2周后,取出移植瘤,计算肿瘤体积[(宽2×长)/2]。
1.2.7 免疫组化实验检测相关蛋白在肿瘤中的表达对切片进行脱蜡、水化、抗原修复、透膜,添加一抗,并置于4 ℃冰箱孵育过夜;次日将切片复温后,添加二抗,孵育30 min;再用DAB 进行显色,苏木素复染,然后用乙醇进行梯度脱水,二甲苯透明,最后用中性树胶封片;显微镜观察并拍片。
1.3 统计学方法实验数据采用SPSS 19.0 统计软件分析,对实验数据进行正态检验,服从正态分布的,采用单因素方差分析,两两比较用LSD 检验方法进行统计,计量资料以均数±标准差表示;以P< 0.05 表示差异有统计学意义。
2 结果
2.1 Andro 对TNBC 细胞增殖的影响由图1 可知,随着Andro 干预浓度增加与培养时间的延长,MDA-MB-231 和4T1 细胞的活性随之降低。Andro干预MDA-MB-231 和4T1 细胞72 h 后的IC50值分别为12.63 μmol/L 和11.54 μmol/L,并由此选择5、10和20 μmol/L 浓度进行后续实验。

图1 Andro 对TNBC 细胞增殖的影响Fig.1 Andro inhibited the proliferation on TNBC cells
2.2 Andro 对TNBC 细胞迁移的影响由图2 可知,经Andro 干预后的MDA-MB-231 和4T1 细胞划痕的愈合速度均有所降低,且呈剂量依赖性。各浓度组与对照组相比,差异有统计学意义(P<0.01,P< 0.001)。
2.3 Andro 对TNBC 干细胞特性的影响由图3A-B 可知,Andro 可降低MDA-MB-231 和4T1 细胞的干细胞表面标志物CD44+/CD24-/low的比例,且呈剂量依赖性。由图3C-D 可知,经Andro 干预后的MDA-MB-231 和4T1 细胞的干细胞球的体积减小和数量减少,且呈浓度依赖性。同时,Andro 以浓度依赖性的方式降低了的MDA-MB-231 和4T1细胞中NANOG 和NESTING 蛋白的表达水平,各Andro 浓度组与对照组相比,差异有统计学意义(P< 0.05,P< 0.01,P< 0.001),结果见图3E。
2.4 Andro 对TNBC 细胞EMT 的影响经Andro干预后的MDA-MB-231 和4T1 细胞中E-cadherin 蛋白表达上升,而Vimentin、N-cadherin 和Fibronectin蛋白表达下降,且呈浓度依赖性,见图4。
2.5 Andro 对TNBC 细胞中YAP、ANKRD1 和p-YAP 蛋白的影响由图5 可知,Andro 以浓度依赖性的方式下调MDA-MB-231 和4T1 细胞中YAP 和ANKRD1 蛋白表达水平,上调p-YAP 蛋白表达水平。
2.6 Andro 对小鼠移植瘤的生长及肿瘤中YAP 和ANKRD1 蛋白的影响与对照组相比,经Andro处理的小鼠肿瘤体积和质量均有所减小,抑瘤率明显升高(P< 0.01),见表1。如图6所示,对照组YAP和ANKRD1蛋白呈强阳性表达,呈黄褐色颗粒状染色,而Andro(5、10 mg/kg)组YAP 和ANKRD1蛋白阳性表达降低,黄褐色颗粒状染色变浅,两个剂量组的阳性表达率与对照组相比,差异均有统计学意义(P< 0.01,P< 0.001),见表2。
表1 Andro 对小鼠移植瘤生长情况的影响Tab.1 Effect of Andro on the growth of tumor in mice±s,n=5

表1 Andro 对小鼠移植瘤生长情况的影响Tab.1 Effect of Andro on the growth of tumor in mice±s,n=5
注:抑瘤率(%)=(对照组肿瘤平均重量-Andro各剂量组肿瘤平均重量)/对照组平均重量×100%。与对照组相比,*P < 0.05,**P < 0.01
组别对照组低剂量组高剂量组抑瘤率(%)/10.26 ± 0.03**30.30 ± 0.04**剂量(mg/kg)0 5 10肿瘤体积(mm3)386.99 ± 2.10 338.57 ± 12.51*283.34 ± 8.45**肿瘤质量(g)4.29 ± 0.98 3.85 ± 0.11*2.99 ± 0.41**
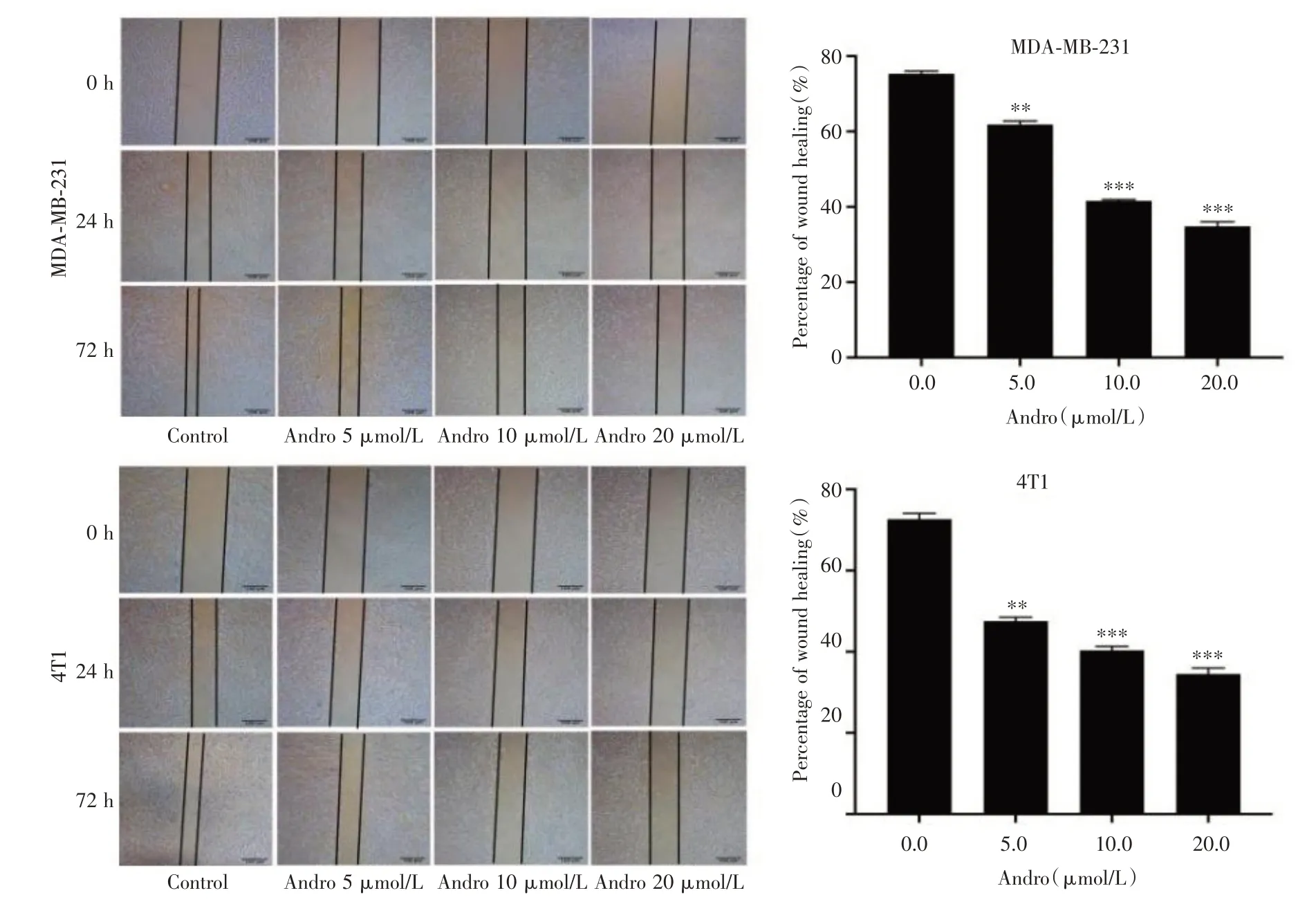
图2 Andro 对TNBC 细胞迁移的影响Fig.2 Andro inhibited the migration on TNBC cells
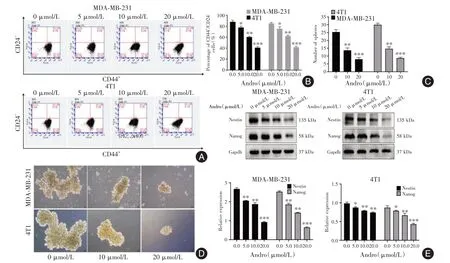
图3 Andro 对TNBC 的干细胞特性的影响Fig.3 Effects of Andro on stem cell properties of TNBC cells

图4 Andro 对TNBC 细胞EMT 的影响Fig.4 Effects of Andro on expression of EMT related protein markers in TNBC cells
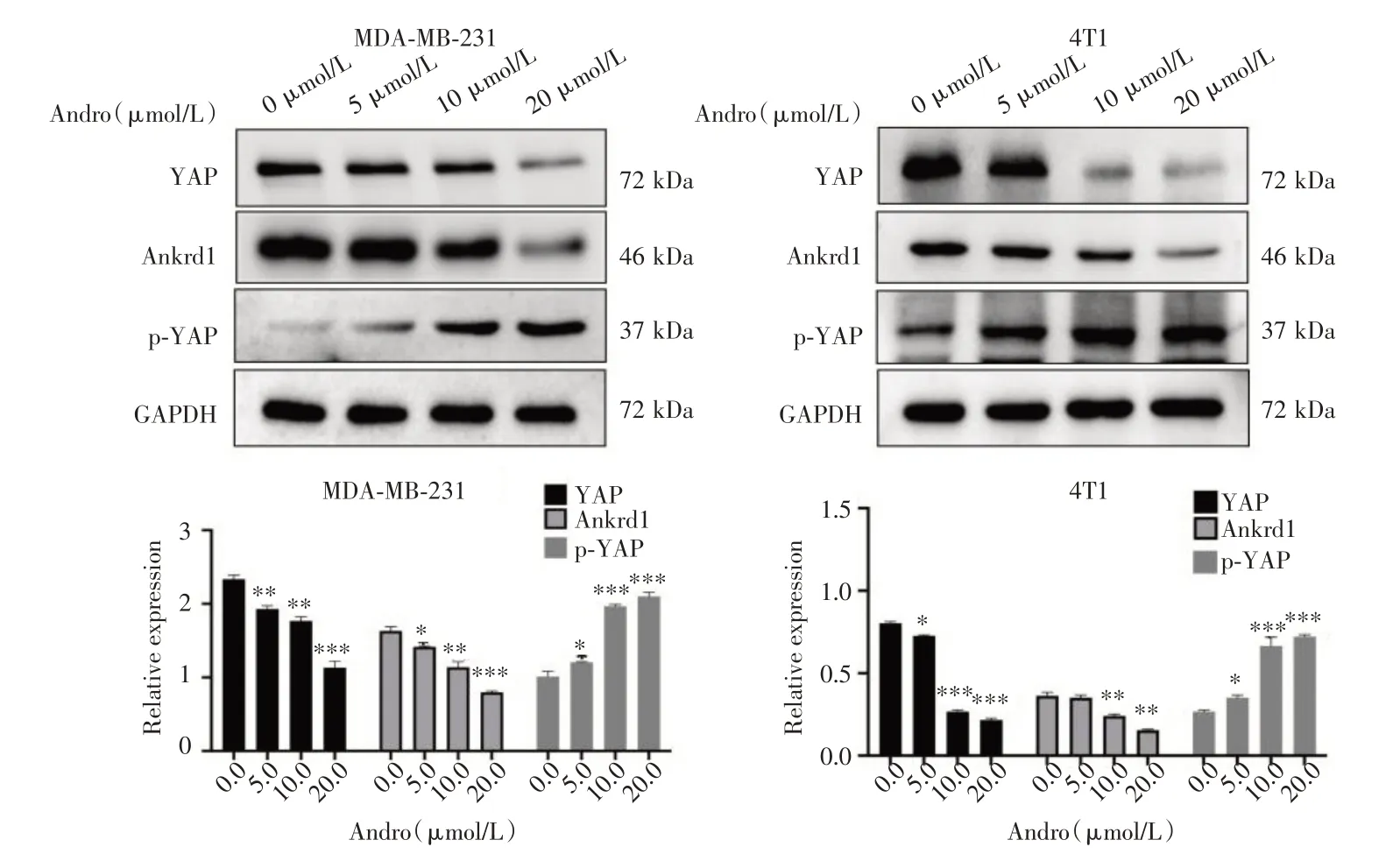
图5 Andro 对TNBC 细胞中YAP、ANKRD1 和p-YAP 蛋白的影响Fig.5 Effects of Andro on expression of YAP,ANKRD1 and p-YAP proteins in TNBC cells
3 讨论
TNBC 是乳腺癌中致死率较高的亚型[1],严重威胁着女性的生命健康。研究表明,肿瘤干细胞(cancer stem cells,CSCs)数量极少,具有自我更新、多向分化潜能、高致瘤性等特点[3],是TNBC 增殖、转移和复发的主要机制。EMT 是TNBC 转移的主要机制,在EMT 进程中,维持上皮细胞表型的黏附分子被间质细胞的表型分子所取代,导致肿瘤细胞间的黏附力降低,从而增强细胞迁移能力,加快肿瘤的进展[9]。因此,抑制CSCs 自我更新分化能力和EMT 进程是攻破 TNBC 的关键环节。Andro具有较强的抗肿瘤活性,有文献报道[10],Andro 通过抑制糖酵解,恢复氧化磷酸化,改善线粒体功能等途径,发挥抗乳腺癌小鼠肿瘤的作用。本研究先利用TNBC 细胞开展体外实验,结果发现Andro 各浓度组的细胞活性和迁移率明显低于对照组。同时,Andro 可降低TNBC 细胞CD44+/CD24-/low的比例及干细胞成球能力,且降低了干性标志蛋白NANOG 和NESTING 的表达水平。研究还发现,Andro 能上调E-cadherin 蛋白表达水平,下调Vimentin、N-cadherin 和Fibronectin 蛋白表达水平。上述实验结果揭示了在体外Andro 能抑制TNBC 细胞的增殖、迁移能力、干细胞特性和EMT进程。为了验证Andro 在体内也具有抗TNBC 的作用,本研究构建了小鼠移植瘤实验。结果显示,Andro 各剂量组的小鼠肿瘤体积和肿瘤质量明显低于对照组,抑瘤率高于对照组。表明了Andro在体内可抑制小鼠肿瘤的生长,提高抑瘤率。综上实验结果可知,Andro 在体内外均有抗TNBC的作用。

图6 Andro 对肿瘤中YAP 和ANKRD1 蛋白的影响(IHC,×400)Fig.6 Effects of Andro on expression of YAP and ANKRD1proteins of tumor(IHC,×400)
表2 小鼠肿瘤组织中YAP 和ANKRD1 蛋白表达量Tab.2 The expression of YAP and ANKRD1 protein of tumor in mice±s,n=4

表2 小鼠肿瘤组织中YAP 和ANKRD1 蛋白表达量Tab.2 The expression of YAP and ANKRD1 protein of tumor in mice±s,n=4
注:与对照组相比,**P < 0.01,***P < 0.001
组别对照组低剂量组高剂量组ANKRD1 125.87 ± 3.23 79.55 ± 1.03**43.77 ± 2.76***YAP 130.04 ± 4.14 102.44 ± 2.25**69.77 ± 3.28***
Hippo信号通路是一条由激酶链和YAP及TAZ两个效应因子组成的信号通路[11],在调控器官大小、组织生长、干细胞自我更新分化和肿瘤发生、发展等过程中发挥着重要作用[13-14]。当Hippo 信号通路被激活后,上游激酶发生级联反应引起下游YAP 磷酸化,被磷酸化的YAP 与14-3-3 蛋白结合并被滞留在细胞质中而无法进入细胞核与转录因子(如TEADs)结合,使其失去转录功能。而非磷酸化的YAP 与细胞核内的转录因子结合,才能发挥调控下游靶基因转录的功能,从而影响肿瘤的发展进程,如促进细胞增殖、干细胞自我更新分化和抑制细胞凋亡等过程[4,12]。已有研究表明[14-16],YAP 在乳腺癌、卵巢癌和食管癌等多种肿瘤中YAP 呈高表达,其过度激活在肿瘤干细胞自我更新和分化能力、EMT 等过程中具有重要调控作用[17-19]。YANG 等[20]发现氯丙嗪可通过促进YAP的蛋白酶体降解而抑制YAP 的表达,从而抑制乳腺癌干细胞成球能力和ALDH 的活性,从而发挥抗乳腺癌干细胞的能力。有研究表明,通过抑制YAP/TAZ 的表达和核定位,从而抑制乳腺癌细胞SKBR3 的增殖和EMT 进程,促进细胞凋亡[21]。本研究结果显示,Andro 能有效促进YAP 磷酸化,降低TNBC 细胞中的YAP 及下游靶基因ANKRD1 蛋白表达,且与小鼠移植瘤的免疫组化实验结果一致。由此可知,Andro 在体内外均可降低YAP 和ANKRD1 蛋白的表达。ANKRD1 基因是锚蛋白重复序列家族成员,也是YAP 的靶基因,其参与炎症、恶性肿瘤的发生、发展进程[22-24]。有研究表明[24],通过下调ANKRD1 蛋白的表达水平,可抑制膀胱癌细胞的增殖能力;上调ANKRD1 的表达,可诱导肝癌细胞EMT 进程,从而促进细胞增殖与迁移[25]。因此,Andro 诱导YAP 磷酸化,下调YAP 和ANKRD1 蛋白的表达水平,可能是Andro 抑制TNBC 细胞的增殖、迁移能力、干细胞特性和EMT进程的作用机制。
综上所述,Andro发挥抗TNBC的作用可能是通过介导Hippo/YAP 信号通路实现的。由此,Andro可能是对高YAP 活性的乳腺癌患者治疗有效的潜在药物。但本研究仅对下游基因进行研究,因此在Hippo 信号通路的上游激酶及YAP 与TEADs之间的联系等方面有待进一步深入探讨。
【Author contributions】HUANG Cuixia performed the experiments and wrote the article.ZHANG YAqian,YANG Aiping,LIU Ruihanqiu performed data collection and statistical analysis.LU Yan designed the study and reviewed.the article.All authors read and approved the final manuscript as submitted

