吸附树脂对唾液酸的分离纯化
张振,李丹,陈辰,吴菁岚,应汉杰,乔浩
(南京工业大学国家生化工程技术研究中心,江苏 南京 211816)
唾液酸(sialic acid,SA)是含有9个碳原子的一类羧基化单糖酰化衍生物的统称[1-2]。因为N-乙酰神经氨酸最广泛存在于自然界,所以通常所说的SA 是指N-乙酰神经氨酸,本文中提到的SA 均为N-乙酰神经氨酸。N-乙酰神经氨酸纯品为无色固体,无气味,易溶于水,在水溶液中不发生变旋作用,CAS 登记号为131-48-6,分子式为C11H19NO9,分子量为306.3[3]。同时N-乙酰神经氨酸在碱性环境中不稳定,易溶于水,在甲醇和乙醇中微溶,在乙醚和酯类等溶剂中溶解度较低。SA在动物细胞表面的糖蛋白和糖脂的糖链末端上广泛地分布,能够在细胞表面多种生理功能活动中发挥重要作用[3-4]。SA可以给大脑提供营养,是一种纯天然的营养素,对于婴儿的记忆提升和智力发育有很大的促进作用[5],因此可以作为婴幼儿配方奶粉的组成成分。SA 因其本身能作为可被识别的受体用来掩盖其他分子,所以被用来遮盖恶性肿瘤细胞表面的抗原决定簇,增强机体自身的免疫力。与此同时SA及其衍生物因其重要价值,在治疗流感、神经性疾病、炎症、肿瘤等方面也发挥着重要的作用[6-8]。
目前制备SA 的方法主要有:化学合成法,该方法用N-乙酰甘露糖胺和二叔丁基氧代丁二酸的钾盐缩合,在碱的催化下经脱羧反应可生成N-乙酰神经氨酸[9],缺点是反应条件苛刻;酶法合成法,该方法利用N-乙酰甘露糖胺、丙酮酸钠和ATP 在SA 醛缩酶的催化下合成N-乙酰神经氨酸[10-11],缺点是合成原料价格昂贵;天然物抽提法,Juneja等[12]从禽蛋的蛋黄膜和系带中提取SA已获成功并已应用于生产,Whitehouse 等[13]从牛乳乳清中提取SA,Schauer 等[14]报道了用热乙醇法从血清中提取SA,该方法缺点是过程复杂,收率较低。目前被广泛应用的SA 制备方法为生物转化法,该方法主要是以N-乙酰葡萄糖胺和过量的丙酮酸钠为底物,以N-乙酰甘露糖胺为中间产物,通过生物合成的方法得到SA[15]。生物转化法具有成本低廉、操作简单的优势,为后续大规模生产SA 提供了可能。目前从转化液中分离回收SA 主要通过强甲酸型的碱树脂吸附SA,以甲酸作为洗脱剂[16]。甲酸属于危险化学品,腐蚀性大,会导致对SA 产品二次污染;且树脂预处理步骤和后续再生过程比较复杂,造成SA的分离成本高。
本文采用一种实验室自制的新型吸附树脂RH-1来分离回收转化液中的SA,仅用水就可实现高效洗脱,研究了SA 在树脂上的吸附平衡和吸附动力学以及不同工艺条件下的柱动态吸附和解吸的过程。
1 材料和方法
1.1 实验原料
唾液酸转化液,由南京工业大学国家生化中心提供,以N-乙酰葡萄糖胺和过量的丙酮酸钠为底物混合培养催化合成SA,最终转化液中SA含量为20~35g/L。
转化液的预处理:首先通过离心去除发酵液中的微生物细胞及其残片等(4000r/min,20min),之后得到的上清液通过超滤进一步地去除杂蛋白和色素等杂质,即可得到包含目标产物SA的清液。
树脂的预处理:吸附树脂RH-1由南京工业大学国家生化中心提供,实验前将树脂先在无水乙醇中充分浸泡并不断用玻璃棒搅拌,将树脂中不溶于水的化合物充分洗出,浸泡完毕后用纯水将树脂上的乙醇冲净以便备用。
1.2 SA检测方法
SA分析方法由文献[17]改进得到。使用安捷伦高效液相色谱法(安捷伦1260型示差检测器),固定相为a Bio-Rad Aminex HPX-87H column(300mm×7.8mm)、流动相为10mmol/L H2SO4、流速为0.4 mL/min、柱温为55℃、进样量为20μL。
1.3 SA吸附等温线实验
经过预处理之后的树脂,通过抽滤抽干水分,准确称取4g湿树脂放入50mL的锥形瓶中。接着加入20mL 的SA 溶液,紧接着使用封口膜将锥形瓶密封完好,将密封完好的锥形瓶放入恒温摇床以120r/min 的速度振荡10h,振荡至溶液和树脂充分平衡后,取上清液测定溶液中目标产物的浓度,计算交换容量。树脂的静态吸附容量见式(1)。
式中,qe为树脂平衡吸附量,mg/g;c0为溶液初始浓度,g/L;ce为溶液达到吸附平衡时溶质的平衡浓度,g/L;m为树脂的质量,g;V为溶液体积,mL。
1.4 SA吸附动力学实验
把三口烧瓶置于恒温水浴中搅拌预热至所需温度后,准确地称取40g湿树脂,将其放入三口烧瓶中,并且加入240mL的料液,以200r/min的搅拌速率进行搅拌。立即搅拌计时,间隔一定时间取溶液测定SA 浓度。以时间t为横坐标,树脂吸附的SA浓度为纵坐标作出SA的动力学曲线。
1.5 SA动态吸附实验
将初始浓度c0的目标产物溶液,用蠕动泵以一定的进样流量输入装满树脂的带夹套的玻璃离子交换柱中,玻璃柱内部直径2cm,长度27cm,夹套内通入用来保持恒温环境的循环水。在柱的出口处用分布收集器定量收集样品流出液,流出液每隔5min 收集一次,检测其中的SA 浓度,直到流出液中SA 的浓度与进料液中的浓度相等,说明此时的树脂吸附达饱和。以流出液的体积为横坐标,SA流出液浓度与初始溶液浓度的比值c/c0为纵坐标作图。考察温度、流速、高径比、进样浓度对SA 动态吸附的影响,得到不同条件下的穿透曲线。
2 结果与讨论
2.1 SA在树脂上的静态吸附结果
2.1.1 SA在树脂上的吸附等温线模型
考察了在不同温度(10℃、30℃、50℃)下,SA 在RH-1 上的吸附行为,并用Henry 模型[18-19]进行拟合。
Henry吸附等温线模型如式(2)所示。
式中,qe为树脂达到吸附平衡时的平衡吸附量,mg/g;kL为Henry吸附等温线Henry常数;ce为达到吸附平衡时溶液中的溶质的质量浓度,g/L。
2.1.2 温度对SA吸附等温线的影响
采用Henry 模型对SA 的吸附等温线实验得到的数据进行拟合,结果如图1所示,拟合得到的结果列于表1中。由拟合得到的结果可以看出不同温度下SA 在RH-1 树脂上的吸附均满足Henry 模型(R2=0.998),表现出了线性吸附行为。
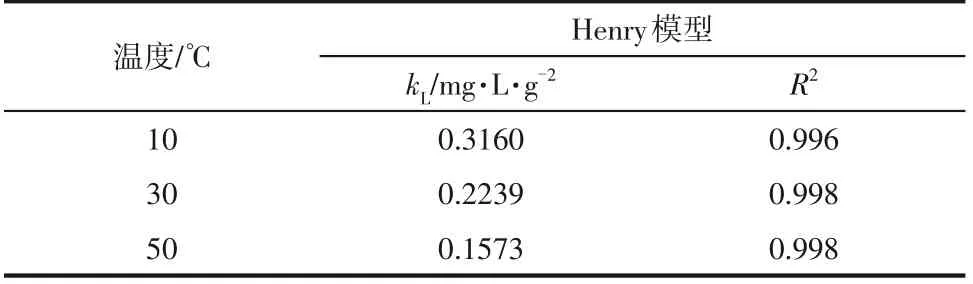
表1 SA在RH-1树脂上的吸附平衡参数

图1 不同温度下SA在RH-1树脂上的吸附等温线
由图1 可知,SA 在RH-1 树脂上的Henry 系数随着温度的升高而降低,这说明SA 在树脂上的吸附过程是一个放热的过程[20-21],降低温度有助于吸附,升高温度有助于解吸。
2.2 树脂吸附SA动力学
2.2.1 表面扩散模型
利用表面扩散模型[22]研究RH-1树脂吸附SA的动力学,考察吸附时间t与树脂吸附量之间的关系。表面扩散模型可以模拟RH-1 树脂吸附SA 的动力学过程,也可以模拟SA 在树脂RH-1 颗粒表面的扩散过程。通过表面扩散模型对不同初始浓度条件下SA吸附动力学曲线进行拟合。
表面扩散模型如式(3)所示。
式中,r为树脂的半径,m;t为吸附时间,s;De为有效扩散系数;Q为体积浓度,g/L。
当边界和初始条件为0时:
当r=0时,= 0,Q=0,t=0
当Q=q时,r=rP,t=无穷大
式中,q为实际进样浓度,g/L;rP为实际所用树脂半径,m。
平均绝对偏差D(%)如式(4)所示。
式中,cexp为实验浓度;cpred为根据拟合模型的浓度预测值。当D值最小时,就表明该模型能很好地描述该动力学过程。
2.2.2 初始浓度对SA吸附动力学的影响
据初始条件温度30℃,搅拌速率200r/min,分别选择SA 初始浓度为10g/L、26.5g/L、60g/L 的实验数据用表面扩散模型进行拟合,考察不同的初始浓度对其影响。以吸附时间t为横坐标,树脂吸附量为纵坐标,实验与拟合结果如图2所示,模型的参数与其相关联的平均偏差列于表2中。
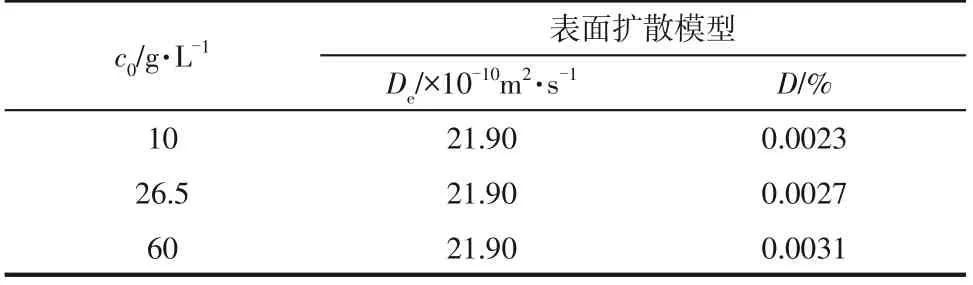
表2 不同操作条件下表面扩散模型参数

图2 不同初始浓度条件下SA在RH-1树脂上吸附动力学
由图2可以看出,SA在10min左右在树脂上达到吸附平衡,说明SA 在树脂上的传质速率较快。随着SA 初始浓度的增加,树脂对其吸附量也在增加。
由表2 可知,在同一温度下,不同SA 的初始浓度,其De值一直保持稳定,表明物质的表面扩散能力并不随着溶液初始浓度的改变而改变。平均绝对偏差较小,表明表面扩散模型能够很好地拟合SA在RH-1树脂上的动力学过程。
2.3 SA的动态吸附与解吸行为
2.3.1 不同温度下SA在RH-1上的穿透曲线
考虑在不同的温度下,SA在RH-1树脂上的穿透曲线,结果如图3所示。由图3可知,随着温度的升高,SA 的穿透曲线提前[23],其原因是该吸附过程为放热过程,温度升高使得SA 在树脂上的吸附量下降,从而导致了SA 穿透曲线的提前,这与测定的吸附等温线结果一致。由此可见,高温更有利于SA在树脂上的洗脱。随着温度的升高,SA在树脂上的传质速率增大,能更快地达到吸附平衡。

图3 温度对SA在RH-1树脂上穿透曲线的影响
2.3.2 不同初始浓度下SA在RH-1上的穿透曲线
分别测定不同初始质量浓度(10g/L、30g/L 和50g/L)条件下SA 在RH-1 树脂柱上的穿透曲线,结果如图4所示。由图4可知,不同初始浓度的SA在达到吸附平衡时所用时间相同,随着SA 初始浓度提高,穿透时间不变。实验结果显示树脂吸附容量随着SA浓度的提升而增大。

图4 初始浓度对SA在RH-1树脂上穿透曲线的影响
2.3.3 不同流速下SA在RH-1上的穿透曲线
考察在不同流速(1mL/min、1.5mL/min 和2mL/min)条件下SA在树脂柱上的穿透曲线,其结果如图5所示,由图5可知,在温度和进样浓度相同的条件下,流量对穿透曲线的影响是随着流速的增加,SA 穿透时间提前。由于吸附量是由其吸附等温线决定,所以流速对SA 在树脂上的吸附量没有影响[24]。随着流速的增大,唾液酸来不及在树脂上达到吸附平衡,就开始流出,因此穿透时间提前。在较低的流速下,有利于唾液酸在RH-1树脂上的吸附。但在较低的流速下,分离所需的时间也相应较长。因此将传质效率与生产效率结合在一起考虑,流速选择在1mL/min时较为合适。

图5 流速对SA在RH-1树脂上穿透曲线的影响
2.3.4 不同高径比下SA在RH-1上的穿透曲线
随着树脂柱的高径比增加,代表其理论塔板数增加,如果分离多组分物质,每个组分之间的分离度也会随其增加;但是增加高径比也会导致物质分离时间增加,柱压增大,导致耗能增加,降低生产效率。因此在不同高径比(6.5∶1、10∶1和13.5∶1)的条件下考察了SA在RH-1树脂柱中的穿透曲线,结果如图6。

图6 高径比对SA在RH-1树脂上穿透曲线的影响
由图6 可知,SA 的穿透时间随着高径比的增加而延长,吸附平衡时间增加,导致所需SA 进样量增加。为实现多组分的高效分离,因此可以选择较大的高径比。
2.3.5 SA在RH-1树脂上的动态吸附-解吸曲线
图7 是在温度30℃、流速为1mL/min、进样的质量浓度为35g/L、进样量为0.1BV(1BV=11.2mL)、高径比为13.5∶1的条件下SA在树脂上的吸附-洗脱曲线。由图7可知,采用水为洗脱剂,可以很快地把吸附在树脂上的SA给洗脱下来,最终经计算SA收率达到了99.8%。
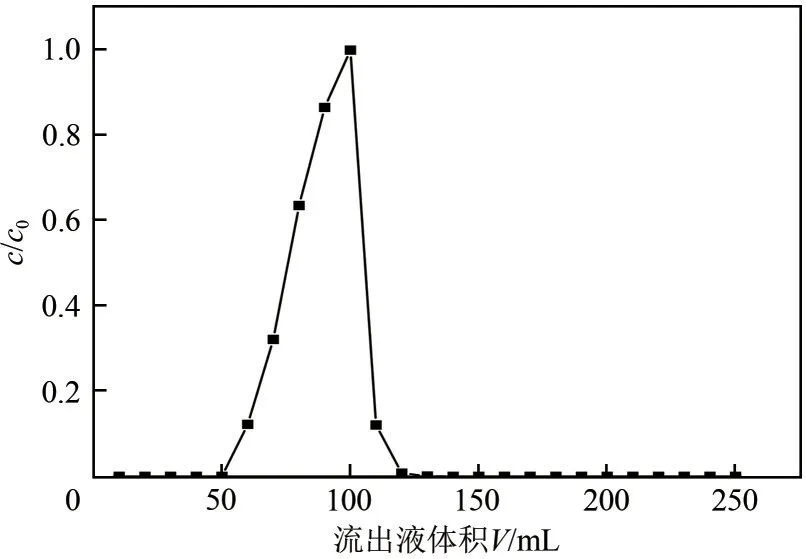
图7 SA在RH-1树脂中的动态吸附-脱附曲线
3 结论
选用了一种实验室自制的吸附树脂RH-1用于SA的吸附分离,结论如下。
(1)静态吸附实验说明,Henry 模型能够很好地拟合SA 的吸附等温线,随着温度升高,树脂对SA 的吸附量减小;动力学实验说明,SA 在RH-1树脂上的吸附动力学曲线符合表面扩散模型,且SA在树脂上的吸附速率较快,10min内即可达到吸附平衡。
(2)研究了温度、进样料液浓度、上样流速、高径比对树脂RH-1 吸附SA 的穿透曲线的影响,获得了较佳动态吸附工艺条件:温度30℃,流速1mL/min,料液浓度35g/L,高径比13.5∶1。经纯水洗脱后,SA收率为99.8%。

