Ag/Cu耦合催化剂的Cu晶面调控用于电催化二氧化碳还原
刘毅,房强,钟达忠,赵强,李晋平
(1 太原理工大学化学工程与技术学院,山西 太原 030024;2 气体能源高效利用山西省重点实验室,山西 太原 030024)
如今,越来越多的化石燃料被消耗,大量温室气体二氧化碳被释放到大气中,这不可避免地导致了严重的气候变化[1-3]。电催化还原CO2技术可以通过降低大气中CO2的浓度来减少碳排放,并且能够利用可再生能源将二氧化碳转化为高能量密度的碳燃料,是减缓温室效应、实现全球碳中和有效的途径[4]。然而在涉及多电子转移的催化过程中,普遍存在着高过电位、低选择性等问题[5-8]。因此,探索具有高选择性及活性的催化剂是实现CO2电还原目标的重要手段。
铜是研究最为广泛的催化剂,因为它可以将CO2还原为各种C2+产物(乙烯、乙醇等),这归因于铜具有独特的电子结构[9-11]。但是铜基催化剂在电催化二氧化碳还原过程中竞争性析氢比较严重,因此其催化性能受到了严重的影响。目前,大量的研究都致力于提高铜对C2+产物的选择性。如铜与杂原子掺杂、与碳材料结合[12]、通过与其他金属结合形成双金属催化剂[13-15]以获得一种活性界面[16-17]或者构造一个缺陷[18-19]等。在所有这些研究中,双金属催化剂被广泛研究,因为它们改变了单个金属的电子和几何结构[20]。Cu 基双金属催化剂可以通过调节催化剂表面关键中间体的吸附来提高电还原二氧化碳对不同产物的选择性。以往的工作表明,Ag催化剂有利于还原CO2至CO[21],通过构建Ag/Cu耦合的催化剂有利于提升Cu 表面的CO 覆盖度,促进CO 转化为碳氢化合物[22]。Wang 等[23]构造了纳米银颗粒均匀分布在纳米铜颗粒表面的复合材料,对电还原CO2具有良好的催化活性,乙烯在-1.1V(vs.RHE)电位下的法拉第效率达到42%。Hou 等[4]采用均匀分布在多孔网状铜纳米线表面的微小Ag纳米粒子构建了Ag/Cu复合结构,CO2还原为乙烯的法拉第效率达到41.3%。Zhong 等[24]研究出了Cu的平均孔径为4.9nm的多孔Ag@Cu催化剂,在施加电流密度为300mA/cm2时,表现出最高的性能,C2+产物法拉第效率为73.7%。另一方面,Cu的晶面对C—C 耦合具有决定性作用,比如说,有的研究表明Cu(100)晶面有助于C2+产物的生成[25]。此外,Wu 等[26]也发现了暴露(100)和(111)晶面的铜晶体有利于二氧化碳还原为具有高附加值的C2+产物,这是由于Cu(100)/Cu(111)界面提供了良好的局部电子结构,增强了*CO 吸附,降低了C—C 耦合活化能垒,表现优于Cu(100)和Cu(111)的性能。
基于此,本文通过调控Cu2O 暴露的晶面[Ag/Cu2O-(100)、Ag/Cu2O-(111)和Ag/Cu2O-(100/111)],从而还原得到了三种Ag 掺杂Cu(100)、Cu(111)和Cu(100)/Cu(111)晶面的Ag/Cu 耦合催化剂,并对其还原性能进行了分析。本文通过实验研究发现,三种催化剂在-1.1~-1.7V(vs.RHE)区间电位范围内对乙烯的选择性均先增大后减小,在-1.3V(vs.RHE)时对乙烯有最高选择性。其中,具有Cu(100)/Cu(111)的Ag/Cu-(100/111)催化剂在-1.3V(vs.RHE)之后的电位下,对C2+产物的选择性要明显高于其他两种催化剂,说明Cu(100)/Cu(111)界面比Cu(100)晶面和Cu(111)晶面具有更强的C—C 耦合能力。Ag/Cu-(100/111)催化剂中的高活性Cu(100)/Cu(111)界面,增强了*CO的吸附和*CO的二聚反应,从而提高了对C2+产物的催化活性。
1 材料和方法
1.1 材料
Cu(NO3)2·3H2O、CuCl2·2H2O、NaOH、AgNO3、KHCO3,中国医药集团;D-(+)-葡萄糖和聚乙烯吡咯烷酮(PVP,MW=24000),阿拉丁试剂(上海)有限公司。所有试剂在使用前均没有进行纯化。实验用水为超纯水,电阻为18.25MΩ/cm。
1.2 合成Ag/Cu2O催化剂
1.705g CuCl2·2H2O 和PVP 溶解于90mL 超纯水中,水浴加热到60℃,逐滴滴加10mL NaOH(3mol/L)。30min 后加入1.2g D-(+)-葡萄糖。反应3h之后,将10mL AgNO3(0.04mol/L)逐滴滴入混合液中,0.5h 后形成Ag/Cu2O 催化剂。Ag/Cu2O-(100)和Ag/Cu2O-(111)催化剂的PVP 用量分别为0g 和4.5g。所有过程均在持续剧烈搅拌下进行。将离心后催化剂在10000r/min 的转速下离心6次(超纯水和乙醇交替离心各三次),最后将离心所得到的催化剂在60℃真空烘箱中干燥10h。
1.55g Cu(NO3)2·3H2O 溶解于50mL 超纯水中,油浴加热到98℃,之后将5mL NaOH(6mol/L)缓慢滴入上述溶液。5min 后,加入0.8g D-(+)-葡萄糖。反应1h 之后,将10mL AgNO3(0.04mol/L)逐滴滴入混合液,半小时后形成Ag/Cu2O-(100/111)催化剂。所有过程均在持续剧烈搅拌下进行。将离心后催化剂在10000r/min 的转速下离心6次(超纯水和乙醇交替离心各3 次),最后将离心所得到的催化剂在60℃真空烘箱中干燥10h。
1.3 工作电极的制备
首先,将6mg 催化剂超声溶解在590μL 异丙醇、350μL去离子水和60μL 5%的Nafion溶液混合而成的溶液中,形成分散均匀的混合液。在面积为0.28cm2的玻碳电极上滴加10μL的混合液,形成工作电极。玻碳面上催化剂的负载量为0.2mg/cm2。滴加的混合液完全干燥后,对催化剂进行性能测试。
1.4 结构表征
使用配有顶空进样器的安捷伦气相色谱仪(HS-GC System)测试了催化剂对各种气相产物以及液相乙醇的选择性,其中,色谱前检测器FID的温度是250℃,色谱柱温度是80℃,色谱使用两根毛细柱,其中,测试气相产物的毛细柱为HPPLOT Q 柱(30m×0.32mm×20.00μm),测试液相所使用的毛细柱为HP-INNOWax 色谱柱(60m×0.32mm×0.5μm);使用X射线衍射仪(XRD,Bruker D8 Discover)分析鉴定了样品的晶体结构;通过场发射扫描电镜(SEM,SU8010 Japan)和场发射透射电镜(TEM,JEM-2100 Japan)研究了催化剂还原前后的表面形貌,还原前催化剂SEM 制样方法是通过棉棒将干燥的粉末催化剂粘在样品台的导电胶上并进行喷金,然后进行SEM 表征;催化剂还原后TEM的制样方法为:首先将催化剂进行还原,之后将还原后的催化剂通过超声溶解到乙醇中,然后将乙醇滴在铜网上进行TEM 表征;通过X 射线光电子能谱仪(XPS,VG Scientific UK)测定了催化剂的化学价(XPS数据在使用前均与C的标准峰284.8eV进行校正)。
1.5 电化学CO2还原性能测试
使用H型电解槽对制备的催化剂电化学性能进行了测试。这种H型电解槽是三电极体系,其中商用Ag/AgCl 作为参比电极(以饱和KCl 作为填充溶液),铂电极作为对电极,滴有催化剂的玻碳电极作为工作电极。电解槽的阳极室和阴极室由质子交换膜隔开。采用0.1mol/L的KHCO3作为阳极和阴极电解质。反应前,通入CO2使阴极室KHCO3电解液达到饱和状态,在-1.1V(vs.Ag/AgCl)下还原Ag/Cu2O催化剂1h,得到目标Ag/Cu催化剂。在电化学还原CO2的过程中,CO2气体连续进入阴极室,流速设置为50mL/min。在恒压条件下,比较了各种催化剂的CO2电催化性能。用气相色谱法测定各种气相产物的含量,气相色谱采用外标法。根据气相色谱法测定的气体浓度和产生的电流,计算出每种电位下各种气体的法拉第效率。使用顶空进样器对液相产物进行测试,计算出催化剂对乙醇的选择性,测试过程中均没有使用iR补偿。
2 结果与讨论
通过XRD、SEM、XPS表征研究了催化剂的晶体结构和形貌。根据图1(a)所示的X射线衍射图谱(XRD),铜的存在形式主要是Cu2O。三种Ag/Cu2O催化剂的XRD光谱显示出的特征峰在2θ为29.18°~77.84°的范围中对应于Cu2O(PDF No.05-0667)[27]。除此之外,在38.1°处观察到Ag(PDF No.04-0783)的(111)晶面对应的特征峰[28]。Cu 2p 的高分辨率XPS 谱在结合能(932.5±0.2)eV 处和(952.5±0.2)eV 处有两个峰,对应Cu+2p3/2和Cu+2p1/2,这与之前的报道[29]一致[图1(b)]。此外,在934.8eV 和954.8eV 处也能分辨出低强度的特征峰,分别与Cu2+2p1/2和Cu2+2p3/2有关,表明Cu2O纳米结构中存在少量CuO。Cu2+的存在是由于Cu+的氧化,因为Cu2O 在空气中不稳定,容易氧化[30]。与此同时,Ag 的谱图在374.1eV 和368.1eV 证实了Ag0存在[图1(c)][31-32],这证明银在铜表面的成功引入。
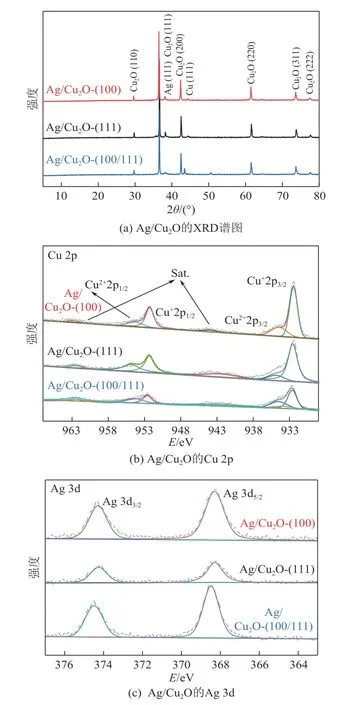
图1 Ag/Cu2O的结构表征
Ag/Cu2O催化剂在不同倍率下的SEM图像如图2所示。催化剂的粒径相近,并呈现出三种不同的形貌。图中可以看出,Ag/Cu2O-(100)和Ag/Cu2O-(111)的形貌不同是由于在水热过程中是否加入PVP 所致[33]。水浴过程中加入PVP可以改变成核过程,从而得到具有不同晶面的Ag/Cu2O 催化剂。EDS 谱图结果也证明Ag 的成功掺杂。ICP 测试结果表明,三种不同催化剂中银的掺入量相同,排除了银的含量对催化剂性能的影响(表1)。

图2 不同倍数下的SEM图和相应的Cu、Ag EDS谱图
将Ag/Cu2O在-1.1V(vs.Ag/AgCl)的恒电位下进行1h 的还原制备Ag/Cu。根据还原后得到的Ag/Cu XRD谱图(图3)可以观察到金属Cu(111)、(220)的两个衍射峰,Cu2+完全转化为金属Cu,说明催化剂还原完全。为了进一步了解Ag/Cu的微观结构,对其进行了还原后的SEM以及TEM 表征(图4、图5),可以看到,三种催化剂基本保持了还原前的形貌,并且颗粒大小没有发生改变。通过Ag/Cu-(100/111)EDX映射图像(图6)可以看出,Ag相对比较均匀地分布在Cu的表面。

图3 Ag/Cu催化剂的XRD谱图

图4 Ag/Cu催化剂的SEM图像

图5 Ag/Cu催化剂的透射电镜图像

图6 Ag/Cu-(100/111)的透射元素分析图
采用H 槽在-1.1~-1.7V(vs.RHE)的电位范围内对Ag/Cu 催化剂的电化学还原CO2性能进行了测试。各种产物的法拉第效率如图7所示。Ag/Cu-(100/111)和Ag/Cu-(100)均展现了对乙烯优异的选择性以及对析氢反应的抑制。Ag/Cu-(100/111)表现出整体更高的C2+产物选择性和部分电流密度。在-1.3V(vs.RHE)之后的电位下Ag/Cu-(100/111)对C2+产物的选择性最优[图7(d)],这是由于C1产物CH4的生成路径被抑制。电流密度是衡量催化剂电化学性能的另一个标准。图8 是不同电位下Ag/Cu耦合催化剂的各种电流密度对比。Ag/Cu-(100)和Ag/Cu-(100/111)总电流密度几乎相同,均大于Ag/Cu-(111);在-1.3V(vs.RHE)时Ag/Cu-(100)的C2+部分电流密度略高于Ag/Cu-(100/111),但在随后的电位下,后者C2+部分电流密度高于前者,这与C2+产物的法拉第效率趋势相一致。可以看出具有Cu(100)和Cu(111)晶面的Ag/Cu-(100)/(111)耦合催化剂与Ag/Cu-(100)和Ag/Cu-(100/111)相比,存在一种Cu(100)/Cu(111)界面,该结构增强了*CO 吸附并降低了*CO 二聚化的活化能垒,提高了Ag/Cu-(100)/(111)耦合催化剂对C2+产物选择性,这与先前Wu等[26]的工作一致。

图7 Ag/Cu催化剂的产物法拉第效率及C2+产物法拉第效率对比

图8 Ag/Cu催化剂的各种电流密度
通过测试的电化学阻抗谱(EIS)进一步解释了不同形貌催化剂的反应动力学差异(图9)。Ag/Cu-(100/111)表现出更小的半圆直径,表明其具有最小的电荷转移电阻,说明Ag/Cu-(100/111)催化剂还原CO2的电子转移速度最快。

图9 Ag/Cu的EIS谱图
3 结论
综上所述,具有Cu(100)和Cu(111)晶面的Ag/Cu-(100)/(111)耦合催化剂具有优异的将CO2还原至C2+产物的性能,能够抑制析氢反应以及C1产物CH4的生成,提高催化剂对C2+产物的选择性,在较宽的电位下表现出最优的C2+法拉第效率及其部分电流密度,在电位为-1.5V(vs.RHE)时,C2+产物的最大法拉第效率达到57.7%,部分电流密度8.92mA/cm2。Ag 促进了CO2向CO 转变,Cu(100)/Cu(111)晶面界面增强了*CO 的吸附,进一步促进了*CO 二聚成C2+产物。该工作为后续Cu 基双金属材料及其晶面调控对提高C2+产物选择性方面提供了理论指导,将会启发和指导合理设计其他更具活性和选择性的电催化剂,以实现大规模的电催化CO2还原应用。

