外泌体介导的miR-663a通过调控TGF-β1/Smad信号通路影响结肠癌细胞侵袭和迁移
任俊宇 周锐泽 雷梓 许宁 黄凤昌 李文亮
(昆明医科大学第一附属医院 1肿瘤科,云南 昆明 650032;2病理科)
结肠癌是消化道最常见的恶性肿瘤之一,其发生发展受多种因素影响,是一个多基因、多步骤的复杂过程〔1〕。由于结肠癌患者的早期症状不明显,通常在初诊时已为晚期,且预后不佳〔2〕。尽管目前在手术、放化疗和综合生物治疗等治疗策略上取得了较大进步,但晚期结肠癌患者的总生存率依然很低〔3〕。因此,探寻新的治疗结肠癌的策略具有重要的意义。外泌体是由细胞分泌的直径为30~100 nm的小囊泡,其含有丰富的蛋白质、miRNA等细胞特异性分子,可介导细胞间的物质交换和信息交流,在多种生理和病理生理过程中均发挥着至关重要的作用〔4〕。据报道,位于染色体20q11.1上的miR-663a在肝癌组织和细胞中表达下调,过表达miR-663a可抑制细胞的增殖、侵袭〔5〕;而转化生长因子(TGF)-β1/Smad信号通路是细胞内重要的信号传导途径,可介导结肠癌细胞的增殖、迁移等生物学过程,抑制该信号通路的活化可以降低结肠癌细胞增殖、并诱导其凋亡〔6〕。但外泌体介导的miR-663a对结肠癌细胞的侵袭和迁移及TGF-β1/Smad信号通路的影响尚未见报道。本研究旨在探索外泌体介导的miR-663a对结肠癌细胞的侵袭和迁移的影响及可能的分子机制,以期为研发新的治疗结肠癌手段提供新方向。
1 材料与方法
1.1结肠癌细胞 人骨髓间充质干细胞(BMSC)、人结肠癌细胞株HT-29、Caco-2、SW480、HCT-116及人正常结肠上皮细胞株NCM460均购自中国科学院上海细胞库。
1.2主要试剂与仪器 miR-663a模拟物(miR-663a mimics)及其阴性对照(miR-NC)、TaqMan MicroRNA逆转录试剂盒均购自美国ThermoFisher公司;胎牛血清(FBS)、DMEM培养基、二喹啉甲酸(BCA)试剂盒均购自美国Bio-Rad公司;TransStart®Green qPCR SuperMix均购自TaKaRa公司;Trizol试剂、电化学发光(ECL)试剂盒均购自美国Sigma公司;CD63、CD81、TGF-β1、Smad2、Smad3、GAPDH兔多克隆抗体(anti-CD63、anti-CD81、anti-TGF-β1、anti-Smad2、anti-Smad3、anti-GAPDH)、辣根过氧化物酶(HRP)标记的羊抗兔二抗均购自美国Abcam公司;ABI7300实时荧光定量PCR系统购自美国ABI公司;CO2培养箱购自上海知楚仪器有限公司。
1.3细胞培养 BMSC细胞、人结肠癌细胞株HT-29、Caco-2、SW480、HCT-116和人正常结肠上皮细胞株NCM460均在含有10%FBS、100 U/ml青霉素、100 μg/ml链霉素的DMEM培养基中培养。培养条件为37 ℃,5%CO2。
1.4外泌体的收集 BMSC细胞在无FBS的培养基中处理2 d后,收集BMSC细胞培养上清液2 000 r/min离心10 min去除死细胞。丢弃沉淀后,将上清液转移到新的收集管中,采用微孔滤膜过滤后加入外泌体提取试剂至细胞上清液中,轻轻混匀后,4 ℃条件下过夜,次日以889 000 r/min超速离心70 min沉淀外泌体。弃去上清液后,将外泌体颗粒重新悬浮在磷酸盐缓冲液(PBS)中,即可获得外泌体。
1.5透射电子显微镜观察外泌体 取浓度为0.5 mg/ml的外泌体10 μl滴加至碳覆膜铜网上,吸附1 min后,用滤纸吸去多余液体并晾干,铜网上滴加10 μl醋酸铀染色液避光染色1 min,用滤纸吸去多余液体并晾干,上机,80 kV成像。
1.6外泌体转染 参照文献〔7〕,将1.4中所得的外泌体利用PBS重悬后,利用BCA法检测外泌体浓度,将miR-663a mimics或miR-NC与外泌体在无菌PBS中混合后,加入终浓度为0.1 mol/L的CaCl2,将混合物置于冰上,最后在4 ℃条件下,以30 000 r/min超速离心70 min分离外泌体,并分别命名为EXO组(未转染的外泌体)、EXO-miR-NC组(miR-NC转染外泌体)、EXO-miR-663a组(miR-663a mimics转染外泌体)。
1.7细胞分组 将获得的EXO组、EXO-miR-NC组、EXO-miR-663a组外泌体分别与SW480细胞共培养24 h,分别命名为SW480+EXO组、SW480+EXO-miR-NC组、SW480+EXO-miR-663a组,在SW480+EXO-miR-663a组中加入TGF-β1/Smad信号通路激活剂SRI-011381,命名为SW480+EXO-miR-663a+SRI组,另取SW480细胞记为SW480组作为对照。
1.8细胞内吞外泌体实验 采用外泌体红色荧光标记染料PKH26对BMSC来源的外泌体进行染色并严格按照说明书进行操作,将染色的外泌体加入SW480细胞培养液中,孵育24 h后,利用激光共聚焦显微镜进行观察。
1.9实时荧光定量聚合酶链式反应(qRT-PCR)检测miR-663a的表达 使用Trizol试剂提取细胞与外泌体中的总RNA,使用TaqMan MicroRNA逆转录试剂盒合成cDNA。随后,使用TransStart®Green qPCR SuperMix在ABI7300实时荧光定量PCR系统上进行扩增反应以确定miR-663a的表达水平。以U6为内参,使用2-ΔΔCt方法计算miR-663a的相对表达水平。所用引物为:U6-正向5′-CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGGCGGTCCC-3′, 反向5′-ACACTCCAGCTGGGAGGCGGGCGCCGCGG-3′;miR-663a正向5′-CTCGCTTCGGCAGCACA-3′,反向5′-AACGCTTCACGAATTTGCGT-3′。每个样品设置6个复孔。
1.10Western印迹检测蛋白表达 使用RIPA裂解缓冲液裂解细胞并提取总蛋白。通过10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离40 μg蛋白质,将蛋白质转移到聚偏二氟乙烯(PVDF)膜上,利用5%脱脂牛奶封闭2 h,然后分别加入一抗anti-CD63(1∶2 000)、anti-CD81(1∶3 000)、anti-TGF-β1(1∶1 000)、anti-Smad2(1∶4 000)、anti-Smad3(1∶5 000)、anti-GAPDH(1∶2 000)于4 ℃下孵育过夜,TBST洗膜3次后,加入辣根过氧化物酶(HRP)标记的羊抗兔二抗(1∶3 000)室温孵育1 h,使用ECL系统可视化蛋白质条带。使用ImageJ软件量化蛋白质的条带,并使用GAPDH作为对照,每个样品设置6个复孔。
1.11Transwell实验检测细胞侵袭与迁移 细胞迁移实验:将细胞用无FBS的DMEM培养基重悬并调整细胞浓度为2×105个/ml。取100 μl的细胞悬液接种到Transwell上腔室中,并将500 μl含有10%FBS的DMEM培养液添加到Transwell下腔室中。在5%CO2、37 ℃条件下孵育24 h后,用棉签擦拭上腔室中的细胞,并用100%甲醇固定,结晶紫染色20 min。然后,漂洗细胞并干燥。在倒置显微镜下随机选择6个视图观察,并统计细胞迁移数目。
细胞侵袭实验:将基质胶预先涂在Transwell上腔室中,待其自然干燥后,将各组细胞用无FBS的DMEM培养基重悬,调整细胞浓度为2×105个/ml。取200 μl的细胞悬液接种到预先涂有基质胶的上腔室中,其余步骤同细胞迁移实验。
1.12统计分析 采用SPSS25.0软件进行t检验、单因素方差分析、SNK-q检验。
2 结 果
2.1外泌体的鉴定 与人正常结肠上皮细胞株NCM460(1.05±0.11)比较,miR-663a在结肠癌细胞系HT-29、Caco-2、SW480、HCT-116中的表达水平(0.62±0.05、0.41±0.03、0.21±0.01、0.36±0.02)显著降低(P<0.05,n=6),且在上述结肠癌细胞系中,miR-663a在SW480中的表达水平最低。透射电子显微镜结果显示,BMSC细胞的外泌体均呈现出直径为30~100 nm的囊泡状结构,见图1。Western印迹结果显示,CD63(1.05±0.11 vs 0.09±0.01)和CD81蛋白(1.01±0.09 vs 0.07±0.01)在BMSC细胞的外泌体中的表达水平显著高于细胞裂解液(t=21.290、25.427,P均<0.001,n=6),见图2。
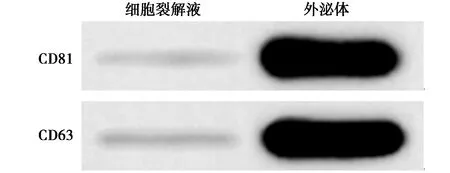
图2 Western印迹检测BMSC细胞外泌体和细胞裂解液中CD63和CD81蛋白的表达
2.2BMSC细胞内及BMSC细胞来源外泌体中miR-663a的表达 与BMSC组(1.05±0.13)比较,EXO组miR-663a表达(2.13±0.18)显著升高(t=11.915,P<0.05,n=6);与EXO组和EXO-miR-NC组(2.21±0.19)比较,EXO-miR-663a组表达(3.42±0.26)显著升高(t=9.204,P<0.05,n=6)。
2.3肿瘤细胞内吞外源性外泌体 激光共聚焦显微镜结果显示,PKH26标记的红色荧光的外泌体主要位于SW480细胞胞质内,并分布在核周围,大部分SW480细胞可见到红色荧光信号,见图3。

图3 激光共聚焦显微镜观察SW480细胞对BMSC细胞来源外泌体的摄取(×400)
2.4各组细胞侵袭数目比较 与SW480组比较,SW480+EXO组细胞侵袭数目显著降低(P<0.05);与SW480+EXO组和SW480+EXO-miR-NC组比较,SW480+EXO-miR-663a组细胞侵袭数目显著降低(P<0.05);SW480+EXO-miR-663a+SRI组细胞侵袭数目显著高于SW480+EXO-miR-663a组(P<0.05),见图4、表1。
表1 各组细胞侵袭、迁移数目及细胞中TGF-β1、Smad2、Smad3蛋白表达比较
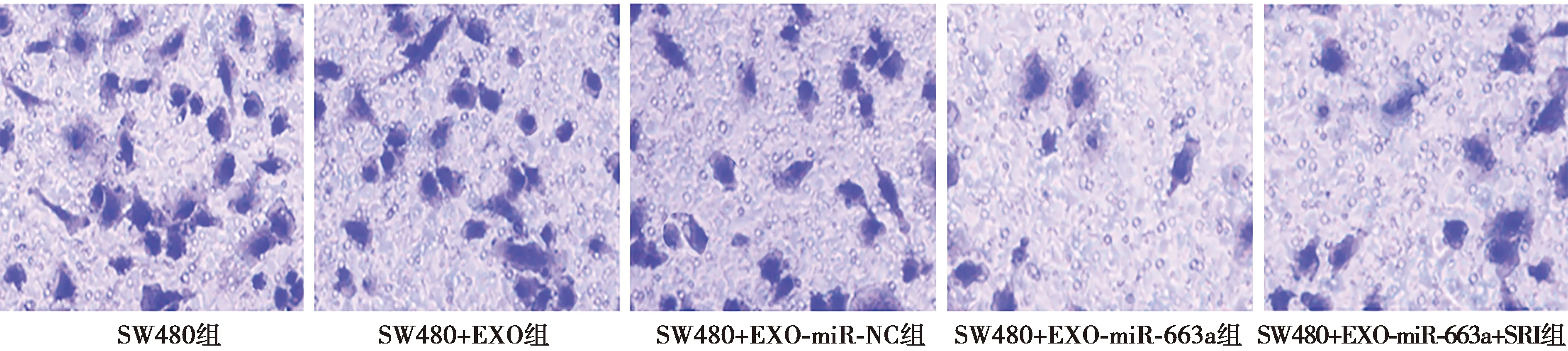
图4 Transwell 实验检测各组细胞侵袭(结晶紫染色,×200)
2.5各组细胞迁移数目比较 SW480+EXO组细胞迁移数目显著低于SW480组(P<0.05);SW480+EXO-miR-663a组细胞迁移数目显著低于SW480+EXO组和SW480+EXO-miR-NC组(P<0.05);SW480+EXO-miR-663a+SRI组细胞迁移数目显著高于SW480+EXO-miR-663a组(P<0.05),见图5、表1。
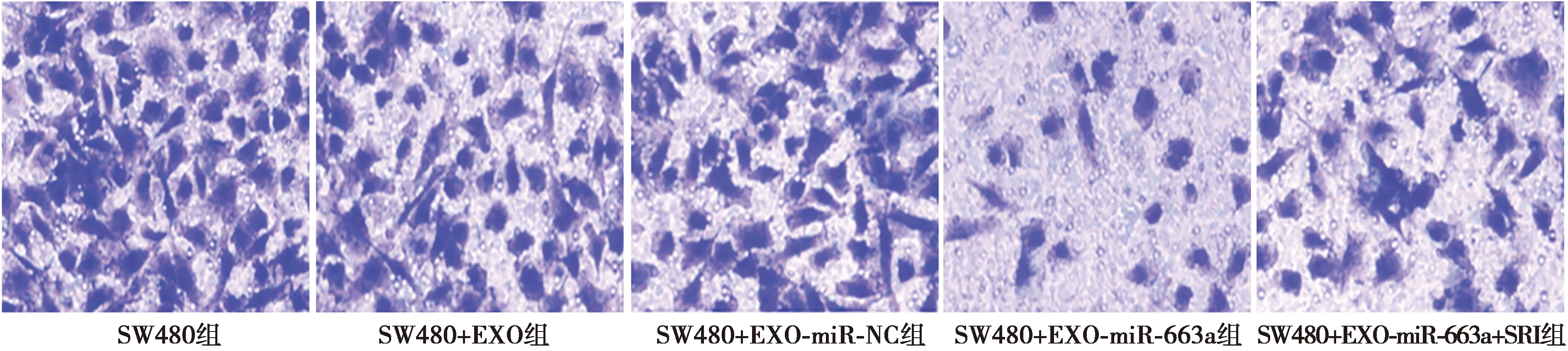
图5 Transwell 实验检测各组细胞迁移(结晶紫染色,×200)
2.6各组细胞中TGF-β1/Smad信号通路相关蛋白表达比较 SW480+EXO组细胞中TGF-β1、Smad2、Smad3蛋白表达水平显著低于SW480组;与SW480+EXO组和SW480+EXO-miR-NC组比较,SW480+EXO-miR-663a组细胞中TGF-β1、Smad2、Smad3蛋白表达水平显著降低(P<0.05);与SW480+EXO-miR-663a组比较,SW480+EXO-miR-663a+SRI组细胞中TGF-β1、Smad2、Smad3蛋白表达水平显著升高(P<0.05),见表1、图6。

1~5:SW480组、SW480+EXO组、SW480+EXO-miR-NC组、SW480+EXO-miR-663a组、SW480+EXO-miR-663a+SRI组
3 讨 论
外泌体是纳米级的细胞外囊泡,由于其能够稳定地传递药物、治疗性miRNA及蛋白质等,所以外泌体可以作为潜在的肿瘤靶向药物载体来治疗肿瘤〔8〕。此外,外泌体的药物递送系统具有将功能分子递送到细胞中及在血液中具有稳定性、先天生物相容性和免疫耐受性,因此与传统的药物递送系统相比具有许多优势〔9〕。本研究结果证明,成功获得BMSC来源的外泌体。
结肠癌是世界上第三大最常见的癌症,癌细胞的侵袭和转移是结肠癌相关死亡的主要原因之一〔10〕。研究表明,外泌体介导的miRNA在结肠癌肿瘤微环境中发挥着重要的调节作用〔11〕。李晓辉等〔12〕报道骨髓间充质干细胞来源携带高水平miR-196b-5p的外泌体可抑制结肠癌细胞增殖、迁移和侵袭,并诱导细胞凋亡;Xu等〔13〕发现骨髓间充质干细胞来源含有miR-16-5p的外泌体可抑制结肠癌细胞增殖、迁移和侵袭。miR-663a作为miRNAs中的一员,对生物的生长、发育、细胞增殖及分化起到重要的调控作用〔14〕。已有研究显示,miR-663a在非小细胞肺癌中下调并通过靶向JunD抑制增殖和侵袭〔15〕,但外泌体介导的miR-663a对结肠癌细胞的侵袭和迁移的影响尚不明确。本研究结果提示,外泌体中miR-663a的表达显著高于BMSC细胞,且外泌体转染成功;BMSC外泌体介导的miR-663a可抑制SW480细胞的侵袭、迁移。
TGF-β1/Smad信号通路在结肠癌的发生发展中起关键作用。据相关文献介绍,TGF-β1能够与其受体结合,进而刺激触发下游Smad2、Smad3信号的转导〔16〕。相关研究表明,TGF-β1信号传导促进了癌细胞的生长、侵袭和转移,抑制TGF-β1可防止转移性癌症进展〔17〕;脂多糖刺激巨噬细胞来源外泌体参与上皮细胞间质转化,该机制与激活TGF-β1/Smad2/3信号转导通路有关〔18〕;丹皮酚通过抑制TGF-β1/Smad信号传导和上皮间充质转化来抑制胰腺癌细胞迁移和侵袭〔19〕;间充质干细胞来源的外泌体通过抑制TGF-β1/Smad通路逆转上皮间质转化并促进受损子宫内膜的修复〔20〕。本研究结果显示,外泌体介导的miR-663a通过抑制TGF-β1/Smad信号通路来抑制结肠癌细胞的侵袭和迁移。
综上所述,外泌体介导的miR-663a通过抑制TGF-β1/Smad信号通路来抑制结肠癌细胞的侵袭和迁移。但是,影响结直肠癌侵袭和迁移的通路较多,miR-663a是否还通过其他通路作用于结肠癌细胞,尚需后续研究。

