外泌体miR-20a-5p 调控Sp1/CD147 信号通路促进非小细胞肺癌的骨转移
王 贇,胡 雯,刘理礼,杨 静,张 涛
(空军军医大学第二附属医院肿瘤内科,陕西 西安 710038)
肺癌是我国发病率及病死率最高的恶性肿瘤,其中非小细胞肺癌(non-small cell lung cancer,NSCLC)约占80%[1]。虽然肿瘤的治疗已经取得了极大的进展,但是大多数NSCLC 患者在确诊时就已经处于中晚期,且肿瘤广泛转移,导致患者预后较差,其中骨转移在NSCLC 患者中的发生率约为40%,患者中位生存时间仅6 个月左右,且骨转移带来的剧烈疼痛以及运动能力受损,严重影响患者的生存质量[2-3],因此,探究更多NSCLC 骨转移的机制以及治疗方法非常有必要。肿瘤外泌体可调控肿瘤的多种病理进程,包括转移、复发、耐药等[4]。研究表明,微小RNA(microRNA,miRNA)可影响肿瘤的生长、免疫逃逸及顺铂耐药等[5-7]。外泌体miRNA 在肿瘤的诊断和治疗中具有广泛的应用前景,外泌体中多种miRNAs 都被证实具有调控NSCLC 发生发展的功能,Wang 等[8]研究表明,NSCLC 外泌体miR-17-5p 通过靶向PTEN 促进破骨细胞分化。miR-20a-5p 在NSCLC 中显著高表达,并且可促进肿瘤血管新生[9]。但是关于miR-20a-5p 对NSCLC骨转移的影响及机制目前尚不清楚,本文探究NSCLC外泌体中miR-20a-5p 的表达及其对骨转移的影响及机制,以期为NSCLC骨转移的诊断和治疗提供参考。
1 材料与方法
1.1 材料
人支气管上皮细胞系16HBE 和人NSCLC 细胞系A549、PC9和H1299购自中科院上海细胞库;小鼠单核巨噬细胞RAW264.7购自美国ATCC。TRIzol试剂盒和Lipofectamine 2000 试剂盒购自美国Invitrogen 公司;PrimeScript™ RT reagent Kit和SYBR®Prime Script™ RTPCR Kit 购自日本TaKaRa 公司;6 周龄的雌性Balb/c裸鼠[动物生产许可证号:SYXK(京)2022-0052]共25 只购自北京维通利华实验动物技术有限公司;抗酒石酸酸性磷酸酶(tartrate resistant acid phosphatase,TRAP)染色试剂盒购自上海碧云天生物技术有限公司;CD9、CD81、HSP70、SP1、CD147、GAPDH 抗体,山羊抗兔IgG购自武汉三鹰生物技术有限公司。
1.2 细胞培养
于37 ℃、5%CO2的培养箱中,将16HBE、A549、PC9 和H1299 细胞使用含10%胎牛血清的DMEM 培养,RAW264.7 细胞使用含10%胎牛血清的RPMI-1640培养基培养。
1.3 外泌体的提取与鉴定
收集细胞培养上清液10 mL,3 000 r/min离心10 min去除细胞和凋亡碎片,取上清使用0.22 μm 的滤膜过滤,去除细胞碎片,然后100 000 r/min离心60 min后收集的白色沉淀即为外泌体。将所收集的外泌体用10 mL 无菌PBS 重悬,100 000 r/min 离心60 min 清洗外泌体,收集外泌体沉淀,通过透射电镜观察外泌体的形态,Western blot 法检测外泌体标志蛋白表达。16HBE、A549、PC9、H1299 以及转染miR-20a-5p mimic Negative Control(miR-NC)和miR-20a-5p mimic 的A549细胞外泌体分别记为16HBE exo、A549 exo、PC9 exo、H1299 exo、miR-NC exo和miR-20a-5p exo。
1.4 细胞转染与分组
将A549 细胞接种于6 孔板中,待细胞生长至密度达60%时进行转染,根据Lipofectamine 2000 说明书,将125 μL Opti-MEM 培养基与2 μg miR-20a-5p mimic(或miR NC)在1.5 mL 离心管中混匀,取5 μL Lipofectamine 2000 用Opti-MEM 培养基稀释至125 μL,将上述两种溶液混匀后室温静置15 min,6 孔板中更换为800 μL 培养基,然后将静置后的混合溶液滴加至6 孔板中,混匀后于细胞培养箱中孵育8 h,然后更换为新鲜DMEM完全培养基。
将A549 和RAW264.7 细胞分别与10 μg/mL 的16HBE exo、A549 exo、miR-NC exo、miR-20a-5p exo 以及等体积的PBS 共孵育24 h,设为16HBE exo 组、A549 exo组、miR-NC exo组、miR-20a-5p exo组和PBS组。
1.5 qRT-PCR检测miR-20a-5p的表达
使用TRIzol 试剂提取各组细胞及外泌体中的总RNA,根据PrimeScript ™ RT reagent Kit 说明书合成cDNA,根据SYBR®Prime Script ™ RT-PCR Kit 进行qRT-PCR 反应,反应程序为95 ℃ 3 min,1 次循环;95 ℃ 15 s,60 ℃ 1 min,40次循环。以U6为内参,2-ΔΔCt法计算miR-20a-5p相对表达量,引物序列见表1。

表1 miR-20a-5p和U6引物序列
1.6 Transwell小室检测细胞迁移和侵袭能力
将各组A549细胞用DMEM培养基稀释至1×105/mL,取稀释后的细胞溶液100 μL 接种于小室中,6 孔板中加入600 μL DMEM 完全培养基,小室放于板中,下层培养基没过小室底部,培养24 h 后取出小室,清洗后底部用4%多聚甲醛固定,结晶紫染色,清洗晾干后,拍照并统计细胞迁移数。将上述小室更换为铺有50 μL Matrigel 胶的小室,其余步骤同上,用于检测细胞侵袭能力。
1.7 破骨细胞分化与TRAP染色
将RAW264.7 细胞接种于24 孔板中,调整浓度为1×105个/孔,细胞生长至汇合度达70%~80%时,将24孔板中每孔更换为含30 ng/mL 巨噬细胞集落刺激因子(macrophage colony stimulating factor, M-CSF)和50 ng/mL核因子κB 受体活化因子配体(receptor activator of nuclear factor-κB ligand,RANKL)的α-MEM,并根据分组加入对应的外泌体,使培养液中的外泌体浓度为10 μg/mL,每2 天更换1 次培养基,共诱导4 d,然后去除孔内培养基,各孔用10%福尔马林中性缓冲液固定5 min,清洗孔板3 次,采用TRAP 染色试剂盒染色,去离子水清洗3次,显微镜下观察拍照。
1.8 小鼠体内实验
将6 周龄的雌性Balb/c 裸鼠随机分为PBS 组(A组)、16HBE exo 组(B 组)、A549 exo 组(C 组)、miR-NC exo组(D 组)和miR-20a-5p exo 组(E 组),每组5 只。各组小鼠分别注射10 μg 的PBS、16HBE exo、A549 exo、miR-NC exo 和miR-20a-5p exo,每周注射1 次,共注射4 周。注射外泌体4 周后,A549 细胞用无菌PBS 重悬并稀释至1×106/mL,用1%戊巴比妥钠溶液(10 mL/kg)腹腔注射麻醉小鼠,然后取100 μL A549 细胞接种于小鼠的左心室,28 d 后解剖,取小鼠的股骨和胫骨,制作病理切片观察肿瘤细胞转移情况。
1.9 HE染色
使用石蜡包埋各组小鼠的骨组织切片,用二甲苯脱蜡,经100%、95%、90%、80%、75%乙醇水化,苏木素染色5 min,伊红室温染色2 min,去除染色液,再于90%、95%、100%乙醇中浸泡1 min,二甲苯浸泡2 次,每次1 min,中性树脂封片后于显微镜下观察。
1.10 Western blot检测Sp1/CD147信号通路变化
根据蛋白裂解液说明书提取各组细胞或外泌体总蛋白,BCA 蛋白定量后,进行SDS-PAGE 凝胶电泳,稳压80 V,电泳40 min,待蛋白进入分离胶后调整电压为120 V,分离90 min;分离后转膜,稳定电流300 mA,时间90 min;PVDF 膜与CD9、CD81、HSP70、SP1、CD147、GAPDH 抗体低温孵育过夜,TBST 洗膜后,与山羊抗兔IgG 室温孵育1 h,洗膜后ECL 试剂盒显影,拍照。
1.11 统计学分析
采用GraphPad Prism7.0 软件绘制图形,采用SPSS 20.0 统计学软件进行数据处理,所有数据以均数±标准差()表示,2 组间比较采用t检验。P<0.05为差异具有统计学意义。
2 结果
2.1 外泌体鉴定结果
透射电镜下观察到A549 exo、PC9 exo、H1299 exo、16HBE exo 为具有双层膜的囊泡样结构,粒径在30~100 nm(图1a)。外泌体标志蛋白检测结果显示,A549 exo、PC9 exo、H1299 exo、16HBE exo 均表达CD9、CD81、HSP70(图1b),说明A549 exo、PC9 exo、H1299 exo、16HBE exo均符合外泌体的形态和生物学特征。
2.2 miR-20a-5p在NSCLC及其外泌体中显著高表达
NSCLC 细胞A549、PC9 和H1299 中miR-20a-5p 表达水平显著高于其在支气管上皮细胞系16HBE 中的表达(P<0.001),且A549 exo、PC9 exo 和H1299 exo 中miR-20a-5p 的表达高于16HBE exo(P<0.001),其中A549 细胞表达水平最高,所以选择A549 细胞进行后续研究。与miR-NC exo 相比,miR-20a-5p exo 中miR-20a-5p 表达显著上调(P<0.001),见图2,获得的miR-20a-5p exo为高表达miR-20a-5p的外泌体。

图2 各种细胞及外泌体中miR-20a-5p表达水平比较
2.3 miR-20a-5p促进NSCLC细胞的迁移及侵袭
与PBS 组相比,A549 exo 组A549 细胞迁移和侵袭数显著增加(P<0.001),而16HBE exo组细胞迁移和侵袭数量无显著变化(图3a);与miR-NC exo 组相比,miR-20a-5p exo组A549细胞迁移数和侵袭数均显著增加(P<0.001),见图3b,说明外泌体miR-20a-5p可促进A549细胞的迁移和侵袭。

图3 各组细胞迁移和侵袭细胞数目比较
2.4 NSCLC 外泌体转移miR-20a-5p 促进破骨细胞分化
qRT-PCR 检测显示,A549 exo 组RAW264.7 细胞中miR-20a-5p 表达显著高于PBS 组(P<0.001),而16HBE exo 组和PBS 组miR-20a-5p 比较无显著差异(图4a)。miR-20a-5p exo 组RAW264.7 细胞中miR-20a-5p 表达显著高于miR-NC exo 组(P<0.001),说明外泌体可向RAW264.7 细胞转移miR-20a-5p(图4b)。TRAP 染色结果显示,A549 exo 组破骨细胞形成数显著多于PBS 组(P<0.001),16HBE exo 组和PBS 组破骨细胞形成数无显著差异(图4c)。与miR-NC exo 组相比,miR-20a-5p exo 组破骨细胞形成显著增加(P<0.001),说明外泌体miR-20a-5p 可促进破骨细胞的分化(图4d)。

图4 外泌体转移miR-20a-5p促进破骨细胞分化
2.5 外泌体miR-20a-5p 促进NSCLC 细胞在小鼠体内的骨转移
HE 染色结果显示,A 组和B 组骨组织骨小梁结构完整,组织中有少量肿瘤细胞,骨髓腔相对完整,病变较少;C组小鼠骨组织附近出现大量肿瘤细胞,肿瘤细胞紧密排列,骨小梁显著破坏,核浆比例严重失调,病变显著。E 组小鼠骨组织中肿瘤细胞面积更大,骨小梁破坏更加严重,病变较D 组更加显著(图5)。说明NSCLC 外泌体以及外泌体miR-20a-5p 可显著促进肿瘤在小鼠体内的骨转移。
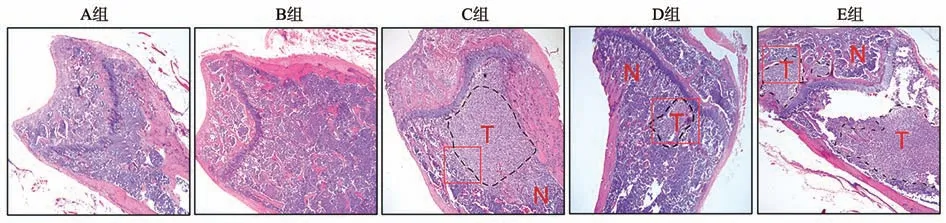
图5 各组小鼠肿瘤骨转移水平比较(×200)
2.6 外泌体miR-20a-5p激活Sp1/CD147信号通路
Western blot 结果显示,A549 exo 组RAW264.7细胞中Sp1 和CD147 表达显著高于16HBE exo 组和PBS 组(P<0.001),说明A549 exo 可促进破骨细胞中Sp1/CD147 信号通路的激活。与miR-NC exo组相比,miR-20a-5p exo 组RAW264.7 细胞中Sp1 和CD147 表达亦显著上调(P<0.001),说明外泌体通过转移miR-20a-5p 促进Sp1/CD147 信号通路的激活(图6)。

图6 各组细胞Sp1和CD147表达水平比较
3 讨论
NSCLC 是高发的恶性肿瘤,其发病机制尚不明确,但有研究指出,NSCLC 的发病与吸烟、二手烟、不良饮食习惯、生活环境等密切相关[10]。NSCLC 恶性程度高,患者在确诊时往往已经处于中晚期,其5年生存率不足5%,预后差[11]。大部分患者在癌症晚期出现肿瘤骨转移,严重影响生活质量,因此探究NSCLC 骨转移的机制,对其治疗至关重要。外泌体是由大多数细胞分泌的胞外囊泡,由于携带多种遗传物质,如DNA、miRNA、circRNA 等,可从基因层面或转录层面调控肿瘤细胞的恶性生物学行为[12-13],其中外泌体miRNA 具有广泛的临床应用前景,因此越来越多的研究定位于外泌体miRNA。
miR-20a-5p 是近年肿瘤研究的miRNA 之一,有研究表明,miR-20a-5p 可通过诱导血管新生从而促进NSCLC的生长和转移[9]。Yang等[14]研究发现,miR-20a-5p可通过抑制NR4A3 表达而促进膀胱癌转移。Cheng等[15]研究表明,miR-20a-5p 亦可通过抑制Smad4 表达而促进结直肠癌转移,提示miR-20a-5p 可能是调控NSCLC 发生发展的重要分子。此外,相关研究报道,miRNAs 失调可导致肺癌的发生及骨转移[16]。肺腺癌细胞和破骨细胞中发现部分miRNAs 可选择性纳入外泌体,并将其释放到细胞外空间,是骨转移“恶性循环”的潜在媒介[17]。然而有关外泌体miR-20a-5p 与肺癌相关的报道有限,因此本研究探究了外泌体miR-20a-5p 调控NSCLC 骨转移的可能作用机制,发现miR-20a-5p 在NSCLC 细胞以及外泌体中均显著高表达,提示miR-20a-5p 或外泌体miR-20a-5p 可能具有调控NSCLC 发生发展的作用。进一步研究发现,与NSCLC外泌体共孵育后,A549细胞中miR-20a-5p表达显著上调;与高表达miR-20a-5p 的外泌体共孵育后,A549 细胞中miR-20a-5p 表达会进一步上调,说明NSCLC 外泌体可向肿瘤细胞转移miR-20a-5p。且与高表达miR-20a-5p的外泌体共孵育后,A549细胞的迁移和侵袭能力均显著增加。NSCLC 外泌体通过转移遗传物质调控肿瘤转移已得到证实,Ma 等[18]研究表明,肿瘤外泌体可传递miR-3157-3p 而促进NSCLC 的血管新生和转移;Kim 等[19]研究发现,外泌体miR-1260b 可通过抑制HIPK2 从而促进NSCLC 的转移。因此,本研究推测,NSCLC 外泌体可通过转移miR-20a-5p进而促进肿瘤的转移。
为了探究外泌体miR-20a-5p 是否对NSCLC 骨转移具有调控作用,本研究将NSCLC 外泌体以及高表达miR-20a-5p 的外泌体与RAW264.7 细胞共孵育,发现NSCLC 外泌体作用后,RAW264.7 细胞向破骨细胞分化显著增加,高表达miR-20a-5p 的外泌体可进一步促进破骨细胞的分化。研究表明,肿瘤的骨转移是肿瘤细胞先通过分泌细胞因子促进破骨细胞成熟[20]。破骨细胞可破坏骨骼基质,从骨基质中释放出大量促进肿瘤生长的细胞因子,进而实现骨转移[21]。本研究在小鼠体内进行了验证,发现接受NSCLC 外泌体的小鼠肿瘤骨转移显著增加,给予高表达miR-20a-5p 的外泌体小鼠肿瘤骨转移进一步形成,说明外泌体miR-20a-5p可促进NSCLC 的骨转移。在机制上,本研究初步探究发现,NSCLC 外泌体诱导后破骨细胞中Sp1/CD147 信号通路被显著激活,外泌体miR-20a-5p 亦可进一步促进破骨细胞中Sp1/CD147 信号通路的激活。Sp1/CD147 信号通路是调控肿瘤骨转移的重要通路。Kong 等[22]研究指出,特异性Sp1 结合位点位于CD147启动子的CpG 区,Sp1 表达增加,CD147 表达上调。Wang 等[23]研究表明,在肺癌中,CD147 的表达可诱导IL-8 的分泌而促进破骨细胞的生成。因此,本研究得出,NSCLC 外泌体miR-20a-5p 可通过诱导Sp1/CD147信号通路激活进而促进破骨细胞的分化。
综上所述,NSCLC 外泌体可通过转移miR-20a-5p而激活Sp1/CD147 信号通路诱导破骨细胞的生成,进而促进肿瘤的骨转移,但外泌体miR-20a-5p 的临床应用还需进一步探究。

