乳腺癌细胞放疗后LncRNA RP3-340B19.3的表达以及干预对其生物学特性的影响*
吴茜茜,徐诗靓,赵玥昕,王凌霞,王波,杨欢,2(1.苏州大学附属第二医院a.检验科,b.肿瘤科,江苏苏州215004;2.苏州大学放射医学与辐射防护国家重点实验室,江苏苏州215004)
乳腺癌(BC)是危害女性生命健康的主要肿瘤之一,其发病率居女性恶性肿瘤首位[1]。放射治疗是乳腺癌治疗中不可或缺的一环,它与手术治疗相辅相成,可进一步提高患者治愈率。然而放疗抵抗仍是获得理想临床应用效果的主要障碍[2]。研究发现,长链非编码 RNA(LncRNA)在乳腺癌患者中的异常表达导致部分患者产生了放疗抵抗的现象,影响了乳腺癌患者的放射治疗效果[3-4]。因此,探讨LncRNA在乳腺癌中的调控功能,对于乳腺癌放射治疗有效性的提高具有至关重要的作用。本课题组前期研究发现,LncRNA RP3-340B19.3在乳腺癌患者中呈高表达,可促进乳腺癌细胞增殖、迁移等恶性生物学行为。目前关于RP3-340B19.3在乳腺癌放疗中的作用尚未明确。本课题组在前期研究的基础上以人乳腺癌细胞系MCF-7、MDA-MB-231作为研究对象,进一步探讨RP3-340B19.3对乳腺癌细胞放疗后抵抗的生物学影响,以期为改善乳腺癌放射治疗疗效提供实验依据。
1 材料与方法
1.1细胞系、主要仪器与试剂 人乳腺癌细胞系MCF-7、MDA-MB-231(中国科学院上海细胞库),高糖DMEM培养基、Opti-MEM无血清培养基、胎牛血清(FBS)购自美国Gibco公司,逆转录试剂盒和AceQ qPCR SYBR Green Master Mix试剂盒(南京诺唯赞生物科技公司),Lipofectamine 2000、Trizol试剂(美国Invitrogen公司),细胞周期试剂盒(北京兰杰柯科技公司),细胞凋亡试剂盒(美国BD公司),RP3干扰片段(苏州吉玛基因股份有限公司)。CO2细胞培养箱(日本三洋公司),QuantStudio 3定量PCR仪(美国ABI公司),CytoFLEX流式细胞仪(美国贝克曼库尔特公司),高速低温离心机(德国Eeppendorf公司)。
1.2方法
1.2.1细胞培养 取生长状态良好的乳腺癌细胞系MCF-7和MDA-MB-231接种于含10%FBS的DMEM培养基中,置于37 ℃、5%CO2细胞培养箱中常规培养。
1.2.2细胞辐照 收集生长状态良好的MCF-7细胞、MDA-MB-231细胞并进行辐照。辐照条件设置为:靶源距100 cm,辐照场大小为 10 cm×10 cm,照射的剂量率设定为3 Gy/min。
1.2.3引物设计及qRT-PCR 根据Trizol试剂说明书提取各组乳腺癌细胞总RNA,使用 NanoDrop 2000微量分光光度计检测RNA浓度与纯度,选取吸光度比值(A260 nm/A280 nm)在1.8~2.0之间的样本用于后续试验。参照HiScript Ⅲ 1st Strand cDNA Synthesis Kit说明书将1 μg 总RNA逆转录为cDNA,样本置于-20 ℃保存。使用Primer Premier 6.0软件设计引物,引物由上海生工公司合成。GAPDH(NM_001357943.2)上游引物序列(F):5′-CAGGAGGCATTGCTGATGAT-3′,下游引物序列(R):5′-GAAGGCTGGGGCTCATTT-3′,扩增片段长度为138 bp,退火温度为60 ℃。LncRNA RP3-340B19.3(XR-007076734.1)上游引物序列(F):5′-AGGTGCGTCCATGTCTGTCT-3′,下游引物序列(R):5′-TCCCTTGGGCTGGAGATTGG-3′,扩增片段长度为147 bp,退火温度为60 ℃。按照AceQ qPCR SYBR Green Master Mix试剂盒说明书以cDNA为模板进行qRT-PCR。qRT-PCR反应总体积为20 μL,包括:2×SYBR Green Master Mix 10 μL,10 μmol/L上、下游引物各0.4 μL,cDNA 2 μL,ddH2O 7.2 μL。循环参数:95 ℃预变性 10 min,95 ℃变性 10 s,60 ℃退火30 s,共40次循环。使用ABI QuantStudio 3定量PCR仪进行扩增,QuantStudio 3 Real-time PCR System软件分析扩增曲线和熔解曲线。以GAPDH为内参,采用2-ΔΔCt法计算 RP3-340B19.3 的相对表达量,公式:ΔΔCt=(ΔCt实验组-ΔCt对照组),ΔCt= Ct目的基因-Ct内参基因。
1.2.4细胞转染与辐照 取生长状态良好的MCF-7、MDA-MB-231细胞,以每孔(15~20)×104个/孔的细胞密度接种于6孔细胞培养板,待培养细胞密度达60%~70%时进行转染。首先将10 μL si-NC、si-RP3分别溶于240 μL Opti-MEM无血清培养基中,另取5 μL Lipofectamine 2000溶于245 μL Opti-MEM无血清培养基,静置5 min。将Lipofectamine 2000溶液与si-NC/si-RP3溶液混合,si-NC/si-RP3的最终浓度为250 nmol/L,静置20 min,分别转染相应孔,6 h后更换为含10% FBS的DMEM培养基继续培养。转染24 h后,对各组细胞进行放射处理,辐照剂量为6 Gy,分别记为si-NC组、si-RP3组、si-NC+6 Gy组、si-RP3+6 Gy组。继续培养24~48 h后,各组细胞用于后续试验。
1.2.5克隆形成试验 收集各组转染的MCF-7、MDA-MB-231细胞,制备细胞悬液,根据不同放射剂量,接种不同细胞数至6孔细胞培养板内(放射剂量分别为0、2、4、6、8 Gy,接种细胞数分别为1 000、2 500、5 000、6 000、8 000个/孔)。第二天待细胞贴壁后置于放射装置下予以0、2、4、6、8 Gy不同剂量放射。放射结束后继续置于37 ℃、5% CO2细胞培养箱中培养,3~5 d更换一次新鲜的含10%FBS的DMEM培养基,待出现肉眼可见的克隆时终止培养。采用4%多聚甲醛固定20 min,0.5%结晶紫染色15 min,PBS清洗,干燥后置于显微镜下,以观察单个克隆团中细胞数>50个为有效克隆数,计算克隆形成率。计算公式:克隆形成率(PE)=集落数/细胞接种数×100%;细胞存活分数(SF)=照射后细胞形成集落数/(接种细胞数×未照射细胞集落形成率)×100%。采用SigmaPlot软件拟合出细胞的存活分数曲线,设定计算函数Y=1-[1-exp(-k×X)]N进行单击多靶模型拟合分析生存曲线,计算放射增敏比(SER)。
1.2.6流式细胞术检测细胞凋亡变化 使用不含EDTA的2.5 g/L胰蛋白酶消化并收集si-NC组、si-RP3组、si-NC+6 Gy组、si-RP3+6 Gy组细胞。各组细胞处理步骤如下:预冷PBS洗涤细胞2次,用1×Binding Buffer将细胞浓度调整为1×106/mL。取100 μL细胞悬液与5 μL PE 和5 μL 7-AAD混合,室温避光温育15 min。加入400 μL 1×Binding Buffer混匀,检测。结果判读:右上象限(Annexin V+/7-AAD+)为晚凋细胞;右下象限(Annexin V+/7-AAD-)为早凋细胞。总凋亡细胞=早凋细胞+晚凋细胞。
1.2.7流式细胞术检测细胞周期 用含EDTA的2.5 g/L胰蛋白酶消化,收集si-NC组、si-RP3组、si-NC+6 Gy组、si-RP3+6 Gy组细胞,预冷的PBS洗涤细胞1~2次,1 000×g离心5 min收集细胞(细胞数约为1×105~1×106个)。细胞沉淀用300 μL预冷PBS重悬,后滴加700 μL无水乙醇,4 ℃固定过夜;第二天加入1 mL预冷PBS重悬。再次1 000×g离心5 min沉淀细胞。小心吸弃上清。轻轻弹击离心管底以适当分散细胞,避免细胞成团。每管中加入0.5 mL碘化丙啶(PI)染色液,轻轻混匀重悬细胞沉淀,37 ℃避光温育30 min。流式细胞仪在激发波长488 nm波长处检测红色荧光,通过设门排除黏连细胞与细胞碎片带来的干扰,计数10 000个细胞,结果用细胞周期拟合软件ModFitLT5分析。
2 结果
2.1辐照乳腺癌细胞后RP3-340B19.3的表达水平 经6 Gy辐照后,MCF-7细胞RP3-340B19.3的表达量显著高于0 Gy组(1.330±0.060 vs 1.030±0.074,t=5.56,P=0.005),MDA-MB-231细胞RP3-340B19.3的表达量亦高于0 Gy组(2.900±0.372 vs 1.000±0.110,t=8.48,P=0.001)。而经8 Gy辐照后,MCF-7细胞RP3-340B19.3的表达量(1.480±0.136)显著高于0 Gy组(t=5.04,P=0.007),MDA-MB-231细胞RP3-340B19.3的表达量(2.620±0.176)亦高于0 Gy组(t=13.5,P=0.000 2)。
2.2siRNA对乳腺癌细胞RP3-340B19.3敲减效率验证结果 qRT-PCR结果显示,转染si-RP3后MCF-7细胞中RP3-340B19.3的相对表达量(0.236±0.154)显著低于对照组(1.030±0.059),差异具有统计学意义(t=8.36,P=0.001)。在MDA-MD-231细胞中,转染si-RP3组RP3-340B19.3的相对表达水平(0.363±0.037)显著低于对照组(1.010±0.166),差异亦具有统计学意义(t=6.28,P=0.003)。
2.3抑制RP3-340B19.3表达对乳腺癌细胞克隆形成能力及细胞存活分数的影响 转染si-NC、si-RP3至MCF-7、MDA-MB-231细胞,以0、2、4、6、8 Gy不同剂量照射细胞后的克隆形成试验结果显示,在 MCF-7细胞中,与si-NC组比较,si-RP3组克隆形成率下降,细胞存活分数下降,细胞SER为1.240±0.119。在MDA-MB-231细胞中,与si-NC组比较,si-RP3组克隆形成率下降,细胞存活分数下降,细胞SER为1.210±0.059(图1~3,表1~2)。
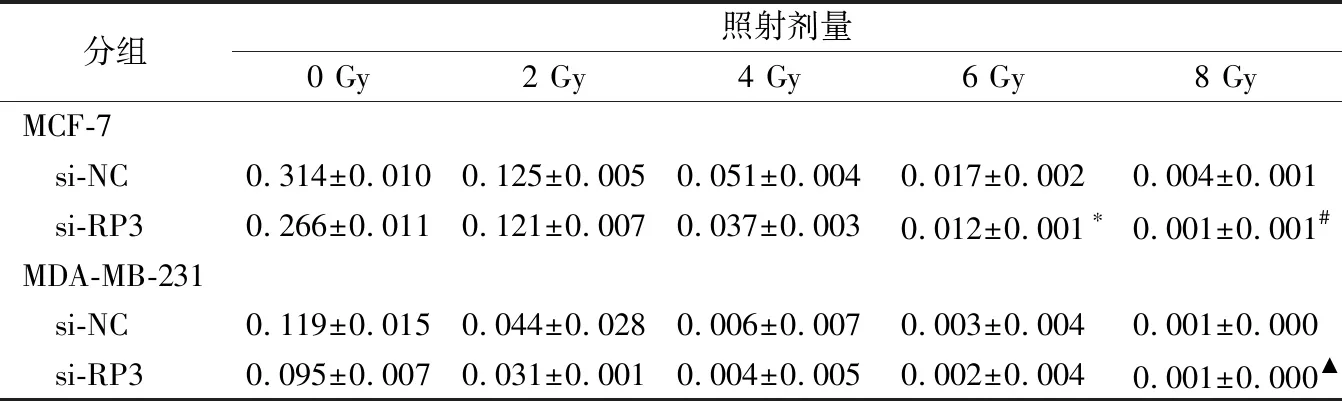
表1 不同剂量辐照后的细胞克隆形成率(PE)
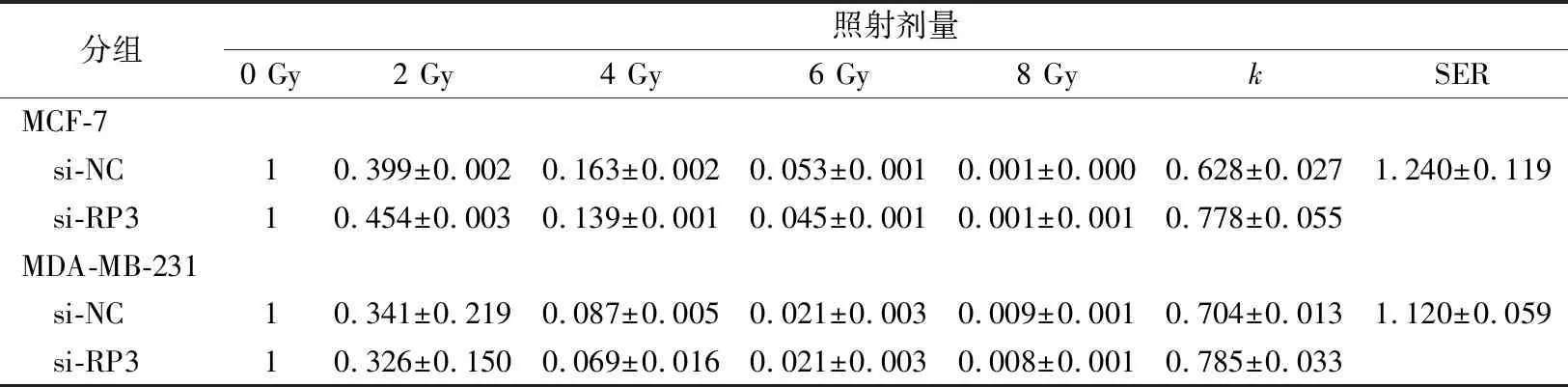
表2 不同剂量辐照后的细胞存活分数(SF)
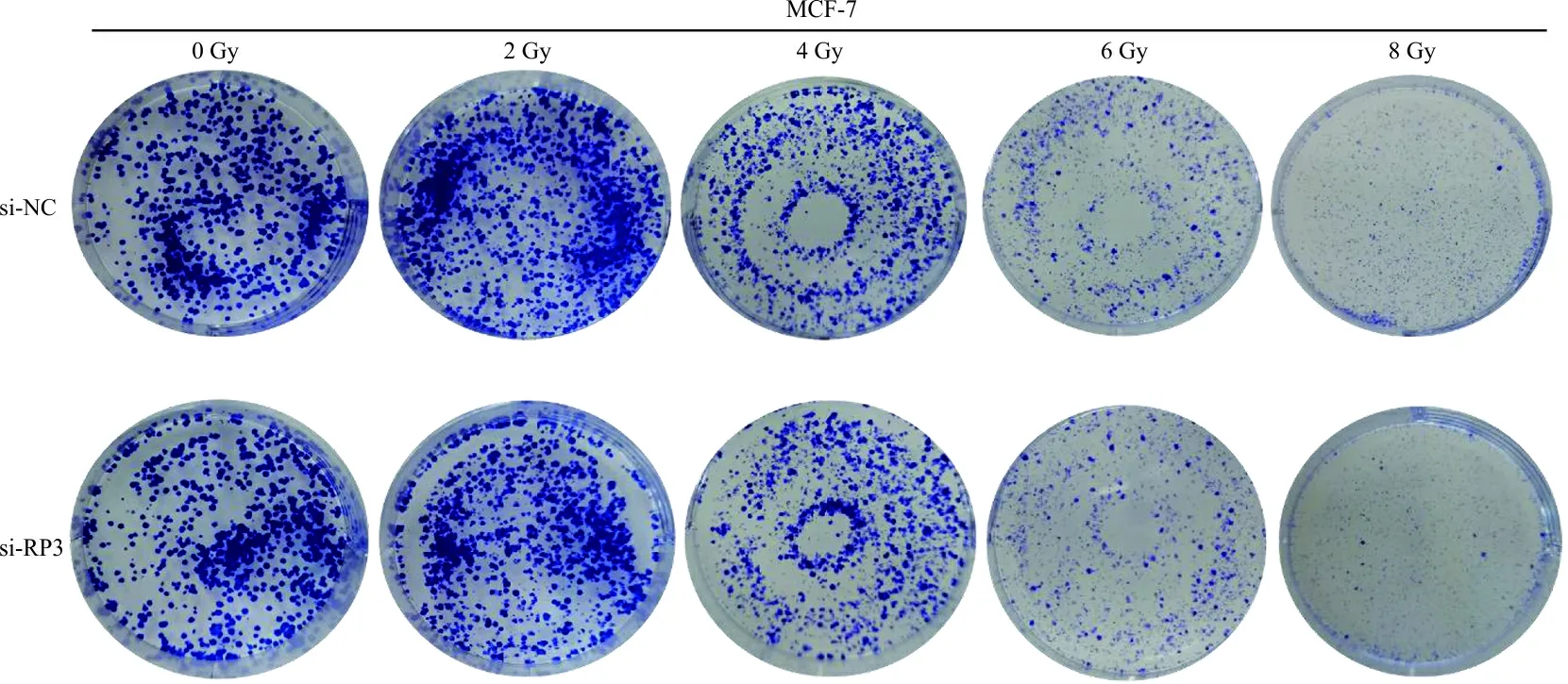
图1 辐照后MCF-7细胞克隆形成

图2 辐照后MDA-MB-231细胞克隆形成
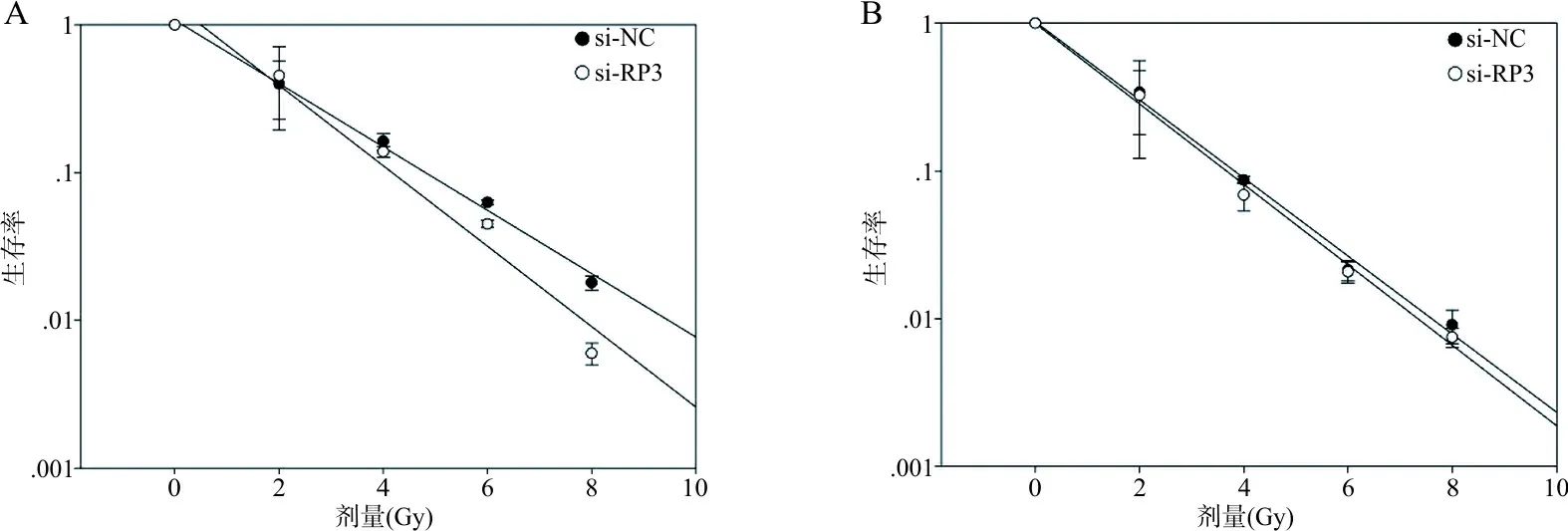
注:A,MCF-7细胞拟合存活曲线;B,MDA-MB-231细胞拟合存活曲线。
2.4抑制RP3-340B19.3表达对乳腺癌细胞凋亡的影响 转染si-NC、si-RP3至MCF-7、MDA-MB-231细胞后,通过流式细胞术分析发现,在MCF-7细胞中,与si-NC组比较,敲减RP3-340B19.3后细胞凋亡率(%)显著增加(1.97±0.19 vs 3.42±0.28,P=0.000 8);与si-NC+6 Gy组比较,si-RP3+6 Gy组凋亡率(%)显著增加(4.93±0.49 vs 7.02±0.33,P<0.000 1);si-RP3+6 Gy联合组与si-RP3组相比,凋亡率显著增加(P<0.000 1,图4A)。MDA-MB-231细胞中,与si-NC组比较,si-RP3组细胞凋亡率(%)显著增加(1.38±0.41 vs 5.57±0.52,P<0.000 1);与si-NC+6 Gy组比较,si-RP3+6 Gy组细胞凋亡率(%)显著增加(6.89±0.30 vs 8.62±0.41,P<0.001);si-RP3+6 Gy联合组与si-RP3组相比,细胞凋亡率显著增加(P<0.000 1,图4B)。
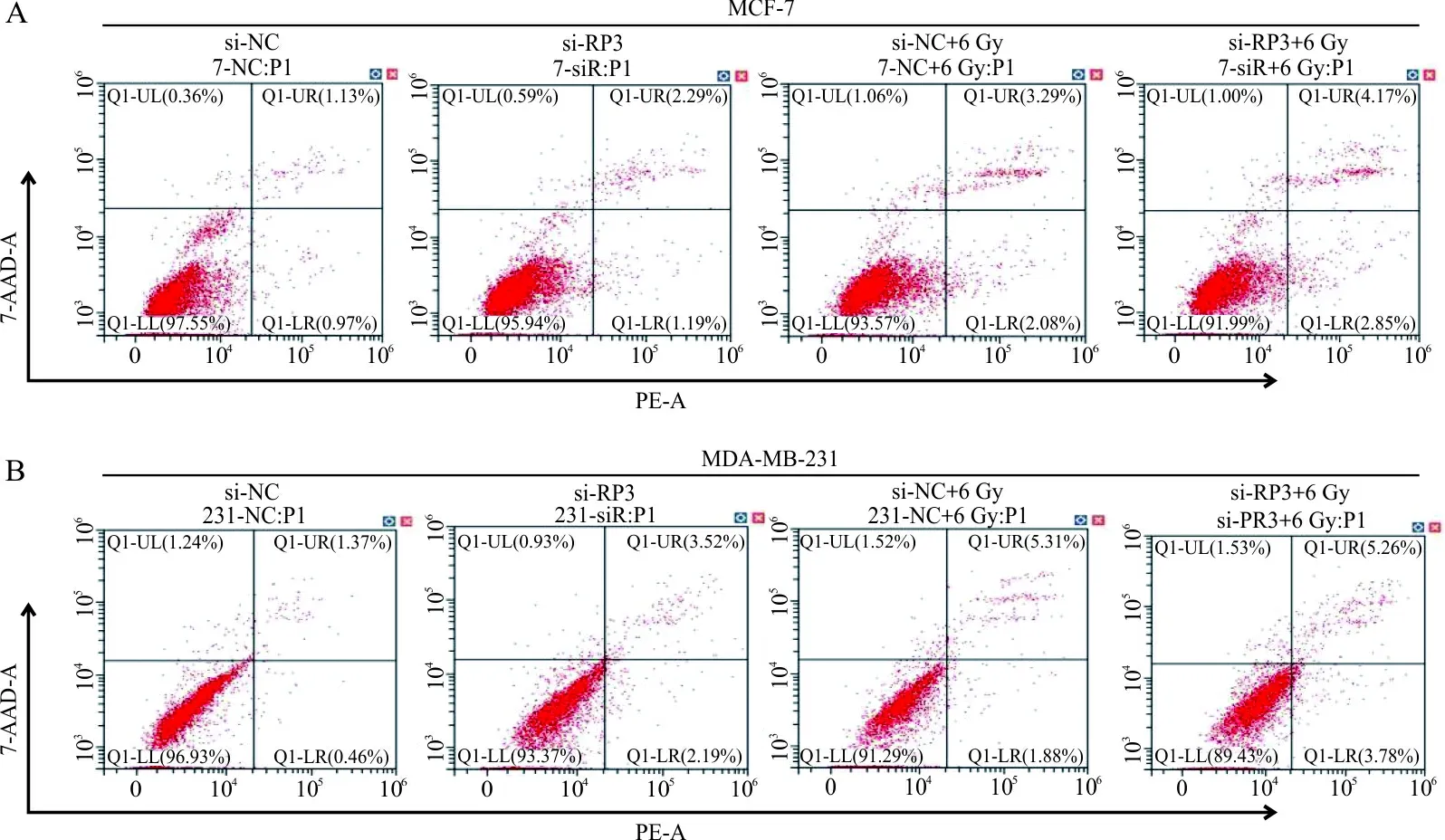
注:A,MCF-7 细胞凋亡率;B,MDA-MB-231细胞凋亡率
2.5抑制RP3-340B19.3表达对乳腺癌细胞周期的影响 流式细胞仪检测结果表明,使用si-RP3转染MCF-7细胞后,si-RP3组S期细胞百分比(%)显著低于si-NC组(9.57±0.65 vs 13.30±0.72,P=0.000 4);si-RP3+6 Gy组S期细胞百分比(%)显著低于si-NC+6 Gy组(3.34±1.10 vs 7.80±0.63,P<0.001)。si-RP3+6 Gy联合组与si-RP3组相比,S期细胞比例显著降低(P<0.000 1)。在MDA-MB-231细胞中,si-RP3组S期细胞百分比(%)显著低于si-NC组(15.50±0.71 vs 20.60±0.66,P=0.000 3);si-RP3+6 Gy组S期细胞百分比(%)显著低于si-NC+6 Gy组(8.56±1.15 vs 12.60±0.83,P<0.000 1)。而si-RP3+6 Gy联合组与si-RP3组相比,S期细胞比例显著降低(P<0.000 1)。
3 讨论
研究表明,LncRNA与乳腺癌的发生发展、临床治疗和预后密切相关,一些异常表达的LncRNA可促进肿瘤细胞的增殖、转移并产生治疗抵抗性[5-6]。例如,LINC00504对乳腺癌细胞的生长起到了促进作用,并增加乳腺癌放疗抵抗性[7]。有学者发现LncRNA TUG1对乳腺癌细胞增殖和转移起到促进作用,敲减TUG1后可以提高乳腺癌细胞的放射敏感性[8]。以上结果均表明,LncRNA是参与乳腺癌恶性进展及调控乳腺癌放射治疗的重要一环。目前关于LncRNA RP3-340B19.3的研究甚少,至今还未证实该分子在乳腺癌放疗过程中的作用机制。在前期研究基础上,笔者发现RP3-340B19.3在乳腺癌中呈高表达。为了探究RP3-340B19.3是否可以调控乳腺癌放疗过程中的细胞生物学功能变化,本研究首先通过不同剂量的射线对MCF-7、MDA-MB-231细胞进行辐照,结果发现辐照后乳腺癌细胞中RP3-340B19.3的表达水平显著升高。由此推测,放疗后高表达的RP3-340B19.3可对乳腺癌细胞产生放疗抵抗。结合细胞培养24 h后的细胞形态,由于8 Gy照射的细胞状态不佳,故选用6 Gy作为后续实验剂量。
为了进一步探究RP3-340B19.3对乳腺癌细胞放疗过程中生物学特性的影响。首先笔者通过克隆形成试验发现敲减RP3-340B19.3表达后,乳腺癌细胞克隆形成率降低。进一步使用SigmaPlot软件进行单击多靶模型拟合分析生存曲线,结果发现敲减RP3-340B19.3可提高细胞放射敏感性。当肿瘤细胞接受放疗时,一些异常表达的分子可通过激活信号通路和靶向基因来诱导细胞进程的改变,如上皮-间充质转化(EMT)、凋亡、自噬、细胞周期、代谢等,从而调控放射治疗反应[9]。细胞周期失调与凋亡是放疗抵抗的重要因素。笔者通过流式细胞术检测发现敲减RP3-340B19.3可提高乳腺癌细胞凋亡率,并降低细胞S期比例。上述结果证实RP3-340B19.3通过调控细胞周期和凋亡促使乳腺癌放疗抵抗。但本研究尚未证实RP3-340B19.3通过何种蛋白质影响乳腺癌细胞周期与凋亡进程,以及是否可参与某种信号通路以诱导乳腺癌的凋亡。后续研究将进一步明确RP3-340B19.3参与细胞周期与凋亡调控的具体机制。
综上所述,本研究通过构建低表达RP3-340B19.3的乳腺癌细胞进行一系列生物学特性检测,发现RP3-340B19.3参与了乳腺癌细胞恶性生物学行为,辐照后高表达的RP3-340B19.3对乳腺癌细胞产生放疗抵抗性,敲减RP3-340B19.3可以促进乳腺癌细胞的凋亡,抑制乳腺癌细胞的增殖,增强放射敏感性。

