不同保存条件对血清样本细胞因子测定的影响
毛镭篥,张丽,李薇,黄媛,王斐,吴卫(中国医学科学院北京协和医院检验科,北京100730)
细胞因子(cytokine)是由免疫细胞(如单核细胞、T细胞、B细胞、NK细胞等)或某些非免疫细胞(内皮细胞、表皮细胞、纤维母细胞等)经刺激而合成、分泌的一类具有广泛生物学活性的小分子蛋白质,能结合相应受体,调节细胞生长、分化,参与机体免疫应答和炎症反应[1]。细胞因子分为白细胞介素、干扰素、肿瘤坏死因子超家族、集落刺激因子、趋化因子、生长因子等六大家族。大量研究表明细胞因子与多种疾病的发生、发展密切相关,已在国内被纳入众多指南与共识中,如《感染相关生物标志物临床意义解读专家共识》、《中国急性胰腺炎诊治指南》、《中国急诊感染性休克临床实践指南》、《中国脓毒症早期预防与阻断急诊专家共识》、《淋巴瘤相关噬血细胞综合征诊治中国专家共识》[2-6]。标本的采集方法、抗凝剂的选择、贮存条件以及其他分析前处理均会影响细胞因子的准确测定[7],目前,尚无关于细胞因子检测的标准化指南或共识。本研究主要观察不同保存温度及时间下血清标本中细胞因子,如白介素6(IL-6)、白介素8(IL-8)、白介素10(IL-10)、肿瘤坏死因子α(TNF-α)的稳定性,旨在探讨血清样本细胞因子准确测量的可靠条件。
1 资料与方法
1.1标本来源 随机选取北京协和医院2022年3月至10月就诊的120例患者作为研究对象,其中男性58 例,女性62例,年龄22~88岁,平均年龄56岁。纳入标准:(1)标本自采集至即刻上机测定,时长在1 h以内;(2)有低、中、高不同浓度范围的标本。排除标准:乳糜血及溶血标本。
1.2仪器与试剂 IMMULITE1000全自动化学发光免疫分析仪及配套IL-6、IL-8、IL-10、TNF-α检测试剂、定标液和质控品(德国SIEMENS公司);3.5 mL规格含分离胶血清管(VACUTTE公司);1.5 mL规格EP管(XYGEN公司)。
1.3方法 120例研究对象静脉血标本在1 500×g下离心10 min。离心后根据保存条件分为5组,包括:(1)室温原管组40例,标本在室温原管条件下保存,不分装;(2)室温分装组20例,将血清分装至EP管,在室温条件下保存;(3)4 ℃原管组20例,样本置于4 ℃条件下保存,不分装; (4)4 ℃分装组20例,将血清分装至EP管,在4 ℃条件下保存;(5)-20 ℃组20例,将血清分装至EP管,在-20 ℃条件下保存。第(1)组中的20例标本和(2)(3)(4)组分别测定即刻、6 h、24 h的IL-6、IL-8、IL-10、TNF-α结果;第(1)组中的另外20例标本用于分析IL-8的稳定性,分别测定即刻、2 h、3 h、4 h、5 h的IL-8结果;第(5)组-20 ℃组测定即刻及-20 ℃冷冻6月后的IL-6、IL-8、IL-10、TNF-α结果。即刻是指样本自采集、接收、离心至上机,整个时长控制在1 h左右,也是稳定性研究的起始点。
1.4统计学分析 采用SPSS 17.0统计软件进行。 IL-6、IL-8、IL-10、TNF-α的检测结果呈非正态分布,用M(P25,P75)描述,组间比较采用非参数秩和检验,以P<0.05为差异有统计学意义,用GraphPad Prism 5.0软件作图。根据SIEMENS厂家说明书, IL-6、IL-8、IL-10、TNF-α参考区间上限分别为5.9 pg/mL、62 pg/mL、9.1 pg/mL、8.1 pg/mL,检测范围分别为2.0~1 000 pg/mL、2.0~7 500 pg/mL、1.0~1 000 pg/mL、1.7~1 000 pg/mL。稳定性比对判断标准:(1)厂家推荐的检测结果相对偏差在±15%以内。(2)根据CNAS-CL02《医学实验室质量和能力认可准则在临床化学检验领域的应用说明》,应有≥80%的结果符合要求。总之,每组结果的相对偏差±15%的标本数需≥16个,且差异无统计学意义,表示比对通过。
2 结果
2.1室温原管组IL-6、IL-8、IL-10、TNF-α结果 室温原管组中IL-6、IL-10、TNF-α在6 h结果与即刻相比,差异均无统计学意义(P>0.05),比对通过率分别为80%、95%、80%,均≥80%; 24 h结果与即刻相比,差异均无统计学意义(P>0.05),比对通过率分别为70%、85%、80%,IL-6在24 h的稳定性比对不通过。IL-8在6 h、24 h的检测结果与即刻相比,差异均有统计学意义(P<0.05), 6 h和24 h比对通过率仅为5%、0,结果见表1。
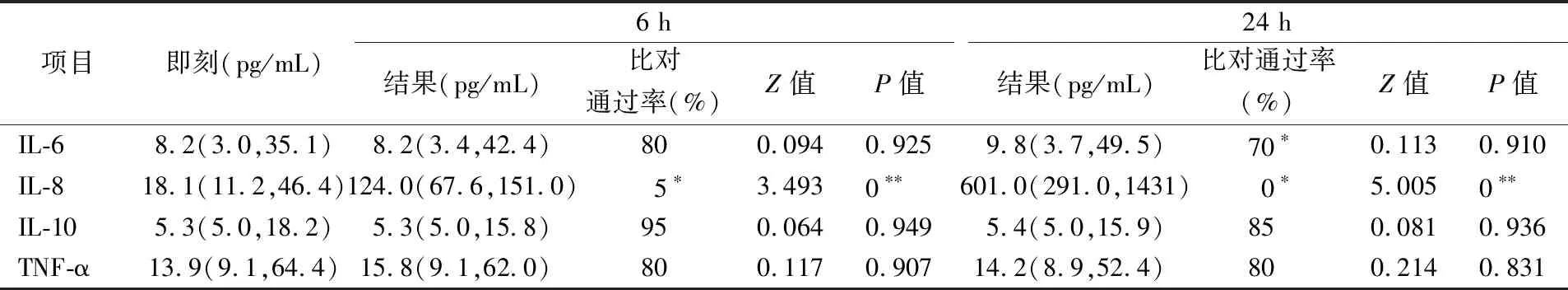
表1 室温原管组中细胞因子在各时间点结果的比较
在即刻结果中,IL-8有5例阳性样本,阳性率为25%; 6 h有17例阳性标本,阳性率为85%,假阳性率为60%,升高倍数最高可达28.8倍;24 h有19例阳性样本,阳性率为95%,假阳性率为70%,升高的倍数最高可达496.8倍。随放置时间延长,IL-8明显升高,假阳性率也不断增加,结果见表2和图1。将IL-8在6 h、24 h升高的倍数与单核细胞数进行Spearman相关性分析,结果r分别为0.313、0.365,差异均无统计学意义(P>0.05)。而IL-6、IL-10、TNF-α在6 h、24 h的阳性率与即刻结果一致,阳性率并未增加。
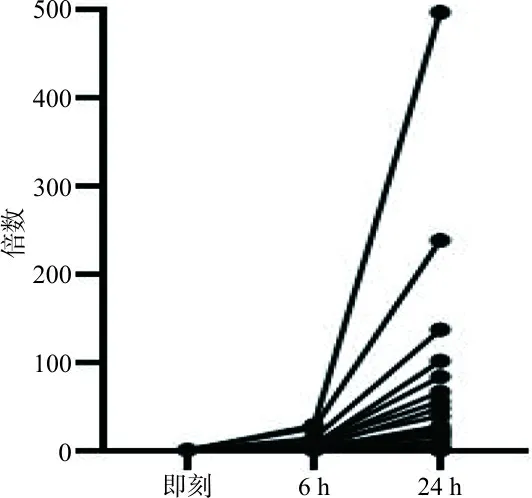
图1 IL-8在6 h和24 h检测值与即刻相比变化的倍数
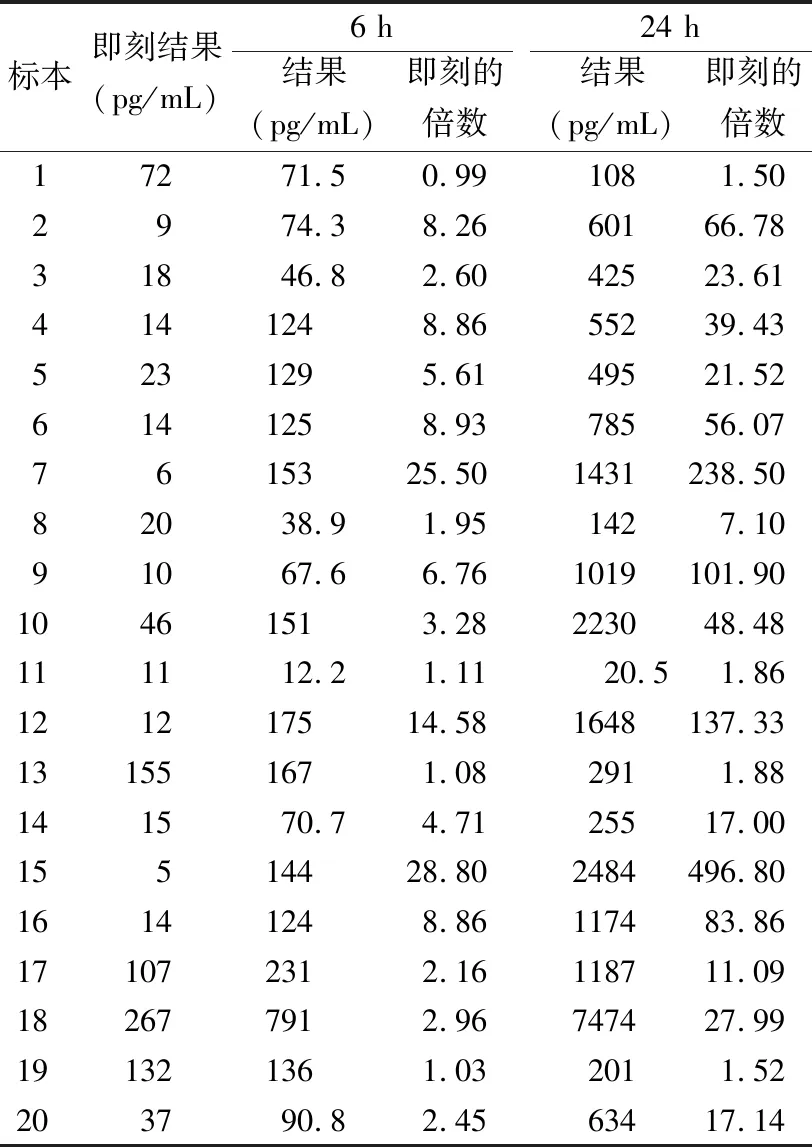
表2 室温原管组中IL-8在各时间点结果的比较
2.2室温原管中 IL-8稳定性分析 20例血清样本在室温放置2 h、3 h、4 h、5 h后,其IL-8结果与即刻相比,P值分别为0.820、0.461、0.076、0.003,仅放置5 h的结果与即刻相比,差异有统计学意义(P<0.05),其余各组差异均无统计学意义(P>0.05)。比对通过率分别为80%、35%、15%、10%;仅2 h的比对通过。室温原管组中IL-8在即刻、2 h、3 h、4 h、5 h的结果,其阳性率分别为15%、20%、25%、35%、45%,随放置时间延长,其阳性率也在不断增加,结果见表3。
2.3室温分装组结果 室温分装组中,IL-6、IL-8、IL-10、TNF-α在6 h的检测结果与即刻相比,比对通过率分别为95%、65%、100%、90%,差异无统计学意义(P>0.05);24 h的检测结果与即刻相比,比对通过率分别为90%、50%、95%、95%,差异无统计学意义(P>0.05)。IL-8在6 h、24 h的比对通过率均<80%,比对不通过,结果见表4。
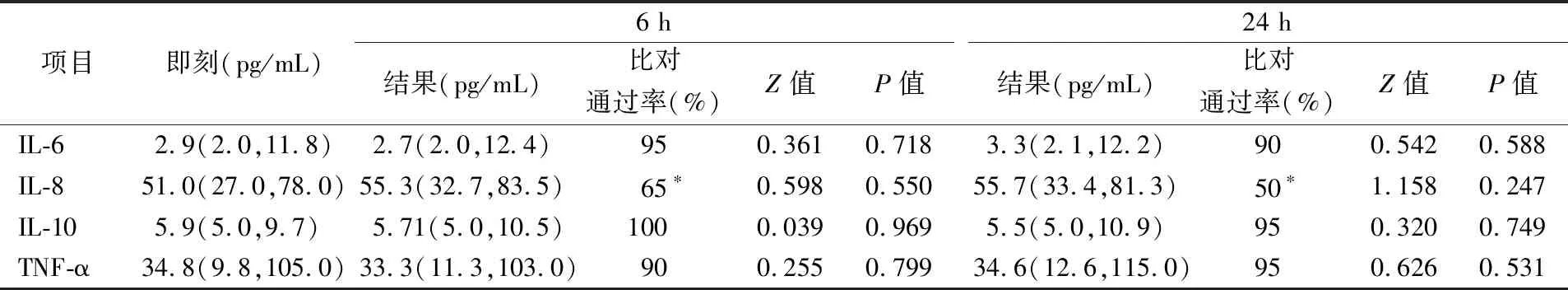
表4 室温分装组中细胞因子在各时间点结果的比较(pg/mL)
2.44 ℃原管组结果 4 ℃原管组中,IL-6、IL-8、IL-10、TNF-α在6 h的检测结果与即刻相比,比对通过率分别为85%、90%、90%、90%,差异无统计学意义(P>0.05)。24 h的检测结果与即刻相比,比对通过率分别为80%、55%、90%、95%,差异无统计学意义(P>0.05)。IL-8放置24 h后比对不通过,其余各组比对通过率均≥80%。结果见表5。
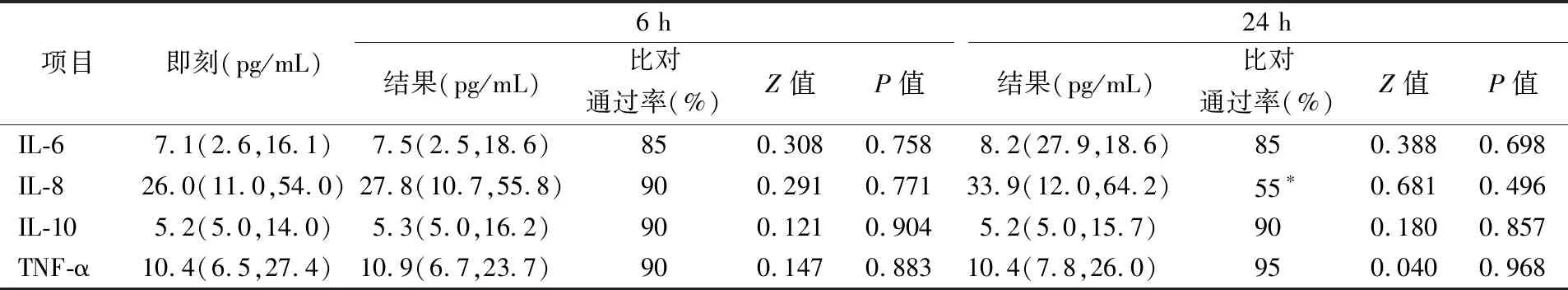
表5 4 ℃原管组中细胞因子在各时间点结果的比较(pg/mL)
2.54 ℃分装组结果 4 ℃组中, IL-6、IL-8、IL-10、TNF-α在6 h的检测结果与即刻相比,比对通过率分别为90%、100%、95%、95%,差异无统计学意义(P>0.05)。24 h结果与即刻相比,比对通过率分别为85%、95%、100%、85%,差异无统计学意义(P>0.05)。各结果比对通过率均≥80%,见表6。
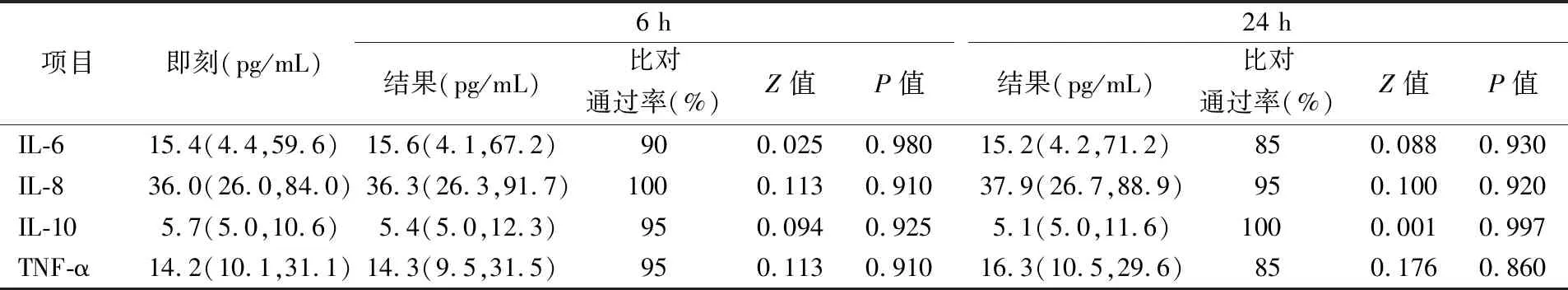
表6 4 ℃分装组中细胞因子在各时间点结果的比较
2.6-20 ℃分装组结果 -20 ℃分装组中, IL-6、IL-8、IL-10、TNF-α放置6个月后其结果与即刻相比,P>0.05,差异无统计学意义,比对通过率均≥80%。结果见表7。
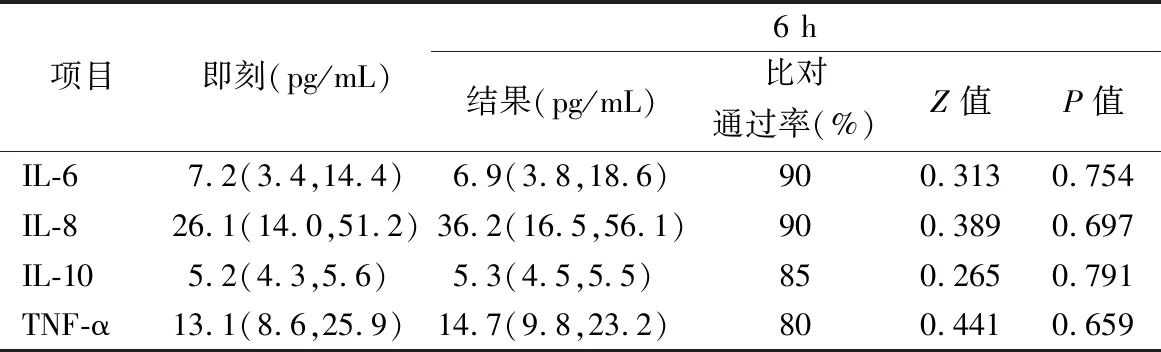
表7 -20 ℃分装组中细胞因子在各时间点结果的比较
3 讨论
细胞因子是免疫系统最活跃的分子标志,可以帮助临床预测脓毒症[8]、辅助诊断噬血细胞综合征[9]、鉴别革兰氏阴阳性细菌感染谱[10]以及早期诊断原发性中枢神经系统性淋巴瘤[11-12]等疾病。另外细胞因子可作为新冠肺炎的风向标,特别是IL-6是引发新冠肺炎细胞因子风暴的关键因子,是引起急性呼吸窘迫综合和多脏器衰竭的重要原因[13]。早在《新型冠状病毒肺炎诊疗方案(试行第六版)》提到:“重型、危重症患者常有炎症因子升高”,建议有条件的进行细胞因子的检测[14]。延续至最新的《新型冠状病毒感染诊疗方案(第十版)》中建议对于重型、危重型且实验室检测IL-6水平升高者可使用IL-6抑制剂[15]。
细胞因子检测的标本类型多样,包括血清、血浆、脑脊液、尿液、肺泡灌洗液、胸腹水、腹透液等,如何对不同类型的标本进行规范标准化的前处理,以保证检测结果的稳定性和准确性,非常值得摸索及探讨[7]。鉴于尚未出现标准化的分析规程,本实验分析了不同温度不同保存时间对血清管IL-6、IL-8、IL-10、TNF-α测定结果的影响。
IL-8作为促炎因子,由巨噬细胞、内皮细胞、上皮细胞分泌,可吸引中性粒细胞,而中性粒细胞弹性蛋白酶的释放又能诱导气道上皮细胞IL-8基因的表达,形成恶性循环,在慢性阻塞性肺炎及哮喘中有重要的临床意义[16]。在本实验中,IL-8在原管室温条件下放置时,其假阳性率会随时间的延长而增加,放置6 h和24 h时,假阳性率分别为45%、55%,与既往文献相似[7],可能因为采用血清管时,血液凝固过程中的凝血酶诱导了Rho/JNK级联(Rho是凝血酶信号通路的关键中介,JNK的激活依赖于Rho的刺激),这种级联可导致IL-8的转录和激活,刺激单核细胞表达IL-8[17],亦有研究表明,单核细胞要产生和释放更高水平的IL-8,需要血小板的增强作用[18],因此单核细胞的数量并非是导致IL-8升高的唯一因素。本实验中IL-8随时间延长而升高的倍数虽然与单核细胞的数量无关,但在肺泡灌洗液中IL-8的升高与肺泡中的单核-巨噬细胞的数量有关,可能与单核细胞不同成熟阶段有关[7]。需要注意的是,虽然使用了含分离胶的血清管,但显然并不能阻止单核细胞持续分泌IL-8至血清中。在IL-8的稳定性分析实验中,虽然室温放置2 h、3 h、4 h的结果与即刻相比差异无统计学意义,但3 h和4 h的稳定性比对通过率<80%,不能满足实验室质量要求,而2 h的比对通过率为80%,结合实验室实际日常工作,IL-8室温放置2 h是可接受的,这点在厂家说明书中也有体现。IL-6、IL-10、TNF-α在本实验中的分析结果较稳定,因此若联合检测多项细胞因子时,由于IL-8的不稳定性,室温条件下建议2 h内上机测定。关于24 h内的稳定性,只有4 ℃分装组的所有CK结果的比对通过率均≥80%,故建议2~24 h可采取4 ℃分装保存。在-20 ℃分装时,CK保存6个月复融检测时,结果依旧稳定,本实验IL-8在-20 ℃分装冻存后,中位数结果从26.1 pg/mL升高为36.2 pg/mL,可能与在室温复融时间过长有关。因此建议复融后及时检测。有文献报道[19], IL-6、IL-10、TNF-α在-20 ℃反复冻融结果稳定,但IL-8在-20 ℃有限次冻融稳定,建议避免多次冻融。本实验虽未分析延迟离心对细胞因子的影响,但研究证实血清样本在室温放置24 h后再离心检测,IL-6及IL-8明显增高,因此有必要减少离心前时间[20]。
采用血清样本联合检测多项细胞因子IL-6、IL-8、IL-10、TNF-α时,标本自采集至上机,时间控制在2 h内,可采取室温原管放置;2~24 h内推荐4 ℃分装;-20 ℃时6个月内细胞因子结果稳定可靠。日常工作中,采用血清样本测定细胞因子时,如果不能满足2 h内及时上机,为避免IL-8的假阳性,建议分装冻存。各实验室可根据实际情况选择不同保存方式。

