氮负荷增强对闽江河口芦苇残体分解及其养分释放的影响
贺攀霏,孙志高,3,*,师自香,胡星云,宋振阳,李亚瑾,陈冰冰,厉彦哲
1 福建师范大学福建省亚热带资源与环境重点实验室,福州 350007 2 福建师范大学湿润亚热带生态地理过程教育部重点实验室,福州 350007 3 福建师范大学地理研究所,福州 350007
河口湿地是河流与海洋相互作用形成的特殊湿地类型,具有多种重要生态功能。残体分解是河口湿地生态系统物质循环和能量流动的重要环节之一,它连接着生物有机体的合成与分解。残体分解过程中向土壤归还的氮磷等养分是生态系统“自我施肥”的重要过程,可显著影响河口湿地的初级生产力[1]。因此,探讨残体分解过程中养分的变化规律是进一步明晰河口湿地生态过程的重要基础。目前,国外关于河口湿地残体分解的研究开展较早,且已围绕残体分解特征、养分动态以及生物因素(基质质量、无脊椎动物、真菌和微生物等)[2—5]与非生物因素(温度变化[6]、水分条件[7]、沉积强度[8]、酸碱状况和养分水平[9]等)对其分解影响等方面开展了许多研究。与之相比,国内在该方面也开展了较多工作,其研究区域主要涉及辽河口、胶州湾洋河河口、黄河口、长江口和闽江河口[1,10—13],而研究内容主要侧重于残体分解速率、元素动态(碳、氮、磷、硫和痕量元素)[14—18]及其非生物影响因素(温度、水分和沉积)[1,19],而关于养分条件改变对河口湿地残体分解及养分释放的研究还不多见。
闽江河口湿地是闽江和东海相互作用形成的典型感潮湿地,其对于维护区域生态安全发挥着重要作用。近年来,高强度的人类活动已导致闽江河口湿地处于高氮沉降和高氮养分负荷状态。其中,该区氮沉降量已达3.0—3.5 g N m-2a-1[20],超过其临界负荷量(2.0—2.5 g N m-2a-1)[21];河口营养盐入海通量高达3.8—6.1×104t[22],湿地氮养分负荷接近21 g N m-2a-1[23]。芦苇(Phragmitesaustralis)作为闽江河口分布最为广泛的原生植被之一,抗逆性较强,是响应氮磷养分较为敏感的典型湿地植被,其对于修复河口湿地受污染的水体和土壤具有重要的生态作用[24]。当前,关于闽江口湿地残体分解的研究主要集中在水盐梯度[19]、沉积强度[1]和底栖生物扰动[25]等对短叶茳芏(Cyperusmalaccensis)、互花米草(Spartinaalterniflora)等残体分解的影响以及残体在分解过程中生源元素动态变化和重金属释放风险两方面,而关于氮养分改变条件下,芦苇残体分解及其养分释放的研究还不多见。为此,本研究以闽江河口本土优势种芦苇为研究对象,基于野外原位氮负荷增强模拟实验,探讨了氮负荷增强对其残体分解及其养分释放的影响。研究结果有助于揭示湿地养分循环过程对氮负荷增强的响应机制,并可为该区湿地生态保育提供科学依据。
1 研究区概况与研究方法
1.1 研究区概况
闽江河口地处中亚热带和南亚热带过渡地区,气候温热潮湿,雨热同期,年平均气温为19.6℃,年降水量为1380 mm。鳝鱼滩位于闽江河口南部,是最大的一块天然湿地(图1)。研究区位于鳝鱼滩西北部,该区属正规半日潮,水文过程较为复杂。该区土壤类型主要为滨海盐土,主要优势植物有芦苇(P.australis)、短叶茳芏(C.malaccensis)和互花米草(S.alterniflora)。
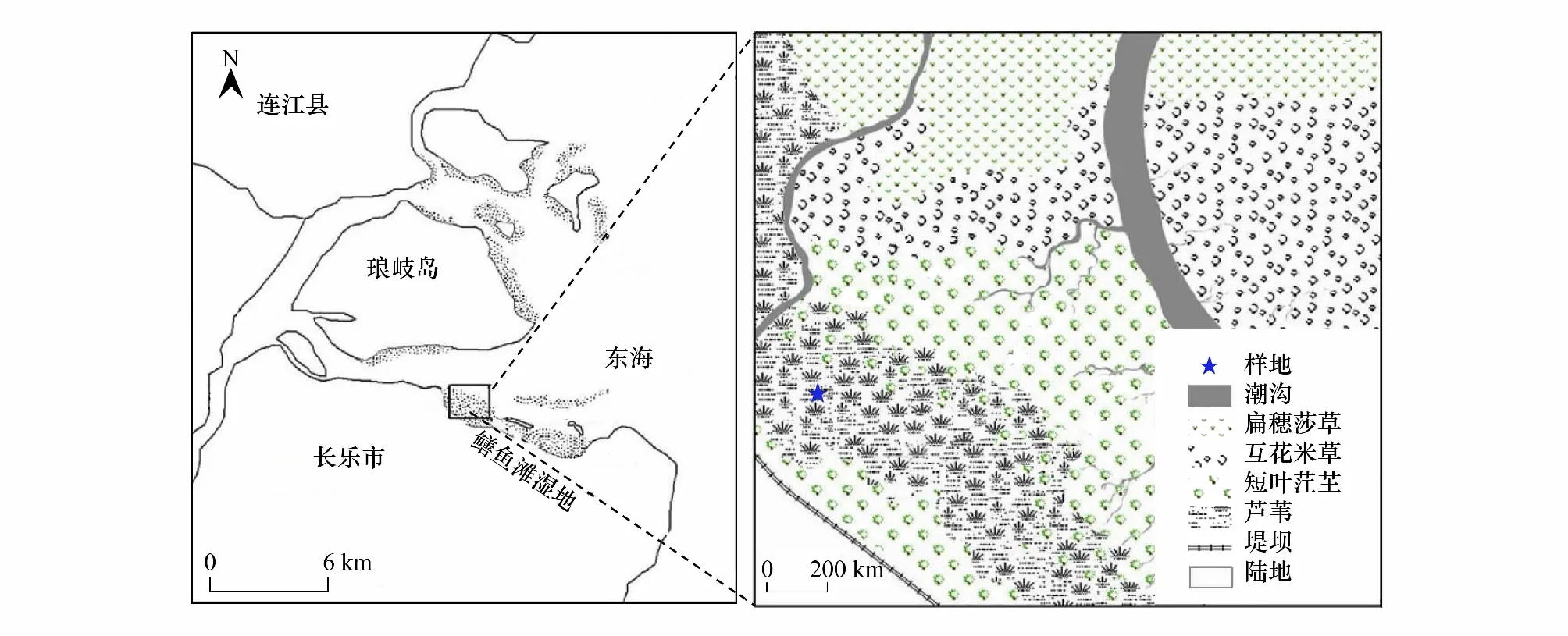
图1 研究区域及研究样地示意图Fig.1 Sketch of the study region and experimental plot
1.2 研究方法
1.2.1试验设计与布设
选择鳝鱼滩西北部位于潮上带的芦苇群落为研究对象,于2021年1月采集芦苇样本带回实验室,用去离子水冲洗烘干后,剪成20 cm小段,装入分解袋中(孔径为0.2 mm,规格为20 cm×25 cm),每袋20 g(干重)。结合该区资料,考虑陆源氮输入(21.0 g N m-2a-1)和氮沉降(3.0—3.5 g N m-2a-1)的综合影响,将湿地背景氮负荷量设定为25.0 g N m-2a-1,并据此设计分解试验的4个氮负荷水平,即:NL0(无氮负荷处理,当前湿地背景氮负荷量,实际输氮0 g N m-2a-1)、NL1(低氮负荷处理,模拟较低的氮负荷水平,实际输氮12.5 g N m-2a-1)、NL2(中氮负荷处理,模拟较高的氮负荷水平,实际输氮25.0 g N m-2a-1)和NL3(高氮负荷处理,模拟很高的氮负荷水平,实际输氮75.0 g N m-2a-1)。在每个氮负荷处理下随机设置3个重复样地(1.5 m×2 m),每个样地均使用聚氯乙烯(PVC)板进行围隔,且样地之间设置大于5 m的缓冲带,以避免不同样地之间互相干扰。不同试验样地环境因子间的差异均不显著(表1),说明分解样地的环境条件较为一致。2021年3月,在上述样地内分别投放20个分解袋。为防止试验期间分解袋被潮水冲走,在每个样地内固定若干根长为2 m的竹竿(1.5 m埋入土壤中),并用尼龙绳将分解袋固定在竹竿上。
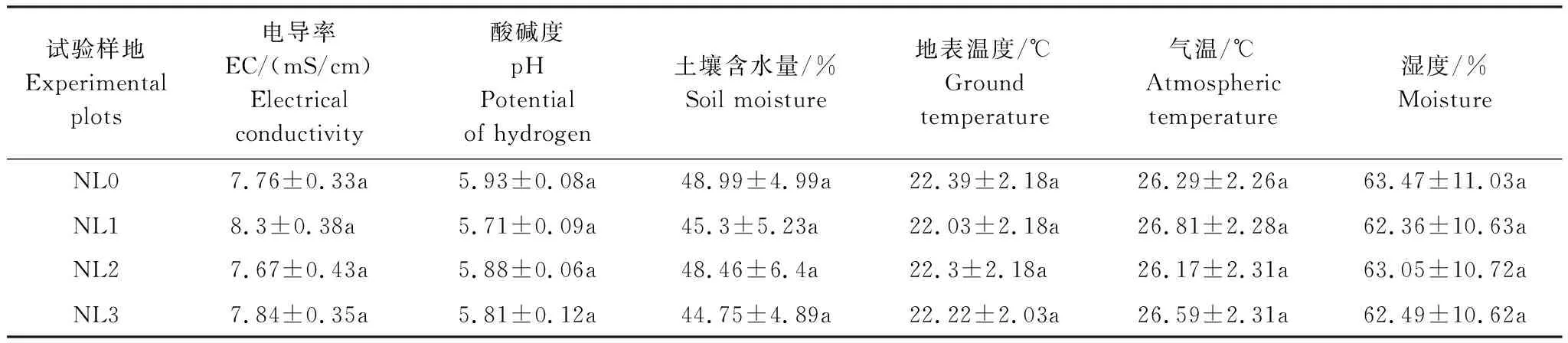
表1 不同试验样地的环境因子Table 1 Environmental variables in different experimental plots
1.2.2样品采集与处理
在上述各氮负荷处理样地内,分别于分解的第15 d、30 d、60 d、90 d、150 d、180 d和240 d采集分解袋,每次3—4个重复。将取回的分解袋及时带回实验室,去掉泥土并拣出袋内杂物,用去离子水将样品清洗干净后烘干至恒重,称量后,将样品磨碎,过100目筛后装袋待测。采用元素分析仪(ElementarVario MAX,德国)测定样品的全碳(TC)和全氮(TN)含量;样品经HClO4-H2SO4消解后,采用连续流动分析仪(SKALAR-SAN++,荷兰)测定全磷(TP)含量。另外,采用便携式电导仪(2265FS,美国)测定土壤电导率(EC)和土壤温度;采用电位法(水土比5∶1)(Starter 300,美国)测定土壤pH;采用烘干法测定分解环境中的表层土壤含水量。
1.2.3相关指标计算
残体残留率(R,%)、分解速率(d-1)和残体完成95%分解所需时间(t0.95)可采用下式计算[1,14]:
(1)
ln(Wt/W0)=-kt
(2)
式中,W0(g)为残体干物质初始质量;Wt(g)为残体在t时刻的干物质质量;k为分解速率;t(d)为分解时间。
t0.95=-ln(0.05)/k
(3)
残体分解过程中的不同元素(碳(C)、氮(N)、磷(P))的累积或释放可采用累积系数(AI)来表征[1]:
(4)
式中,Wt和W0同上;Xt(mg/g)为残体在t时刻的元素含量;X0(mg/g)为残体中元素的初始含量。CAI为碳累积指数;NAI为氮累积指数;PAI为磷累积指数。若AI<100%,说明发生了元素净释放;若AI>100%,说明发生了元素净累积。
1.2.4数据分析与统计
运用Origin 2022软件对数据进行作图和计算;采用SPSS 26.0软件对数据进行Pearson相关分析、单因素方差分析和逐步线性回归分析,显著性水平设定为P=0.05。
2 结果与分析
2.1 氮负荷增强对残体分解速率的影响
不同氮负荷处理下芦苇残体的残留率在分解期间均呈波动降低趋势,且其值在第90 d和180 d存在显著差异(P<0.05)(图2)。分解240 d后,NL0、NL1、NL2和NL3处理下的残留率分别为54.30%、53.98%、47.16%和51.28%。与NL0处理相比,NL1和NL2处理下的残体分解速率分别增加了2.33%和10.51%,而NL3处理下的分解速率降低了2.72%(表2)。另外,不同氮负荷处理下的95%分解所需时间(t0.95)整体表现为NL3(3.28 a)>NL0(3.19 a)>NL1(3.12 a)>NL2(2.89 a)。低氮和中氮负荷处理总体促进了残体分解,而高氮负荷处理则抑制了残体分解。
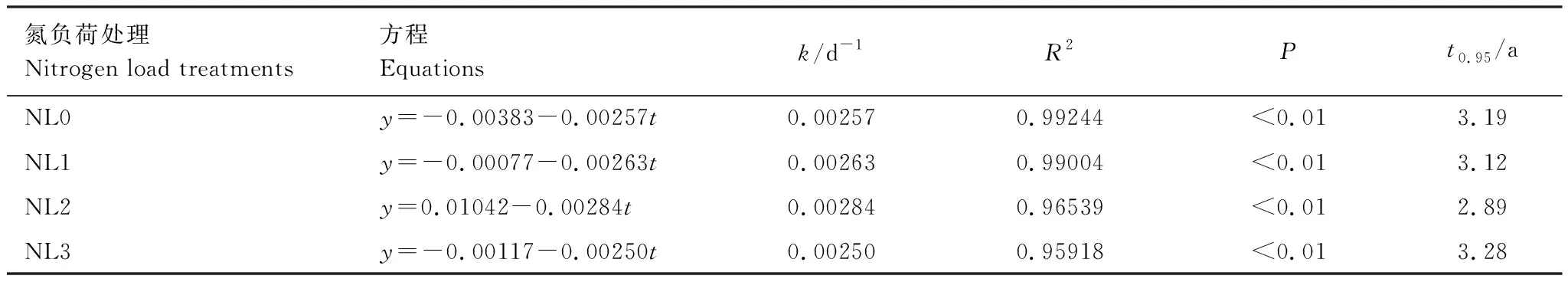
表2 不同氮负荷处理下残体残留率的自然对数(y)与分解时间(t)的回归方程和参数Table 2 Linear equations and parameters between the natural logarithm (y) of mass remaining and decomposition days (t) in different nitrogen load treatments
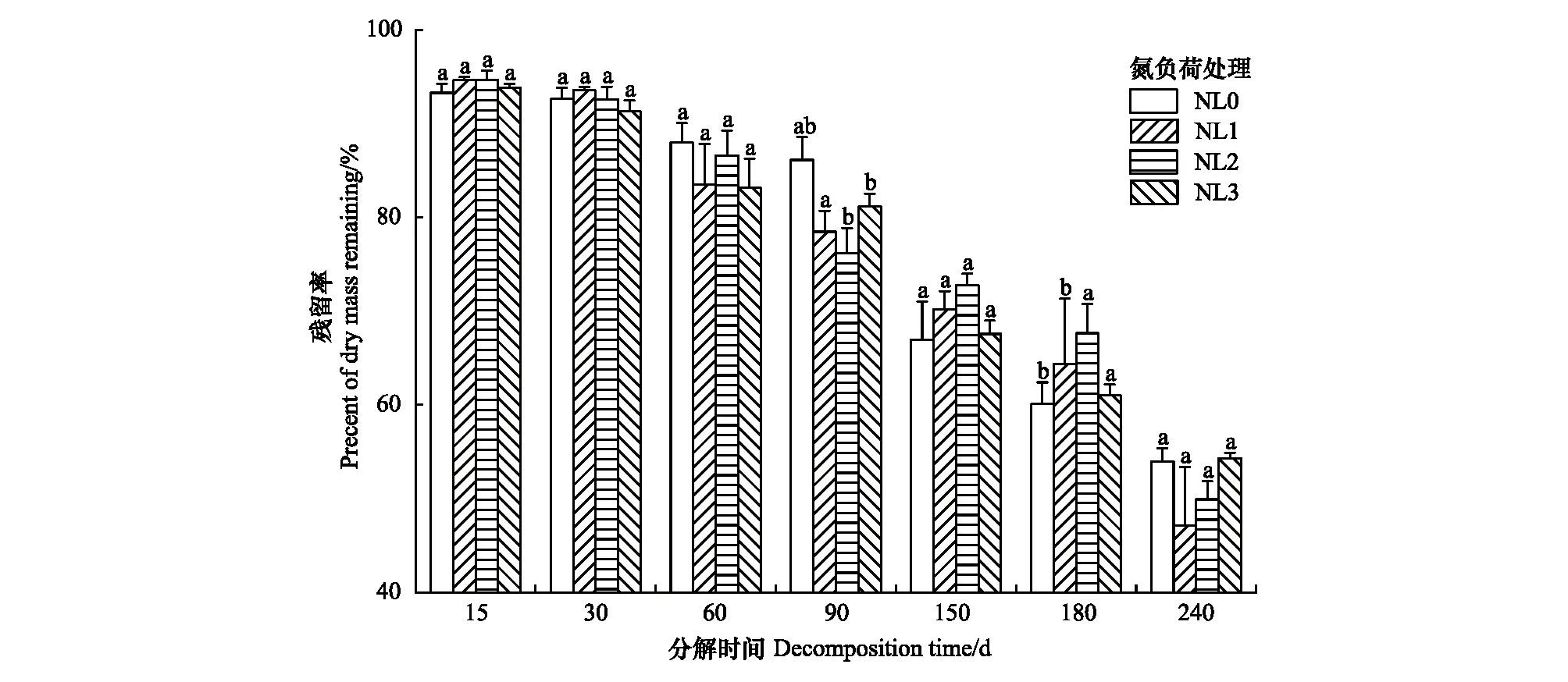
图2 不同氮负荷处理下芦苇残体残留率变化Fig.2 Variation of dry mass remaining of Phragmites australis litters in different nitrogen load treatments不同小写字母表示相同分解时期残体残留率在不同氮负荷处理间存在显著差异(P<0.05);NL0:无氮负荷处理;NL1:低氮负荷处理;NL2:中氮负荷处理;NL3:高氮负荷处理
2.2 氮负荷增强对残体养分变化的影响
2.2.1养分含量变化
尽管不同氮负荷处理下芦苇残体的TC含量在分解期间均呈不同波动变化(图3),但NL0处理下的TC含量整体低于其它处理。除第30 d外,其它分解时间的TC含量在不同氮负荷处理间均存在显著差异(P<0.05)。分解240 d后,NL0、NL1和NL3处理下的TC含量相较于初始值分别降低了2.80%、1.38%和3.13%,但NL2处理下的TC含量相较于初始值增加了0.50%。分解初期(0—30 d),残体中的TN和TP含量均呈骤然降低变化,尤其是TP含量,其在NL0、NL1、NL2和NL3处理下的降幅分别为71.84%、59.51%、63.30%和71.94%(图3)。之后至分解结束(30—240 d),TN含量呈波动上升变化(P>0.05)(图3),而TP含量整体变化不大(P>0.05)(图3)。除第150—180 d外,NL1、NL2和NL3处理下的TN含量整体均高于NL0处理,且不同氮负荷处理的TN含量在0—90 d存在显著差异(P<0.05)(图3)。与之相比,NL1、NL2和NL3处理下的TP含量在0—90 d整体高于NL0处理(P>0.05),而在90—240 d整体低于NL0处理(P>0.05)(图3)。分解240 d后,NL0、NL1处理下的TN含量较初始值分别降低了13.85%和2.23%,而NL2、NL3处理下的TN含量分别增加了11.62%和27.46%。与之不同,NL0、NL1、NL2和NL3处理下的TP含量较初始值分别降低了50.48%、54.76%、53.30%和52.72%。
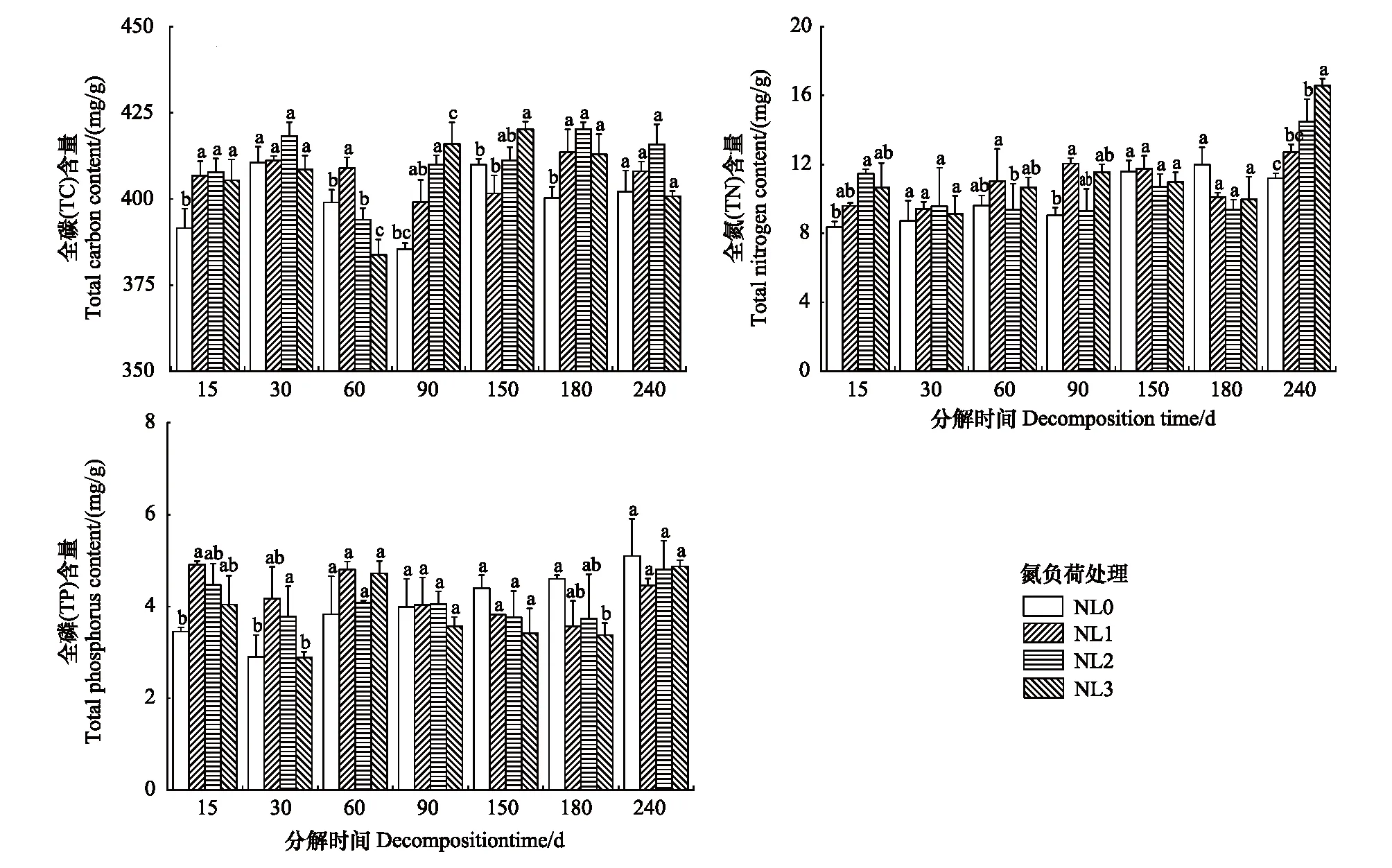
图3 不同氮负荷处理下芦苇残体中TC、TN和TP含量变化Fig.3 Variations of total carbon (TC), total nitrogen (TN) and total phosphorus (TP) contents in Phragmites australis litters in different nitrogen load treatments不同小写字母代表相同分解时期TC、TN或TP含量在不同氮负荷处理间存在显著差异(P<0.05)
2.2.2基质质量变化
不同氮负荷处理下芦苇残体的C/N和C/P变化特征与其对应的TN和TP含量变化特征正好相反(图3—图4)。残体的C/N在分解期间均呈不同波动变化,其在整体上表现为NL0>NL2>NL3>NL1(图4)。残体C/P的变化特征在0—60 d较为一致(P>0.05),之后则呈不同变化特征(P>0.05),其在分解期间整体表现为NL3>NL0>NL2>NL1(图4)。残体的N/P在分解期间均呈波动增加趋势,其在整体上表现为NL3>NL2>NL1>NL0(P>0.05)(图4)。
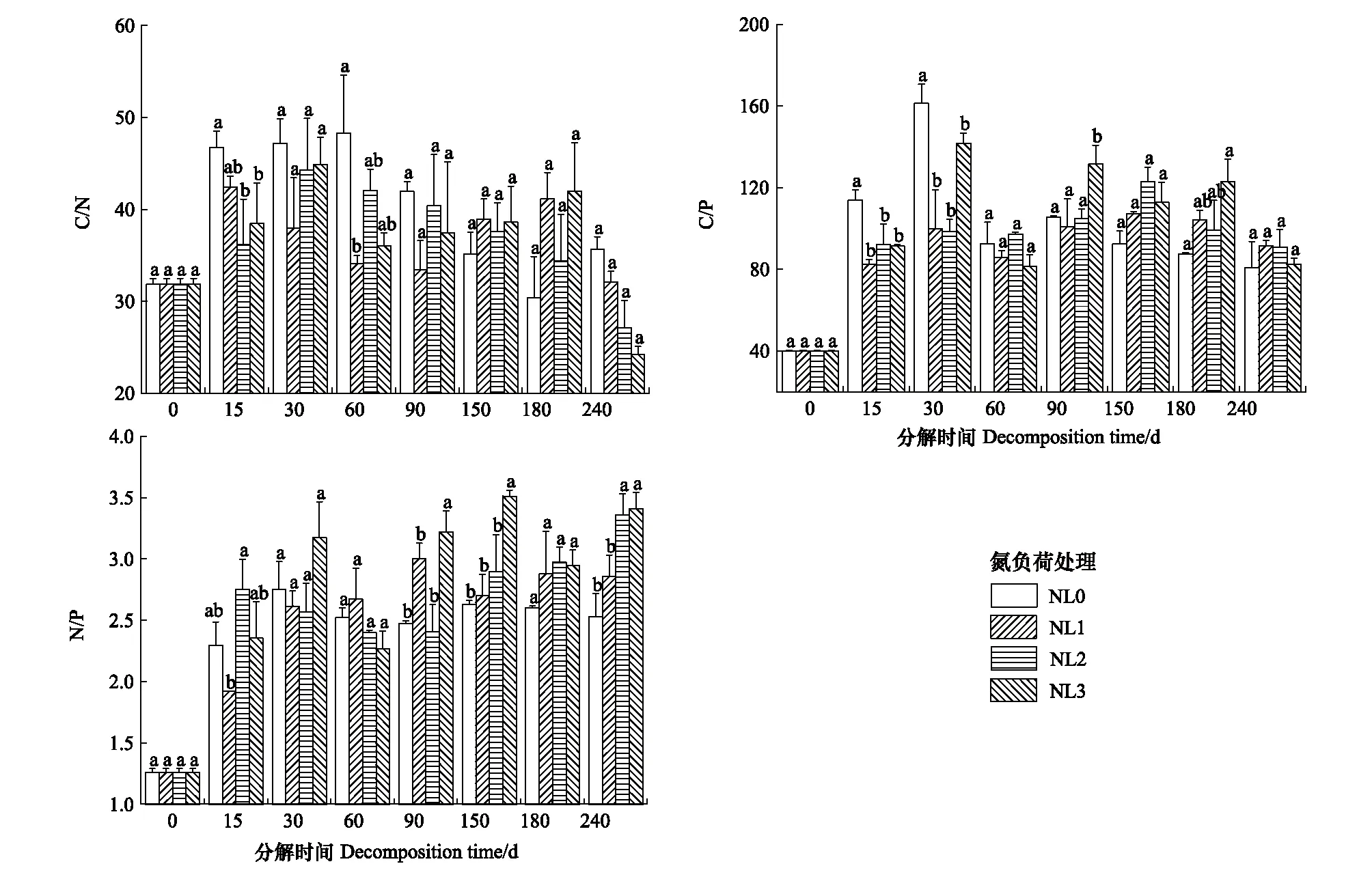
图4 不同氮负荷处理下芦苇残体基质质量变化Fig.4 Variation of substrate quality in Phragmites australis litters in different nitrogen load treatments不同小写字母代表相同分解时期C/N、C/P或N/P在不同氮负荷处理间存在显著差异(P<0.05)
2.3 氮负荷增强对残体养分释放的影响
不同氮负荷处理下残体中的C、N和P在分解期间均表现为不同程度地净释放(图5)。随着分解的进行,CAI、NAI和PAI整体均呈降低趋势,其中NAI和PAI在0—30 d的降幅尤为明显(P>0.05)。比较而言,不同氮负荷处理下的CAI在分解后期(150—240 d)存在显著差异(P<0.05),NAI在分解的第15 d、60 d和180 d存在显著差异(P<0.05),而PAI在分解的第30 d、60 d和180 d存在显著差异(P<0.05)(图5)。分解期间,NL1、NL2和NL3处理下的CAI和NAI整体高于NL0,说明氮负荷增强对残体C、N释放均存在一定的抑制。与之不同,NL1、NL2和NL3处理下的PAI在90—240 d均低于NL0,说明在分解中后期氮负荷增强整体促进了残体中的P释放。
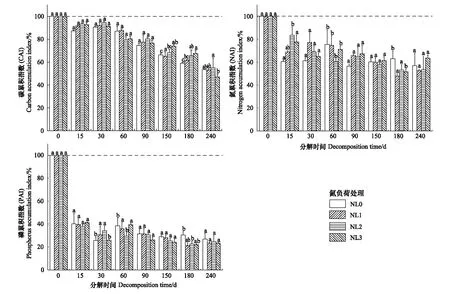
图5 不同氮负荷处理下芦苇残体CAI、NAI和PAI变化Fig.5 Variation of carbon, nitrogen and phosphorus accumulation indices (CAI, NAI and PAI) in Phragmites australis litters in different nitrogen load treatments不同小写字母代表相同分解时期CAI、NAI或PAI在不同氮负荷处理间存在显著差异(P<0.05)
3 讨论
3.1 氮负荷增强对残体分解的影响
本研究表明,低氮和中氮负荷处理整体均促进了残体的分解,而高氮负荷处理对残体分解则产生了一定的抑制。实际上,现有相关研究也得到了类似结果。Hu和Sun的研究发现,黄河口碱蓬(Suaedasalsa)残体的分解速率随外源氮输入水平的提高而明显增加,但高氮输入水平下对残体分解没有显著影响[12]。Gerdol等的研究显示,低水平氮输入对阿尔卑斯东南部泥炭藓(Sphagnum)分解的影响较小,但高水平氮输入下的分解速率则有所衰减[26]。Tao等的研究亦发现,高水平氮添加对黄河口芦苇残体分解产生了抑制[27]。另有研究表明,氮输入对残体分解的影响因输氮时长的不同而有所差异[28]。Yu等对狭叶甜茅(Glyceriaspiculosa)进行长达3 a的氮添加试验发现,较高的氮输入量在早期可促进狭叶甜茅残体中纤维素组织的降解,而在后期则会抑制其木质素组织的降解,但较低的氮输入量对其分解无显著影响[28]。Hu和Sun在黄河口对碱蓬进行1.6 a的外源氮输入试验表明,中氮输入促进了残体分解,但低氮和高氮输入对其分解无显著影响[12]。Zhang等在对小叶章(Calamagrostisangustifolia)进行5个月的研究发现,低氮添加对小叶章叶片分解几乎无影响,但中氮和高氮添加处理下其分解速率显著增加[29]。本研究的时间尺度为240 d,为短期氮输入,其所得出的中氮负荷处理可促进残体分解的结论与上述Zhang等以及Hu和Sun的相关结论相近。需要说明的是,不同氮负荷处理下芦苇残体的t0.95分别为3.19 a(NL0)、3.12 a(NL1)、2.89 a(NL2)和3.28 a(NL3),说明残体完全分解需要较长时间,本研究结果仅反映了残体在短时间尺度上的分解变化。本研究中,导致氮负荷增强对残体分解产生促进或抑制的原因可能主要有两方面。一是与不同氮负荷处理下残体基质质量在分解过程中发生明显改变有关。相关分析表明,NL0和NL3处理下的残留率与C/N均呈显著或极显著正相关(RNL0=0.894,P<0.01;RNL1=0.883,P<0.05);NL2处理下的残留率与C/N呈显著正相关(RNL2=0.813,P<0.05),与N/P呈极显著负相关(RNL2=-0.788,P<0.01),说明C/N极有可能是影响不同氮负荷处理间残体分解速率的关键因素。由于C/N可反映微生物对养分的需求状况,故常被认为是预测残体分解速率的重要指标,C/N越高,残体分解越慢,反之越快[30]。与NL0处理相比,随着氮负荷水平的提高,NL2和NL3处理下的C/N均逐渐降低。尤其是在分解前期(0—30 d),NL2处理下的C/N明显低于其它氮处理;而在分解中后期(30—240 d),其值呈持续下降趋势(图4)。可能正是由于NL2处理下残体较低的C/N,使得其在分解期间的分解速率最高。尽管NL3处理下残体的C/N在分解的第240 d最低,但其值在整个分解期间则整体高于NL1和NL2处理(图4),由此导致NL3处理下残体的分解速率相对较慢。实际上,现有大多数研究也证实了这一点。刘德燕和宋长春的研究表明,小叶章残体的C/N在氮输入条件下明显降低,由此导致其分解速率大于未输氮的小叶章残体[30]。陈冰冰等的研究亦表明,持续氮输入条件下碱蓬残体的分解速率均高于对照处理,原因主要与持续氮输入导致C/N明显降低有关[31]。二是与不同氮负荷处理下残体分解过程中非生物因子的改变有关。相关分析显示,不同氮负荷处理下的残留率与pH均存在负相关关系,其中NL1和NL2处理下二者的相关性还达到了显著水平(RNL1=-0.775,P<0.05,RNL2=-0.760,P<0.05),说明pH可能是影响不同氮负荷处理间残体分解速率的主要非生物因素。已有研究表明,pH是影响微生物群落的关键因子,分解环境中过高或过低的pH均会对微生物活性产生抑制作用,进而可降低残体的分解速率[32]。Leuven和Wolfs的研究还发现,pH主要通过影响真菌和细菌在分解环境中的活性而显著影响灯心草(Juncusbulbosus)残体的分解速率[33]。本研究中,NL1和NL2处理下表层土壤的pH相对于NL0处理均较低,且在不同分解阶段pH均随氮负荷水平的增加而升高(图6)。尤其是二者残留率与pH存在的显著负相关关系表明,低氮和中氮负荷处理下的pH极有可能处于微生物活性较高的范围内,而pH的小幅增加在一定程度上又促进了残体的分解。Boer等的研究也表明,提高酸性土壤中的pH能够促进土壤中细菌的生长,从而刺激有机质的分解[34]。相对于NL0处理,NL3处理下的pH在不同分解阶段的变化幅度较大(图6),加之其残留率与pH之间的负相关关系并不显著,说明该处理下的pH极有可能对微生物的活性产生了一定的抑制作用,从而降低了残体的分解速率。
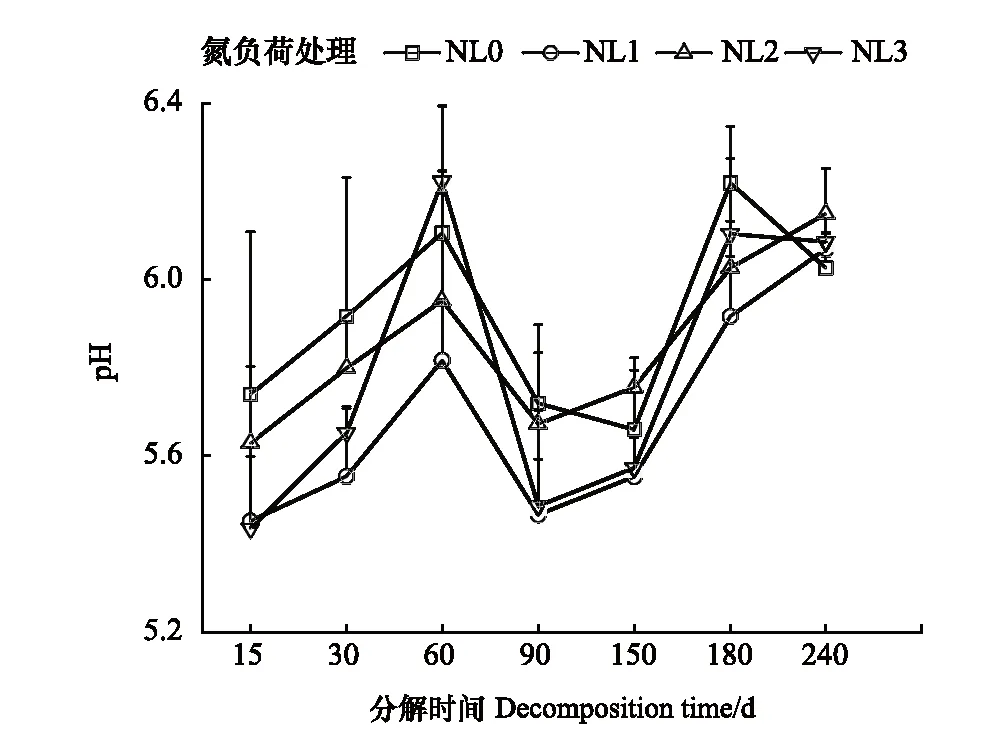
图6 不同氮负荷处理下残体分解期间表层土壤pH变化 Fig.6 Variations of pH in topsoil in different nitrogen load treatments during decomposition
3.2 氮负荷增强对残体养分含量及其释放的影响
本研究表明,不同氮负荷处理下残体中的TC含量均呈不同波动变化特征(图3)。除NL0处理下的TC含量与N/P存在显著正相关关系(P<0.05)以及NL3处理下的TC含量与含水量存在极显著负相关关系外(P<0.01),其它因子与不同处理下的TC含量均不存在显著相关性(P>0.05)(表3),说明影响不同氮负荷处理下残体中TC含量变化的因素可能较为复杂。Sun等对黄河口芦苇、碱蓬和盐地碱蓬(Suaedaglauca)残体分解的相关研究中亦得到了类似结论[16]。本研究还表明,不同氮负荷处理下残体中的TN含量在分解初期(0—30 d)均呈骤然降低变化,之后至分解结束(30—240 d)整体呈波动上升变化(图3)。其中,分解初期残体中TN含量的降低主要与淋溶过程导致的大量可溶解性氮养分释放有关。秦胜金等的研究亦表明,三江平原小叶章残体在分解初期由于淋溶过程导致残体中的氮含量快速下降[17]。Wrubleski等的研究还表明,正是由于分解初期香蒲(Typhaglauca)和芦苇残体中大量可溶性蛋白质的淋失导致了残体中氮含量的骤然下降[35]。随着分解的进行,不同氮负荷处理下残体中TN含量的波动上升主要取决于两方面原因:一是与氮负荷增强条件下微生物从分解环境中固持氮养分而激发活性,从而促进了残体中非氮物质的分解有关[12]。此过程可导致残体的C/N下降,由此使得其是调控不同氮负荷处理下残体分解过程中TN含量变化的主控因素。实际上,相关分析的确显示,不同氮负荷处理下残体的TN含量与C/N均存在显著或极显著负相关关系(P<0.05或P<0.01)。Kuehn和Suberkropp的研究亦表明,分解过程中多叶灯笼草(Juncuseffusus)叶片中TN含量的增加主要与C/N下降有关[36]。Smaill等的研究还表明,氮输入条件下辐射松(Pinusradiata)凋落物中的TN含量增加与凋落物C/N的降低密切相关[37]。二是与不同氮负荷处理下分解有机物对环境中氮养分的较强物理吸附作用有关。已有研究表明,残体在分解过程中可通过物理吸附作用而在分解环境中吸附大量氮养分,从而使得残体中的TN含量出现阶段性的升高[38]。在此过程中,残体残留量可直接影响养分的物理吸附量,由此使得残留率可能也是影响不同氮负荷处理下残体分解过程中TN含量变化的重要因素。这一推测可被相关分析所部分证实,即NL0和NL3处理下残体中的TN含量与残留率均存在显著或极显著负相关关系(P<0.05或P<0.01)(表3)。本研究中,NL1和NL2处理下的残留率整体低于NL0处理(图2),故理论上其TN含量也应相对较低,但实际上其值却高于NL0处理。原因主要与上述氮负荷增强条件下参与分解微生物对环境中氮养分的固持作用较强,其在一定程度上掩盖了分解有机物的物理吸附作用有关。此外,NL2处理下残体中的TN含量还与N/P存在显著正相关关系(P<0.05)(表3)。陈冰冰等在研究短叶茳芏的短期分解中也得到了类似结论,即残体的TN含量与N/P存在正相关关系[1,18]。与其它处理相比,NL3处理下的残留率相对较高(图2)。尽管NL3处理下的氮负荷水平最高,分解有机物可能吸附更多的氮养分,但由于其残留率与TN含量存在显著负相关关系(P<0.05)(表3),所以该处理在分解中后期的TN含量升高可能更取决于微生物的固持作用。由于NL0处理没有额外的氮输入,故其残体在分解过程中可被物理吸附或微生物固持的氮养分也相对有限,由此导致其TN含量在分解期间一直较低(图3)。
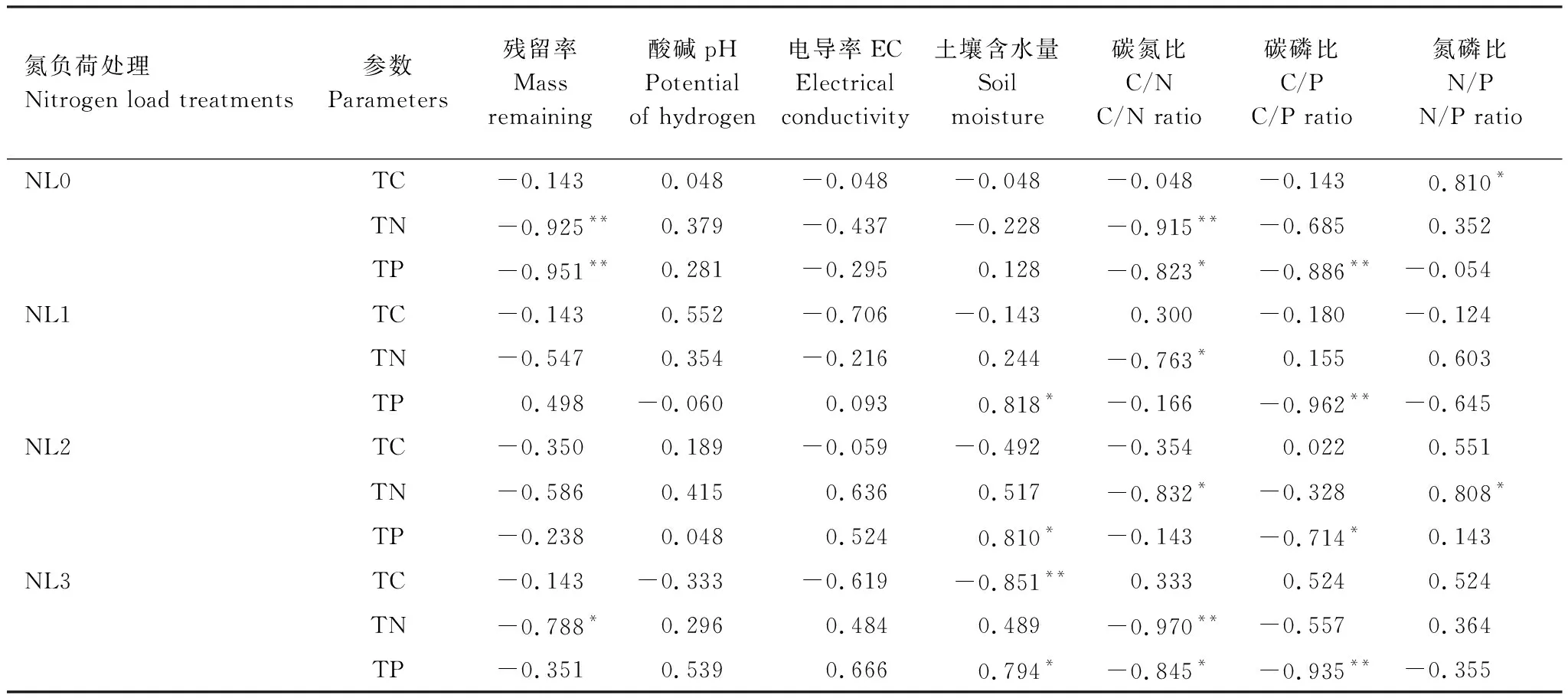
表3 不同氮负荷处理下残体养分与主要因子的相关关系Table 3 Correlations between nutrient parameters and key factors in different nitrogen load treatments
本研究还表明,不同氮负荷处理下残体中的TP含量在分解初期(0—30 d)亦呈骤然降低变化,但之后至分解结束(30—240 d)整体呈小幅波动变化(图3)。与TN相似,分解初期残体中TP含量的降低也主要与淋溶阶段导致的可溶性磷养分释放有关[17]。由于P养分在残体中主要以磷酸根离子或化合物的形态存在,故更易因淋溶作用而大量流失[1,17],由此导致TP含量在分解初期骤然降低(图3)。相关分析表明,不同氮负荷处理下残体中的TP含量与C/P均呈显著或极显著负相关(P<0.05或P<0.01),而NL1、NL2和NL3处理下的TP含量均与土壤含水量呈显著正相关(P<0.05)。另外,NL0处理下的TP含量还与残留率或C/N呈显著或极显著负相关(P<0.05或P<0.01)(表4)。本研究中,由于不同氮负荷处理下的土壤含水量相当且不存在显著差异(P>0.05)(表1),故C/P是调控不同处理下残体分解过程中TP含量变化的关键因素。实际上,已有相关研究也得到类似结论[34]。本研究中,NL1、NL2和NL3处理下残体中TP含量在0—60 d整体高于NL0处理(图3),原因主要与氮负荷增强背景下残体分解过程中氮磷养分失衡导致的磷相对缺乏有关。已有研究表明,闽江河口湿地(尤其是芦苇湿地)主要受N养分限制[18],而在受氮限制的湿地环境中,残体分解过程中氮养分的持续增加往往会导致磷养分的相对缺乏[39],由此导致微生物对分解环境中磷养分的固持量增加。这一推测可为图4中该时期C/P的整体降低所证实。正是如此,导致该时期氮负荷处理下残体中的TP含量整体较高,同时也侧面说明了上述残体中的TP含量与C/P的密切关系。本研究中,NL1、NL2和NL3处理下残体中的TP含量在90—240 d整体低于NL0处理(图3),原因主要是在氮养分负荷持续增强条件下,残体中过多的P养分又可能抑制微生物的活性[18],由此使得P养分又不断向分解环境中释放,导致残体中的TP含量降低。

表4 不同氮负荷处理下残体养分累积指数(y)与主要因子(x)之间的回归方程Table 4 Regression equations between nutrient accumulation index (y) and key factors (x) in different nitrogen load treatments
本研究亦表明,不同氮负荷处理下残体的CAI、NAI或PAI在分解期间均具有不同的变化特征,氮负荷增强对C、N释放均存在一定的抑制,但对分解中后期的P释放则存在一定的促进(图5)。逐步线性回归分析显示(表4),NL0处理下的CAI变化主要受残留率(x1)的影响(R2=0.942),而PAI变化主要受N/P(x7)的影响(R2=0.624)。在NL1处理下,残留率(x1)均是影响CAI、NAI或PAI变化的主要因素,其对三者变化的解释贡献分别为96.2%、83.8%和77.1%。在NL2处理下,CAI(R2=0.962)和PAI(R2=0.743)的变化均主要受残留率(x1)的影响,而NAI变化主要受残留率(x1)和C/N(x5)的共同影响(R2=0.942)。对于NL3处理,残留率(x1)、pH(x2)、C/N(x5)和C/P(x6)共同影响着CAI的变化(R2=0.998),而EC(x3)主要影响着PAI的变化(R2=0.804)。可见,不同氮负荷处理下的残体养分释放主要取决于残留率,而氮负荷增强引起的残体基质质量(C/N、C/P、N/P)和主要环境因子(pH、EC)改变是导致不同处理间养分释放存在差异的重要原因。
4 结论
(1)不同氮负荷处理下残体的分解速率表现为NL2(0.00284 d-1)>NL1(0.00263 d-1)>NL0(0.00257 d-1)>NL3(0.00250 d-1),说明低氮和中氮负荷总体促进了残体分解,而高氮负荷抑制了残体分解,原因主要与不同处理下残体分解过程中基质质量及pH的明显改变有关。
(2)不同氮负荷处理下,残体中的TC含量在分解期间均呈不同波动变化特征。TN和TP含量在分解初期(0—30 d)均骤然降低;之后至分解结束(30—240 d),前者呈波动上升变化,后者则呈小幅波动变化。
(3)不同氮负荷处理下的残体养分释放主要取决于残留率,而氮负荷增强引起的残体基质质量(C/N、C/P、N/P)和主要环境因子(pH、EC)改变是导致不同处理间养分释放存在差异的重要原因。
(4)氮负荷水平的增加整体抑制了残体C、N养分的释放,但其在分解中后期(90—240 d)对P养分释放具有较为明显的促进作用,说明氮负荷增强背景下残体的养分归还量将发生明显改变。

